Розуміння дієтологічної терапії при запальних захворюваннях кишечника
Дата публікації: 28.09.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: запалення, дієта, неспецифічний виразковий коліт, хвороба Крона, кишечник, харчові добавки, суміш
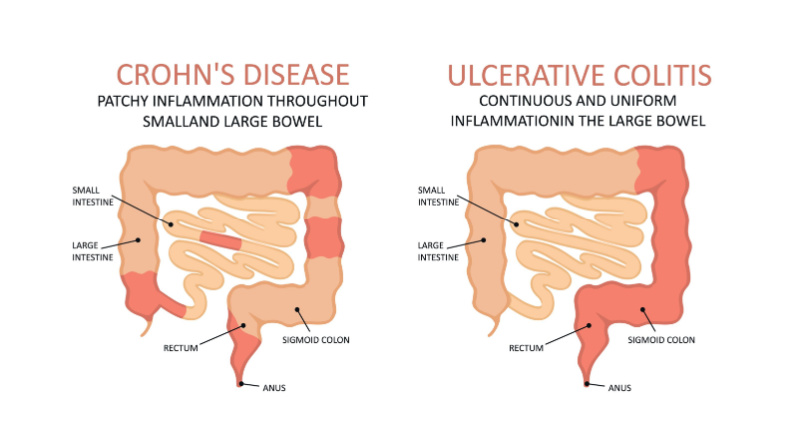
Запальне захворювання кишечника (ЗЗК) — це сукупність хронічних запальних захворювань шлунково-кишкового тракту, включаючи виразковий коліт (ВК) і хворобу Крона (ХК), які характеризуються періодами ремісії та загострення захворювання. Запальний процес, що спостерігається при ВК, є безперервним і обмежується слизовою оболонкою товстої кишки, тоді як на відміну від нього; ХК характеризується трансмуральним запаленням і пропускаючими ураженнями, розташованими в будь-якому відділі шлунково-кишкового тракту. І ХК, і ВК, незважаючи на численні відмінності, мають схожі симптоми, включаючи біль у животі, діарею, позакишкові прояви та недостатнє харчування.
Патогенез гіпотрофії при ЗЗК багатофакторний. Хронічний дефіцит харчування, ймовірно, є вторинним стосовно недостатнього споживання калорій і збільшення витрат енергії під час хронічних і рецидивуючих запальних уражень. Крім того, фармакологічне та хірургічне лікування може погіршити травлення та всмоктування поживних речовин через різні взаємодії між ліками та поживними речовинами та зменшення абсорбційної площі кишечника внаслідок хірургічних резекцій. З усім тим, прямі інгібуючі ефекти прозапальних медіаторів, що виділяються із запаленої тканини, також дуже важливі для стану гіпотрофії.
Лікування ЗЗК включає фармакологічне, дієтичне та хірургічне лікування. Основною метою лікування є індукція та підтримка ремісії, корекція аліментарної недостатності та профілактика ускладнень.
Дієтичну терапію можна проводити шляхом ентерального (ЕХ) або парентерального харчування (ПХ). Крім того, дієтологічне лікування можна розділити на основну та підтримуючу терапію. Метою першого є індукція та підтримка ремісії, а другого — підтримка тривалого ефекту медикаментозної терапії. ПХ може бути альтернативним методом харчування для ентерального прийому поживних речовин у пацієнтів із ЗЗК, головним чином використовується для тих, хто має протипоказання або непереносимість ЕХ, особливо коли є симптоми важкої недостатності харчування. Повне парентеральне харчування (ППХ) також може застосовуватися під час гострої запальної фази (обструкція, токсичний мегаколон та активні нориці) у передопераційному періоді та у пацієнтів із синдромом короткої кишки (СКС) через попередні великі резекції кишки.
Показання до ЕН при лікуванні ЗЗК включають ексклюзивне ентеральне харчування (ЕЕН) при активному захворюванні, додаткове ЕН для підтримки ремісії захворювання та нутритивну підтримку для досягнення адекватного збільшення ваги та росту. Лікування ЕН є більш ефективним для досягнення клінічної ремісії у дітей із ЗЗК, ніж у дорослих. Недавній метааналіз клінічних випробувань показав, що ефективність ЕЕХ може бути порівняна з ефективністю кортикостероїдної терапії. EЕХ знижує активність захворювання та сприяє загоєнню слизової оболонки у пацієнтів із ЗЗК, але механізм дії цієї терапії все ще недостатньо вивчений.
Дієтичні чинники в етіології ЗЗК
Добре відомо, що молекулярна основа ЗЗК пов’язана з імунологією Т-клітин. Більшість популярних теорій припускають, що Т-клітини активуються через злиття генетичних факторів і факторів навколишнього середовища, які породжують імунний дисбаланс, що призводить до запалення, характерного для цих захворювань. Зв’язок неправильної активації Т-клітин з дієтою або пов’язаними з дієтою факторами все ще не є добре встановленою теорією. Кілька харчових факторів ризику були запропоновані з раннього початку життя.

Грудне вигодовування
Кілька останніх досліджень показали захисну роль грудного вигодовування від ризику ЗЗК. Дослідження в Новій Зеландії за участю відносно великої групи учасників показало, що грудне вигодовування має захисний ефект проти ЗЗК зі співвідношенням «тривалість-відповідь». Механізм, за допомогою якого грудне вигодовування захищає від ЗЗК, точно невідомий. Годування в перші місяці життя має вирішальне значення для розвитку мікрофлори кишечника. Мікробіом кишечника стимулює вроджений і набутий імунітет, сприяє дозріванню імунної системи слизової оболонки та цілісності слизової оболонки, а також розвиває толерантність до харчових антигенів. Деякі автори відводять особливу роль у цьому процесі лактоферину. Цей пептид, присутній тільки в жіночому молоці (відсутній у сумішах), має протизапальні, антибактеріальні та противірусні властивості.
Вуглеводи в раціоні
Кілька досліджень у Данії показали, що високе споживання легкозасвоюваного цукру підвищує ризик загального ЗЗК. Однак інше дослідження показало, що дієта з високим вмістом клітковини захищає від ризику ХК, але не від ВК. Клітковина також має протизапальні властивості та позитивно модулює внутрішній мікробіом. Клітковина ферментується шляхом колонізації бактерій у коротколанцюгові жирні кислоти. Ці жирні кислоти активують рецептор γ, що активується проліфератором пероксисом, ядерний фактор транскрипції з протизапальною дією. Засвоєнню цукру в раціоні змінюють мікробіом кишечника, збільшуючи поширеність Prevotella, тоді як білок і тваринний жир у раціоні викликають збільшення Bacteroides.
Крохмаль, один із найважливіших вуглеводів, присутніх у раціоні людини, також сильно впливає на мікробіом. Це необхідний субстрат для кишкових бактерій, особливо для сприяння розвитку мікробів Klebsiella. Оскільки рівні антитіл проти клебсієли були високими у хворих на ХК, існує теорія, що види клебсієли є важливим фактором індукції аутоімунологічних реакцій через механізм молекулярної мімікрії. Сильна позитивна кореляція та перехресно-реактивні антитіла спостерігалися між клебсієлою та колагеном у хворих на ХК та анкілозуючий спондиліт. Крім того, «дієта з низьким вмістом крохмалю», яка використовувалася у пацієнтів з анкілозуючим спондилітом, знизила рівень медіаторів запалення та зменшила клінічні симптоми захворювання.
Нещодавно були опубліковані цікаві дослідження щодо використання «специфічної вуглеводної дієти» (СВД) у дітей з ХК. СВД, яка спочатку використовувалася для лікування целіакії майже 70 років тому, містить мигдальне, горіхове та кокосове борошно та виключає зернові (пшениця, рис, кукурудза). Крім того, заборонено більшість молочних продуктів, за винятком кислого йогурту, а єдиним дозволеним цукром є фруктоза (мед). Два невеликих незалежних ретроспективних дослідження США, які оцінювали СВД як єдиний метод лікування у дітей із ХК, показали, що застосування ССД протягом 5–30 (або 12–52 відповідно) місяців мало позитивний вплив на лабораторні маркери запалення та клінічні прояви захворювання. захворювання, включаючи загоєння слизової. Пряма причина покращення не була відома, але найімовірнішою причиною була модифікація мікробіому кишечника. Тим не менш, для підтвердження цих попередніх результатів необхідні проспективні дослідження.
Жир в раціоні
Протягом багатьох років було відомо, що високе споживання тваринного жиру пов’язане з підвищеним ризиком ВК. Значну увагу приділено ролі ненасичених жирних кислот у патогенезі ЗЗК. Дієта, багата оливковою олією та рибою, а також овочами, фруктами, злаками та горіхами, була обернено пов’язана з ХК в обох статей. Збільшення споживання ω-6 поліненасичених жирних кислот (ПНЖК, яловичина, свинина, кукурудза, соняшникова олія та поліненасичені маргарини) замість ω-3 ПНЖК (риба) було пов’язане з підвищеною частотою ЗЗК. Високе споживання ω-6 ПНЖК лінолевої кислоти було пов’язане з більшим ризиком розвитку ВК залежно від дози. Цей зв’язок спостерігався в обох статей, але він був достовірним лише у жінок. З іншого боку, високе споживання ω-3 ПНЖК докозагексаєнової кислоти було пов’язано з меншим ризиком розвитку ВК. Дія насичених і ненасичених жирів може бути реалізована через модуляцію Toll-подібних рецепторів у макрофагах.
Деякі дані пов’язують споживання жиру з дисбактеріозом. Захворюваність на коліт помітно зросла у мишей з дефіцитом інтерлейкіну (IL)-10, яких годували молочним жиром, але не у нормальних мишей або мишей з дефіцитом IL-10, які отримували поліненасичені жири.
Білки та алергени
Роль споживання білка в етіології ЗЗК є суперечливою. У французькому дослідженні високе загальне споживання білка, зокрема білка тваринного походження, було пов’язане зі значно підвищеним ризиком розвитку ЗЗК у майбутньому житті. Велике споживання м’яса або риби вважалося фактором ризику, але велике споживання яєць або молочних продуктів не було пов’язане з підвищенням захворюваності. Німецьке дослідження близнюків показало, що велике споживання обробленого м’яса, включаючи ковбаси, було пов’язане з підвищеним ризиком ХК, а також ВК. У нещодавніх дослідженнях було показано, що алергія на білок коров’ячого молока в дитинстві була пов’язана з ХК у пізньому дитинстві.
Альтернативне пояснення може бути пов’язане з інфекцією Mycobacterium avium subspecies paratuberculosis (MAP), яка бере участь у патогенезі багатьох захворювань, включаючи ЗЗК. MAP широко поширений у навколишньому середовищі, воді та їжі. Деякі поживні речовини, такі як молоко, м’ясо та цукор, можуть посилити його інвазивність.
Мікроелементи та вітаміни
Магній, вітамін С і фрукти були негативно пов’язані з ризиком розвитку ЗЗК, тоді як позитивний зв’язок був виявлений для ретинолу. Споживання калію та споживання овочів показали негативний зв’язок лише з ризиком ХК. Експерименти на тваринних моделях показали значну роль дефіциту селену в патогенезі ЗЗК, оскільки він є кофактором протизапальних білків, але кореляції не було виявлено у випадку фолатів. Вітамін D також важливий для розвитку ЗЗК. Дані, отримані на мишачій моделі коліту, показали, що 1,25(OH)2D3 або дефіцит рецептора вітаміну D викликає дисбактеріоз, що призводить до підвищення сприйнятливості до шлунково-кишкового ушкодження. З іншого боку, підвищене споживання вітаміну D захищало від ЗЗК на тваринній моделі та у людей, але лише від ХК.
Консерванти та добавки в харчові продукти
Збільшення харчової сірки є результатом її використання як консервуючої харчової добавки. Ця добавка пов’язана зі збільшенням кількості випадків ВК, і припускають, що сірка може бути токсичною для колоноцитів людини після її метаболізму кишковими бактеріями до сірководню (H2S). Було показано, що полісахаридна дієтична добавка мальтодекстрин погіршує клітинні антибактеріальні реакції та пригнічує кишкові протимікробні захисні механізми, що може призвести до виникнення ЗЗК.
Мікрочастинки, такі як діоксид титану, силікати алюмінію та тальк, можуть діяти як транспортери антигену з просвіту кишечника до слизової оболонки, і їх пов’язують із розвитком ХК. Силікати алюмінію використовуються як допоміжні засоби проти кислот, а алюмосилікат натрію та тальк (E-553b) додають до порошкоподібних продуктів для запобігання утворенню грудочок. Діоксид титану — барвник харчових продуктів і зубних паст (Е171). Ці мікрочастинки поглинаються спеціалізованими М-клітинами, але не розкладаються та накопичуються в макрофагах і лімфоїдній тканині та індукують секрецію прозапальних IL-1β та IL-18. Оскільки ад’юванти полегшують взаємодію слизової оболонки з антигенами, вони порушують місцеву імунну систему. Багато інших речовин із зубної пасти, ймовірно, пов’язані з етіологією ЗЗК. Трикальційфосфат і кварц (абразиви) на тваринних моделях проникали в епітелій і створювали кишкові ураження, подібні до тих, що виникають при хворобі Крона. Крім того, карагенани, які широко використовуються в харчових продуктах і зубних пастах через їх гелеутворюючі, згущувальні та стабілізуючі властивості, пошкоджували ентероцити на тваринних моделях у спосіб, типовий для ЗЗК у людей.
Напої
Високе споживання рідини було негативно пов’язане з ризиком ЗЗК. Крім того, зелений чай і кава знижують ризик розвитку ЗЗК в азіатських і австралійських популяціях. Щоденне споживання чаю було пов’язане зі зниженим ризиком ХК, тоді як щоденне вживання чаю і споживання кави були пов’язані зі зниженим ризиком ВК. У дослідженні in vitro кофеїн полегшив прояви гострого коліту в епітеліальних клітинах кишечника. Зелений чай багатий поліфенолами — антиоксидантами, які послаблюють тяжкість коліту на тваринній моделі. Подібний захисний механізм постулюється у випадку споживання вина. Однак вино також містить діоксид сірки, який діє як потенційний негативний фактор. Дієта та напої є головним модифікованим впливом на мікробіом, але також є джерелом мікроорганізмів. Було виявлено, що вода є шляхом передачі кількох патогенів, пов’язаних із ЗЗК.
Роль харчування при ЗЗК
Неправильне харчування
Недоїдання є поширеним явищем серед пацієнтів із ЗЗК, і його можна розпізнати за білково-енергетичною недостатністю, зміненим складом тіла та дефіцитом мікроелементів. Недоїдання є одним із найважливіших факторів, пов’язаних із поганим результатом у пацієнтів із ЗЗК. Найбільш поширеним типом у дорослих пацієнтів із ЗЗК є білково-енергетична недостатність, яка переважно розглядається як втрата ваги. У недавньому румунському дослідженні поширеність недоїдання на основі індексу маси тіла (ІМТ) у пацієнтів із ЗЗК була встановлена як 30,6%. Рівень пацієнтів, які страждають від білково-енергетичної недостатності, був значно вищим серед пацієнтів із ЗЗК, ніж серед випадків без ЗЗК, як для пацієнтів із ХК, так і для пацієнтів з НВК.

Несподівано висока частка пацієнтів із ЗЗК (переважно пацієнтів з ВК) мають надлишкову вагу. Недавнє дослідження в Сполучених Штатах показало, що поширеність ожиріння у пацієнтів із ЗЗК відображає індекс ожиріння в загальній популяції. Дуже багатообіцяючим спостереженням є те, що клінічні результати у пацієнтів із ожирінням кращі, ніж у пацієнтів без ожиріння з ЗЗК, а ожиріння (визначене за допомогою індексу ІМТ) є маркером менш тяжкого перебігу захворювання при ЗЗК. Відносно високий відсоток пацієнтів з ожирінням під час встановлення діагнозу може бути пов’язаний зі збільшенням ожиріння серед загальної популяції, що супроводжується раннім розпізнаванням ЗЗК.
ЗЗК іноді розвивається у пацієнтів, які раніше лікувалися від ожиріння. Деякі хірургічні втручання, такі як шунтування шлунка, можуть призвести до серйозної недостатності харчування у випадку ЗЗК у більш пізньому віці.
Зміни складу тіла
Безжирова маса тіла: вага та ІМТ є дуже поверхневими факторами в аналізі стану харчування. Тому часто проводяться глибокі вимірювання відділів тіла. Як правило, безжирова маса тіла у пацієнтів із ЗЗК нижча, ніж у здорової популяції. Недавнє дослідження показало, що зменшення м’язової маси спостерігалося у 21% дорослих пацієнтів із ЗЗК. Крім того, у систематичному огляді аналізу дорослих пацієнтів із ЗЗК до 2013 року наведено схожі дані. Незалежно від використовуваної методології, у дорослих пацієнтів із ЗЗК спостерігалося зменшення маси без жиру у 28% випадків ХК та 13% випадків НВК порівняно зі здоровими особами контролю. Не було виявлено стійкого зв’язку між складом тіла та активністю захворювання, тривалістю, масштабом або терапією. Кілька досліджень показали, що безжирова маса також була зменшена у дітей із ЗЗК порівняно з контрольною групою.
Маса жиру: у нещодавньому систематичному огляді було виявлено, що маса жиру не відрізняється статистично у 66% пацієнтів з ХК і у 75% пацієнтів з ВК порівняно з контрольною групою. 31% пацієнтів з ХК і 13% пацієнтів з ВК показали статистично значуще зменшення жирової маси. Розподіл жиру, особливо жиру, локалізованого навколо просвіту кишечника, вважається патогномонічним, а також патогенним фактором для ЗЗК. Жир, що накопичується навколо тонкої або товстої кишки, називається «чепцем». При ХК типовим є жир, що оточує понад 50% окружності кишки. Крім того, припускають, що прозапальні та модулюючі імунну систему адипокіни, що виділяються цією жировою тканиною, відіграють значну роль в етіопатогенезі захворювання.
Кісткова маса: остеопенія та остеопороз є поширеними ускладненнями ЗЗК і вражають майже кожного другого пацієнта. Існує кілька розбіжностей щодо впливу віку, статі, локалізації уражень. Ранній початок ЗЗК (до 30 років) є фактором ризику для глибокого зниження мінеральної щільності кісткової тканини порівняно з пацієнтами, яким діагностовано в літньому віці. Проте вік старше 50 також є фактором ризику остеопенії та остеопорозу. Нещодавнє італійське дослідження показало, що у нещодавно діагностованих пацієнтів із ЗЗК остеопороз і остеопенія спостерігалися переважно у пацієнтів чоловічої статі старше 30 років (63%) та у молодих жінок (62%). Крім того, нещодавнє дослідження в Словаччині показало, що пацієнти з ХК із клубовою/ілеоколічною локалізацією та анамнезом проктоколектомії/тотальної колектомії мають вищий ризик розвитку остеопорозу, ніж інші пацієнти з ЗЗК.
Найпопулярнішим поясненням втрати мінеральної кісткової матриці є мальабсорбція кальцію та вітаміну D, а також побічні ефекти лікування, головним чином від тривалого систематичного прийому стероїдів. Біологічна терапія пов’язана з кращими результатами щодо мінеральної щільності кісткової тканини. Останні дослідження пов’язують мінеральну щільність кісткової тканини при ЗЗК із генетичними факторами. Було також припущено, що адипокіни, а також медіатори запалення втручаються в баланс між остеобластами та остеокластами.
Дефіцит вітамінів і мікроелементів: у пацієнтів із ЗЗК зазвичай не спостерігається явних симптомів дефіциту вітамінів або мікроелементів. Найбільш детальні дослідження були проведені щодо вітаміну D як фактора ризику зниження мінеральної щільності кісткової тканини. Суперечливі результати цих досліджень, здається, залежать від різних досліджуваних етнічних груп, які проживають на різних широтах з різним впливом сонячного світла, різними граничними показниками дефіциту вітаміну D і різними методами, що використовуються для вимірювання вітаміну.
Сприятливий ефект добавок вітаміну D пов’язаний з його імуномодулюючою роллю при ЗЗК. У пацієнтів із ЗЗК рівень вітаміну D сильно обернено корелює із запаленням кишечника. Моделі на тваринах показали, що підвищене споживання вітаміну D запобігає раку товстої кишки, пов’язаному із запаленням. Крім того, добавки вітаміну D і рівні вітаміну D у плазмі корелювали з якістю життя пацієнтів з ВК і ХК протягом зимового/весняного періоду в країнах Центральної Європи.
Іншим типовим ускладненням ЗЗК є анемія. Деякі розбіжності в різних звітах є результатом двох різних механізмів анемії (залізодефіцитної анемії та анемії хронічних захворювань) і різних порогових значень для діагностичних рівнів гемоглобіну та інших маркерів анемії, таких як феритин, трансферин або гепсидин. Анемія пов’язана з дефіцитом заліза, цинку, міді, фолатів і вітаміну В12. Відповідно до нещодавнього огляду та метааналізу даних про понад 2000 пацієнтів із європейських країн, загальна поширеність анемії у пацієнтів із ЗЗК становила 24%, а в 57% випадків це була залізодефіцитна анемія. Дефіцит цинку у дітей із ЗЗК є відносно поширеним — вражає 40% пацієнтів — особливо в порівнянні з дефіцитом у здорової популяції відповідного віку (19%). Селен є ще одним поживним мікроелементом з антиоксидантними властивостями, але він не відрізнявся у дітей із ЗЗК порівняно зі здоровою контрольною групою. У дорослих концентрація селену була значно нижчою у пацієнтів з ВК, ніж у контрольній групі. Дивно, але середня концентрація міді в сироватці крові була вищою у дітей із ХК порівняно з пацієнтами відповідного віку, які страждають на ВК, або у контрольній групі. Дорослі хворі на ХК і на ВК мали вищі рівні міді, ніж у контрольній групі. Статевих відмінностей не спостерігалося, але чоловіки з панколітом мали значно вищі рівні міді, ніж чоловіки з проктитом.
Таким чином, харчування є ключовим фактором при ЗЗК — воно бере участь у патогенезі та лікуванні цих захворювань. Харчування при ЗЗК все ще є проблемою для пацієнтів і для медичного обслуговування. Останні статті показали, що знання пацієнтів у цьому питанні відносно слабкі та потребують вдосконалення. Крім того, збільшення кількості дітей із ЗЗК відкриває нову главу в науці про харчування. У цих випадках харчування має забезпечувати правильний розвиток, а також сприяти ремісії захворювань.
Ентеральне харчування при ЗЗК
Вже понад 40 років ентеральне харчування використовується в дієтологічній терапії ЗЗК. З початку 1970-х років, коли були показані перші первинні терапевтичні ефекти елементарної дієти у хворих на ХК, було проведено численні дослідження щодо ЕХ. Спостережуваний терапевтичний ефект був різним залежно від типу ЗЗК (ХК проти ВК), віку пацієнтів, їх клінічних проявів та супутнього лікування.
Загалом EЕХ — це забезпечення 100% харчових потреб людини за допомогою рідкої харчової суміші перорально або через зонд. EЕХ зазвичай надається протягом 6-8 тижнів, а потім поступово відновлюють нормальний режим харчування.
Протоколи EЕХ можуть відрізнятися за складом ентеральної суміші та шляхом введення. У EЕХ використовуються три основних типи ентеральних сумішей залежно від ступеня гідролізу білка. Полімерні формули створені для імітації загальної дієти з негідролізованими білками, вуглеводами та жирами. Джерелом білка зазвичай є казеїн, вуглеводами є мальтодекстрин кукурудзи, а джерелом жиру є рапс або соєві боби. Напівелементні та елементарні формули плануються для використання у пацієнтів із порушенням всмоктування, тому поживні речовини частково (напівелементні формули) або повністю гідролізовані (елементарні формули). Білок зазвичай знаходиться у формі дипептидів або трипептидів у напівелементарних формулах і вільних амінокислот в елементарних. Вуглеводи постачаються у вигляді гідролізованого кукурудзяного крохмалю, мальтодекстрину або фруктози. Крім того, дієта може бути стандартної концентрації (1 ккал/мл) або високої концентрації (2 ккал/мл). Залежно від концентрації жиру можна виділити дієти з дуже низьким вмістом жиру (< 3 г/1000 ккал), дієти з низьким вмістом жиру (< 20 г/1000 ккал) і дієти з високим вмістом жиру (> 20 г/1000 ккал) [3].
Механізм впливу
Механізм, що лежить в основі терапевтичної відповіді на EЕХ, досі залишається неясним. Є кілька теорій, які намагаються пояснити його протизапальні властивості. Спочатку вважалося, що низьке антигенне навантаження відповідає за лікувальні ефекти, але пізніше дослідження показали, що полімерна дієта була такою ж ефективною, як і елементарна, в індукції ремісії при активному ХК. Інша теорія вказувала на зміну профілю жирних кислот в ентеральному раціоні та його можливий вплив на бактеріальну мікрофлору шлунково-кишкового тракту, що призводить до терапевтичного ефекту на ХК.
Останні дослідження показали, що зниження регуляції прозапальних цитокінів слизової оболонки є можливим фактором, відповідальним за індукцію ремісії при ЗЗК Одна з останніх теорій вказує на сильну протизапальну дію ЕХ формул на слизову оболонку кишечника, що супроводжується гістопатологічним загоєнням. Формули ЕХ, збагачені фактором росту пухлини бета (TGF - β), викликали клінічну ремісію ХК. Це було пов’язано із загоєнням слизової оболонки та зниженням прозапальних цитокінів, таких як IL-1, IL-8 та інтерферон гамма, у зразках слизової оболонки термінального відділу клубової та товстої кишки; і збільшення TGF -β в термінальному відділі клубової кишки. Це свідчить про те, що клінічна ремісія ХК під час EЕХ є скоріше результатом зменшення запального процесу, ніж покращення харчового статусу пацієнта. Інше клінічне дослідження показало, що протизапальний ефект EЕХ передував поживному ефекту та зберігався до кінця дослідження. Загалом, жоден компонент ЕХ не був визначений які такий, що пояснює лікувальний ефект цієї терапії. Проте, було показано, що деякі компоненти ЕХ, такі як глутамін, аргінін і поліненасичені жирні кислоти, мають корисні властивості у пацієнтів із ЗЗК.
Незважаючи на те, що деякі експериментальні та клінічні дослідження показали позитивний вплив аргініну та глутаміну на клінічні симптоми та медіатори запалення при різних запальних захворюваннях, включаючи ХК, їх роль у ЗЗК недостатньо задокументована. Хоча ранні дослідження показали поліпшення клінічного перебігу захворювань після використання сумішей, збагачених аргініном, в ЕХ, останні метааналізи не підтвердили ці висновки. Крім того, не було підтверджено, що ентеральна дієта, збагачена глютаміном, є кращою за стандартну полімерну дієту при лікуванні пацієнтів з активним ХК.
Роль інвазивних видів бактерій як тригерів і факторів коінфекції при ЗЗК не була повністю визначена. Недавні дослідження повідомили про підвищену поширеність MAP та адгезивно-інвазивної Escherichia coli в кишкових тканинах, посівах калу та крові пацієнтів з ХК та ВК, особливо в активній стадії захворювання. EЕХ може впливати на інвазивні види бактерій і зменшувати їх поширеність шляхом модифікації різноманітності бактерій і модуляції переважної кишкової бактеріальної мікрофлори. Це також може бути потенційним способом дії харчової терапії при ЗЗК.

Індукційна терапія при активному захворюванні
ЕЕХ є ефективним варіантом лікування дітей та підлітків із ЗЗК, наразі рекомендований як перша лінія терапії при активному ХК. Однак, останні дані свідчать про те, що ця терапія може бути більш ефективною у дітей, ніж у дорослих, особливо при ХК порівняно з ВК. Крім того, харчова підтримка є корисною для розвитку та профілактики затримки росту, яка є частим клінічним симптомом у дітей із ЗЗК, особливо з ХК. Кокранівський систематичний огляд підтвердив позитивну терапевтичну роль EЕХ на параметри розвитку та росту дітей із ХК. Крім того, діти, які отримували EЕХ, уникали кортикостероїдної терапії та стероїдозалежних побічних ефектів протягом першого року після встановлення діагнозу ЗЗК.
Рекомендації Британського товариства гастроентерологів рекомендують ЕЕХ у дорослих пацієнтів надавати перевагу перед стероїдами, імунодепресантами або хірургічним втручанням, особливо у пацієнтів, які не реагують на 5-аміносаліцилову кислоту (5-ASA) або мають протипоказання до стероїдної терапії.
Наразі невідомо, чому переваги терапії ЕЕХ у дітей не демонструються у дорослих. Однією з причин може бути те, що терапія ЕЕХ викликає ремісію захворювання шляхом зменшення запалення слизової оболонки. У дорослих пацієнтів із ЗЗК, які мають більш тривалий перебіг захворювання та частіші ускладнення, які часто не пов’язані із запальним статусом, ЕЕХ може бути менш ефективним.
Підтримуюча терапія в період ремісії
У підтримуючій терапії під час ремісії можна розглянути різні стратегії харчування. Двома альтернативами є циклічне ЕЕХ, включаючи нічні інфузії ентеральних сумішей протягом одного разу на 4 місяці, або додаткове ЕХ з необмеженим денним режимом харчування.
Якість життя
Елементарні формули порівняно з полімерними мають характерний запах і смак завдяки вищому рівню гідролізу, головним чином через наявність амінокислот, що призводить до їх поганої переносимості пацієнтами при пероральному введенні.
Гіркота, неприємний запах, а також відрижка і гикавка можуть значно погіршити якість життя пацієнтів і дотримання під час вживання елементарних сумішей.
Короткострокові та віддалені результати дієтологічної терапії
У ретроспективному дослідженні щодо терапевтичної ефективності EЕХ з трьома різними ентеральними дієтами (полімерною, напівелементарною та елементарною) у порівнянні з кортикостероїдною терапією автори спостерігали вищий рівень ремісії (80% проти 30%) після 12 місяців спостереження, порівнянний для всіх трьох формул. Крім того, більша кількість пацієнтів, які отримували EЕХ, досягли ендоскопічної та гістопатологічної ремісії після 8 тижнів лікування.

Висновок
Таким чином, роль харчування при ЗЗК є істотною, воно бере участь як у патогенезі, так і в лікуванні цих захворювань. Незважаючи на те, що дослідження підтвердили його ефективність в індукційній та підтримуючій терапії, результати фактичного застосування у дітей та дорослих пацієнтів із ЗЗК у різних країнах неоднакові. EЕХ є варіантом терапії першої лінії при активній ХК у дітей і меншою мірою у дорослих пацієнтів, тоді як ПХ слід розглядати лише як альтернативний метод харчування для пацієнтів з непереносимістю ЕХ або під час післяопераційних періодів лікування. Майбутні вдосконалення харчових протоколів і пом’якшення побічних ефектів харчової терапії, яка зараз використовується, і покращення якості життя пацієнтів призведуть до кращого сприйняття та кращої переносимості цього методу лікування пацієнтами із ЗЗК.
ДЖЕРЕЛО: https://www.ncbi.nlm.nih.gov/
Такоже рекомендуємо для ознайомлення статтю «Ентеропатія з втратою білка».
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Більше половини пацієнтів із тривалим COVI ...

Пошкодження мозку плода, пов'язане з інфек ...

Хламідіоз: симптоми, ускладнення та профіл ...

Бактерії кишечника у матерів та новонародж ...
Генна терапія CRISPR лікує небезпечний зап ...

Вірус Епштейна — Барр запідозрили в спричи ...



