Глибокі інфекції шиї у дорослих
Дата публікації: 26.09.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: інфекції шиї у дорослих, шийний простір, одонтогенні інфекції, інфекції ротоглотки, отогенні інфекції, синогенні інфекції, інфекції паравертебрального простору

Глибокі інфекції шийного простору найчастіше виникають із септичного вогнища зубів нижньої щелепи, мигдаликів, привушної залози, глибоких шийних лімфатичних вузлів, середнього вуха або пазух. Ці глибокі інфекції цервікального простору стали відносно рідкісними в еру прийому антибіотиків. Отже, багато клініцистів не знайомі з цими станами. Крім того, при широкому застосуванні антибіотиків та/або глибокій імуносупресії класичні прояви цих інфекцій, такі як висока температура, системна токсичність і місцеві ознаки еритеми, набряку та флюктуації, можуть бути відсутніми.
Глибокі інфекції шийного простору часто мають швидкий початок і можуть прогресувати до небезпечних для життя ускладнень. Таким чином, клініцисти повинні бути обізнані про такі інфекції та не повинні недооцінювати їх потенційний ступінь чи тяжкість.
Загальні клінічні поняття
Мікробіологія. Інфекції шийного простору зазвичай є полімікробними і являють собою нормальну резидентну флору суміжних поверхонь слизової оболонки, з яких походить інфекція. Завдяки тісним анатомічним зв’язкам резидентна флора ротової порожнини, верхніх дихальних шляхів і деяких частин вух має багато спільних організмів.
Хоча всі інфекції глибокого комірцевого простору спричинені типовою мікрофлорою ротової порожнини, конкретні мікроорганізми відрізняються залежно від походження інфекції.
● Одонтогенні інфекції голови та шиї — хоча на поверхні слизової оболонки порожнини рота може бути від 50 до 100 видів бактерій, типова інфекція глибокого шийного простору включає в середньому п’ять-шість типів бактерій. Анаероби загалом переважають кількість аеробів на всіх слизових оболонках ротової порожнини у співвідношенні. Дослідження із застосуванням молекулярних методів показали, що мікробіом одонтогенних інфекцій є надзвичайно складним, а звичайні клінічні культури недостатні для повної характеристики точної мікробіології цих інфекцій. Ймовірно, що ці молекулярні методи будуть включені у звичайну клінічну мікробіологічну лабораторію в майбутньому.
Загалом, найпоширенішими мікроорганізмами, виділеними з одонтогенних інфекцій глибокого шийного простору, є стрептококи viridans, що відображає їх велику кількість у роті. Група Streptococcus anginosus (раніше називалася група Streptococcus milleri) — це типи стрептококів viridans, які є частиною нормальної флори ротової порожнини та сумно відомі тим, що викликають абсцеси на голові та шиї. У більшості зубних абсцесів також містяться оральні анаероби, включаючи Parvimonas micra (раніше Peptostreptococcus micros), інші види Peptostreptococcus, Fusobacterium nucleatum, пігментовані види Prevotella, такі як Prevotella melaninogenica (раніше Bacteroides melaninogenicus) і види Actinomyces.
● Інфекції ротоглотки — інфекції, що виникають із глотки, часто містять оральні анаероби та факультативні стрептококи, зокрема Streptococcus pyogenes. У дослідженні 847 пацієнтів з паратонзилярним абсцесом Fusobacterium necrophorum був найбільш часто виявленим видом (23 відсотки), потім S. pyogenes (17 відсотків) і стрептококи групи C або G (5 відсотків. Haemophilus influenzae також може бути збудником парафарингеальних або ретрофарингеальних абсцесів.
● Отогенні інфекції голови та шиї — окрім стрептококів та облігатних анаеробів, можуть бути залучені Staphylococcus aureus та факультативні грамнегативні палички, включаючи Pseudomonas aeruginosa, як і при хронічному середньому отиті та мастоідиті.
● Синогенні інфекції — ускладнення гнійного синуситу можуть включати типові мікроорганізми, які викликають гострий бактеріальний риносинусит, такі як Streptococcus pneumoniae, H. influenzae, Moraxella catarrhalis і S. aureus. Крім того, облігатні анаероби зазвичай беруть участь в інфекціях голови та шиї, що виникають внаслідок хронічного синуситу.
● Інфекції паравертебрального простору — інфекції паравертебрального простору зазвичай виникають внаслідок постійного поширення інфекції шийного відділу хребта (такої як дисцит або вертебральний остеомієліт), через місцеві інструменти трахеї чи стравоходу або гематогенне посівне ураження. P. aeruginosa та інші резистентні мікроорганізми, такі як Enterobacteriaceae, що продукують бета-лактамази широкого спектра дії, також можуть бути більш імовірними у пацієнтів з певними факторами ризику. Хазяї з ослабленим імунітетом (наприклад, пацієнти з нейтропенією, викликаною хімієтерапією) особливо ймовірно містять такі патогени, але ті, хто страждає на цукровий діабет, післяопераційну інфекцію або травму, також мають підвищений ризик. Klebsiella pneumoniae часто виділяли з глибоких інфекцій шийного простору на Тайвані, особливо у пацієнтів з цукровим діабетом. Цей вид є більш поширеним збудником різних інфекцій у Південно-Східній Азії, ніж у більшості інших регіонів.
Загальна клінічна картина — хоча первинне джерело інфекції (тобто одонтогенне проти орофарингеального, отогенного або синогенного) визначає початкову клінічну картину, інфекції глибокого шийного простору мають деякі типові клінічні ознаки. Вони часто пов’язані з болем у горлі та/або тризмом (нездатністю відкрити щелепу). Тризм вказує на тиск або інфекцію, що вражає жувальні м’язи (жувальний і крилоподібний) або залучення рухової гілки трійчастого нерва. Дисфагія та одинофагія можуть бути вторинними стосовно запалення в кількох місцях, включаючи крикоаритеноїдні суглоби. Через щільний поверхневий шар глибокої шийної фасції та її м’язово-фасціальних площин флюктуючі утворення важко оцінити під час зовнішньої пальпації пацієнтів із глибокими інфекціями шийного простору. Коли можливо, натомість пальпація ротової порожнини може допомогти визначити таку пухлину або вогнищеву хворобливість. Характерними ознаками глибокого нагноєння є ямка або тістоподібне відчуття при міцній глибокій пальпації.
Стридор і задишка свідчать про обструкцію дихальних шляхів і можуть бути проявами місцевого тиску або поширення інфекції в середостіння. Дисфонія та захриплість є пізніми ознаками інфекцій шиї та можуть вказувати на ураження 10- го черепного нерва. Односторонній парез язика свідчить про ураження 12-го черепного нерва.
Специфічні фактори пацієнта (такі як супутнє захворювання, госпіталізація, попередня операція чи травма або імунодефіцитний стан) також можуть впливати на клінічну картину інфекцій глибокого комірцевого простору. Наприклад, у пацієнтів, які перенесли радикальну операцію на шиї або опромінення шиї з приводу раку, дифузний целюліт і лімфедема можуть бути помітними клінічними ознаками. Так само у пацієнтів, які перенесли трахеостомію та тривалу ШВЛ, може розвинутися трахео-стравохідна нориця з поширенням інфекції в середостіння. У хворих у відділенні інтенсивної терапії з тривалим внутрішнім яремним центральним венозним катетером можливий розвиток гнійного тромбофлебіту внутрішньої яремної вени (варіант синдрому Лем'єра).

Клінічна підозра та невідкладна візуалізація. Будь-які ознаки чи симптоми, що вказують на інфекцію глибокого шийного простору, повинні спонукати до термінового обстеження з візуалізаційними дослідженнями, щоб діагностувати інфекцію глибокого шийного простору, визначити точне місце інфекції та оцінити потенційне поширення. Такі ознаки або симптоми включають сильний односторонній біль у горлі; випинання стінки глотки, м'якого піднебіння або дна ротоглотки; біль у шиї або набряк; кривошия через спазм м'язів; ригідність м’язів шиї; наявність крепатури; або ознаки, що вказують на обструкцію дихальних шляхів (наприклад, глухий голос, виділення слини або слини, стридор або інші ознаки респіраторного дистресу). Якщо є підозра на обструкцію дихальних шляхів, таких пацієнтів слід спочатку негайно обстежити для інтубації та можливого хірургічного втручання. Комп’ютерна томографія (КТ), як правило, є методом вибору візуалізації для діагностики та оцінки місця та ступеня глибоких інфекцій шийного простору. КТ дозволяє критично оцінити м’які тканини та особливо кістку за одноразовим опроміненням. Крім того, аксіальний формат зображення КТ особливо добре підходить для голови та шиї. Оскільки КТ може локалізувати процес і визначити його ступінь, зокрема поширення на середостіння або склепіння черепа, це також безцінний інструмент для планування та спрямування аспірації для культури або відкритого дренажу.
Магнітно-резонансна томографія (МРТ) корисна для оцінки ступеня ураження м’яких тканин і для визначення судинних ускладнень. У дослідженні 15 пацієнтів з глибокими інфекціями шийного простору, які пройшли КТ і МРТ, МРТ була кращою за КТ за анатомічною дискримінацією, видимістю ураження, розширенням ураження та кількістю просторів, залучених до одонтогенних інфекцій. МРТ було особливо корисним для пацієнтів, у яких на КТ погано розрізняють масивне ураження та навколишні структури м’яких тканин. Однак МРТ займає значно більше часу, ніж КТ, щоб отримати якісні зображення, що може викликати дискомфорт або клаустрофобію. Крім того, люди з певними імплантованими пристроями не можуть проходити МРТ.
В окремих випадках може знадобитися додаткова візуалізація для оцінки судинної системи. Як приклад, КТ-ангіографія може бути показана, якщо інші візуалізації або клінічні ознаки вказують на залучення нервово-судинного відділу всередині каротидної оболонки.
Звичайна рентгенографія має обмежену користь для оцінки інфекцій глибокого шийного простору; якщо це виконується, іноді це корисно для виявлення ретрофарингеального набряку або епіглотиту на бокових знімках шиї. Сфокусоване ультразвукове дослідження, яке визначає співвідношення товщини язика до висоти ротової порожнини, є надійним методом оцінки ураження дихальних шляхів і підтверджено в порівнянні з КТ.
Загальні питання менеджменту
Принципи антимікробної терапії — відповідні антибіотики в поєднанні з хірургічним дренажем локалізованої інфекції мають важливе значення для успішного результату глибоких інфекцій шийного простору. Основною патологічною знахідкою при глибоких інфекціях шийного простору є целюліт, який залучає сполучні тканини, фасції та м’язи та часто піддається некрозу. Цей некротичний целюліт призводить до серозно-кровної, гнильної інфільтрації тканин шиї, зазвичай з невеликою кількістю або без явного гною. На цій стадії інфекції лікування в основному медикаментозне за допомогою антибіотиків, спрямованих на знищення збудників мікроорганізмів і запобігання місцевому чи системному поширенню інфекції. Хірургічне дренування слід проводити тільки в тому випадку, якщо целюлітний процес локалізувався в дискретний абсцес.
Посів крові слід проводити всім пацієнтам, у яких є глибока інфекція шийного простору, незалежно від наявності лихоманки.
Емпіричні схеми базуються на очікуваній мікробіології та імунному статусі хазяїна, і охоплення має бути звужено, якщо стануть доступними мікробіологічні дані. Вибір антимікробних схем для лікування глибоких інфекцій шийного простору не оцінювався в клінічних дослідженнях. Слід вводити максимальні дози системних протимікробних препаратів, щоб оптимізувати проникнення в тканини.
Обстеження дихальних шляхів — усі пацієнти з інфекцією глибокого комірцевого простору повинні пройти обстеження щодо можливої обструкції дихальних шляхів. Для тих, у кого є докази ушкодження дихальних шляхів, підтримка адекватного проходження дихальних шляхів є першочерговою та невідкладною проблемою лікування.
Застосування глюкокортикоїдів для полегшення симптомів у пацієнтів без алергії з інфекціями голови та шиї залишається суперечливим; Докази щодо його переваг занадто обмежені, щоб підтримувати рутинне використання глюкокортикоїдів з цією метою. Проте систематичний огляд ролі кортикостероїдів у цервіко-фаціальних інфекціях припустив, що короткочасні високі дози кортикостероїдів можуть бути корисними при деяких інфекціях голови та шиї, зокрема у випадках загрози обструкції дихальних шляхів.
Інфекції парафарингеального та заглоткового просторів
Клінічна картина та ускладнення
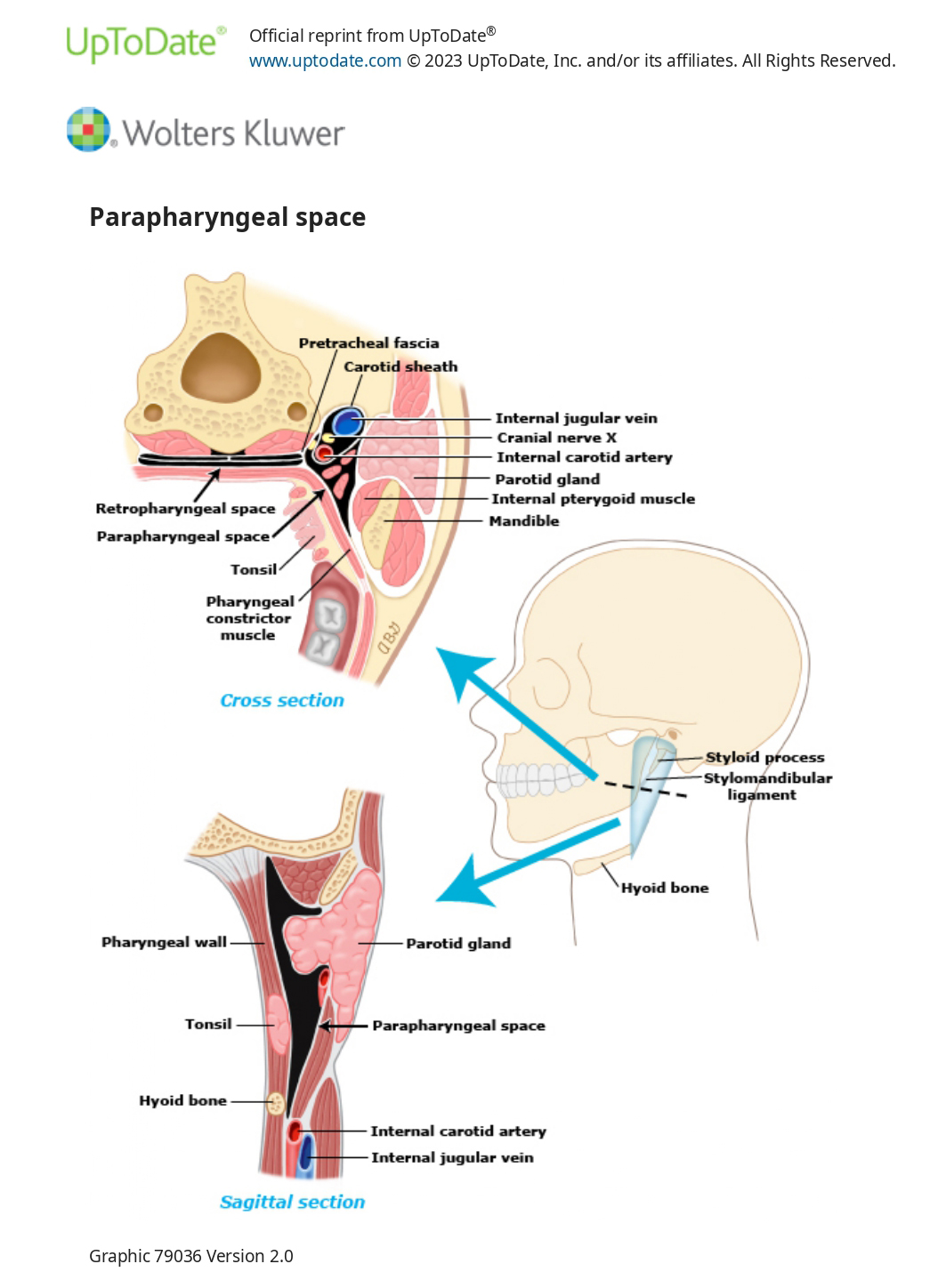
Інфекції парафарингеального простору — оскільки в клінічній картині можуть переважати симптоми та ознаки первинного джерела інфекції, діагноз ураження навкологлоткового простору часто встановлюється із запізненням. Зубні інфекції є найпоширенішим основним джерелом, потім паратонзилярний абсцес і рідко паротит, отит або мастоїдит (абсцес Безолда).
● Клінічні ознаки — основні клінічні ознаки інфекцій парафарингеального простору подібні до загальних симптомів інфекції глибокого шийного простору складаються з:
- Тризм (тобто нездатність відкрити щелепу).
- Ущільнення та набряк нижче кута нижньої щелепи.
- Медіальне випинання стінки глотки.
- Системна токсичність з лихоманкою та ознобом.
Задишка може виникати, але не є помітною, якщо набряк і припухлість не охоплюють надгортанник і гортань.
Результати фізикального обстеження включають набряк обличчя та шиї, еритему та гнійні виділення з рота. Зазвичай спостерігається набряк і зміщення привушної залози. Можливе скупчення слини в ротовій порожнині та асиметрія ротоглотки. Набряк стінки глотки, якщо він присутній, буде за піднебінно-глотковою дугою і його легко помітити клінічно. Зазвичай присутня лімфаденопатія.
Ці знахідки переважають при інфекції переднього відділу парафарингеального простору, що є більш поширеним, ніж ураження заднього відділу. Абсцес, локалізований у задньому нервово-судинному відділі парафарингеального простору, може проявлятися мінімальним тризмом або болем і натомість сепсисом і неврологічними симптомами, що вказують на ураження черепних нервів (наприклад, синдром Горнера, захриплість, односторонній парез язика). Задній мигдаликовий стовп може бути зміщений. Набряк привушної залози може виникнути як при інфекції заднього відділу, так і переднього.
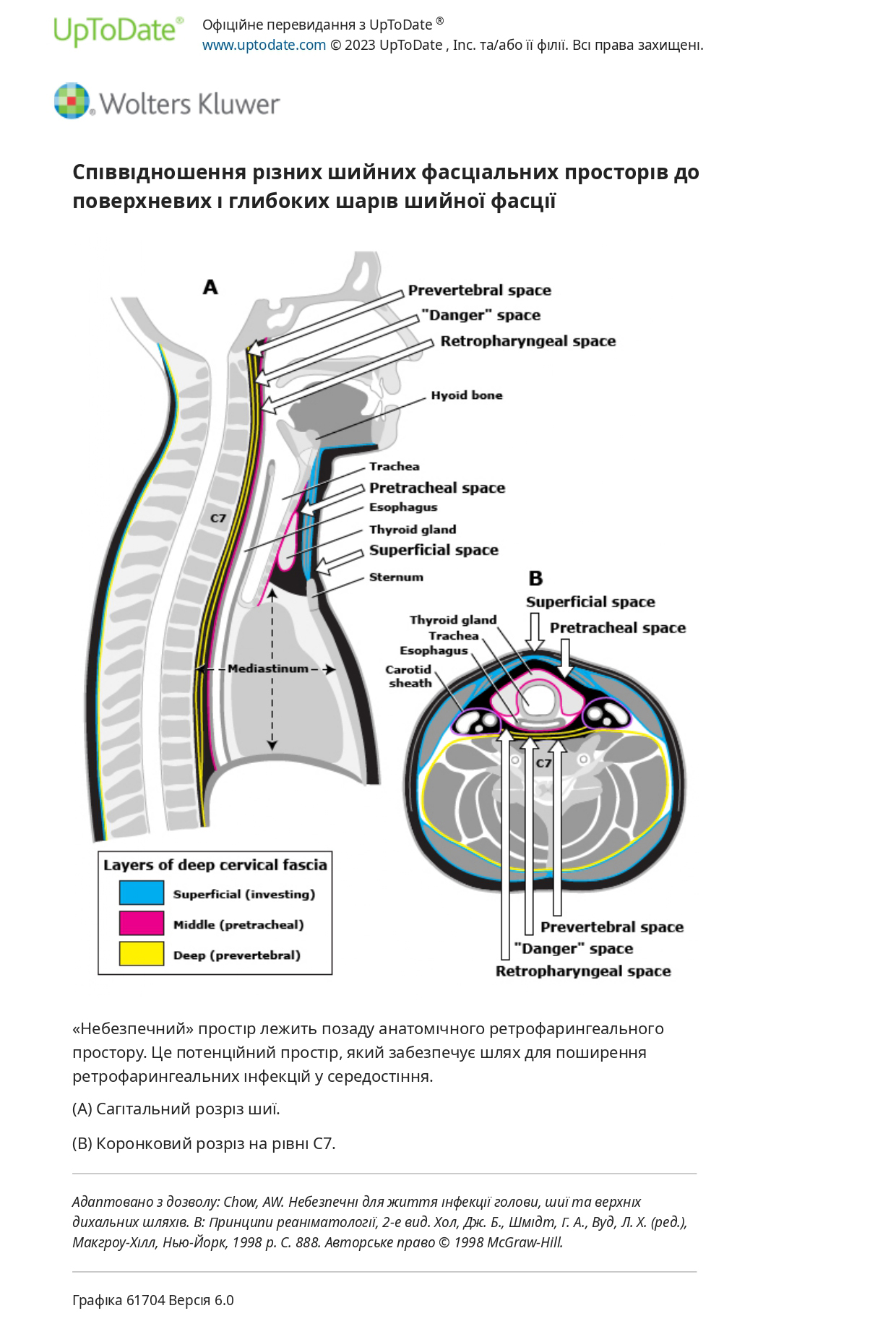
● Ускладнення. Інфекції парафарингеального простору є потенційно небезпечними для життя через можливість ураження каротидної оболонки та її життєво важливого вмісту (наприклад, загальної сонної артерії, внутрішньої яремної вени, блукаючого нерва), схильності до ущемлення дихальних шляхів та бактеріємічної дисемінації. Нагноєння також може швидко поширюватися в інші простори, особливо в ретрофарингеальний і «небезпечний» простори, можливо, досягаючи середостіння знизу або основи черепа зверху.
● Ураження каротидної оболонки — ураження каротидної оболонки є страшним ускладненням інфекцій парафарингеального простору через можливість ерозії сонної артерії та гнійного яремного тромбофлебіту. Сонна оболонка прилягає до всіх трьох шарів глибокої шийної фасції. Таким чином, інфекція може виникнути шляхом поширення з парафарингеального простору, підщелепного простору або нагноєння глибоких шийних лімфовузлів.
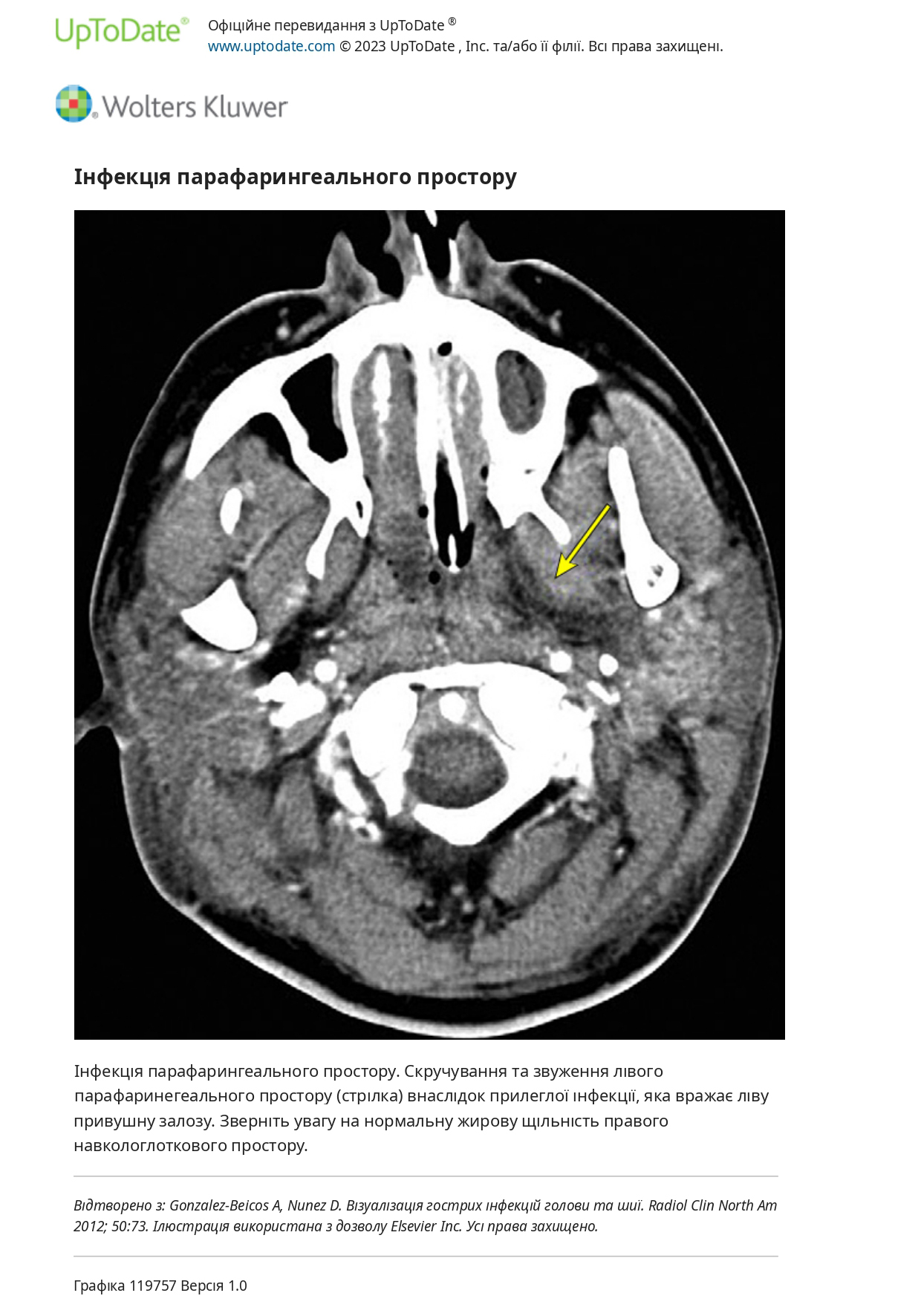
Немає характерних симптомів або ознак інфекції каротидної оболонки. Ангіна в анамнезі зазвичай, але не завжди, може бути легкою або односторонньою; може бути латентний період до трьох тижнів до розвитку явних проявів інфекції глибокого шийного простору. Пацієнт з’являється або в стані отруєння, або з підступною лихоманкою невизначеного походження. Тризм відсутній, і ознаки місцевого нагноєння можуть спочатку бути незначними через щільну сполучну тканину навколо та всередині каротидної оболонки. У деяких пацієнтів спостерігається дифузний набряк уздовж грудинно-ключично-соскоподібного м’яза з вираженою болючістю та кривошією на протилежному боці.
Рівень смертності від мікозних аневризм сонної артерії становить приблизно 20 відсотків. Ерозія сонної артерії є потенційно руйнівним ускладненням. Це ускладнення виникає внаслідок артеріїту через суміжне запалення, що зрештою призводить до утворення хибної аневризми, яка може розірватися. Після цього утворюється гематома в навколишніх тканинах, затяжний клінічний перебіг і з часом настає шок внаслідок знекровлення. Перев'язка сонної артерії може знадобитися у випадках великих крововиливів, але рівень смертності залишається високим, а ризик інсульту значним.
● Гнійний тромбофлебіт яремної кишки. Гнійний тромбофлебіт яремної артерії (також відомий як синдром Лем’єра або постангінальний сепсис) слід запідозрити у пацієнтів з попереднім фарингітом, септичною легеневою емболією та стійкою лихоманкою, незважаючи на антимікробну терапію. Це найчастіше викликається F. necrophorum, який часто присутній у крові.
Інфекції ретрофарингеального простору
● Клінічні ознаки — клінічні ознаки інфекції ретрофарингеального простору залежать від первинного джерела інфекції. Біль у горлі, утруднене ковтання або утруднене дихання можуть бути характерними ознаками, коли інфекція викликана місцевим поширенням, яке зазвичай є вторинним щодо проникаючої травми (наприклад, від курячих кісток або після інструментального втручання стравоходу чи трахеї). Також можуть спостерігатися гарячка та системна токсичність. При огляді ротоглотки можна виявити серединну або односторонню припухлість або опуклість задньої стінки глотки. Інфекція ретрофарингеального простору також може поширюватися через місцеве поширення парафарингеальної інфекції або від більш віддалених інфекцій (наприклад, одонтогенних інфекцій) через залучення ретрофарингеальних лімфатичних вузлів. У таких випадках тризм може бути помітним і перешкоджати безпосередньому огляду задньої стінки глотки.
● Ускладнення. Ретрофарингеальні абсцеси належать до найсерйозніших інфекцій глибокого простору, оскільки інфекція може поширюватися безпосередньо на передню або задню ділянки верхнього середостіння або на всю довжину заднього середостіння через небезпечний простір Гострий некротичний медіастиніт є найбільш небезпечним ускладненням інфекції ретрофарингеального простору. Інфекція в «небезпечному» просторі між алярною та превертебральною фасціями може відтікати під дією тяжіння в заднє середостіння, що призводить до медіастиніту та емпієми. У минулому 70 відсотків випадків медіастиніту були результатом поширення інфекції таким чином. Однак із запровадженням антибіотиків розширення середостіння стало рідкістю, і більшість випадків гострого медіастиніту є наслідком перфорації стравоходу.
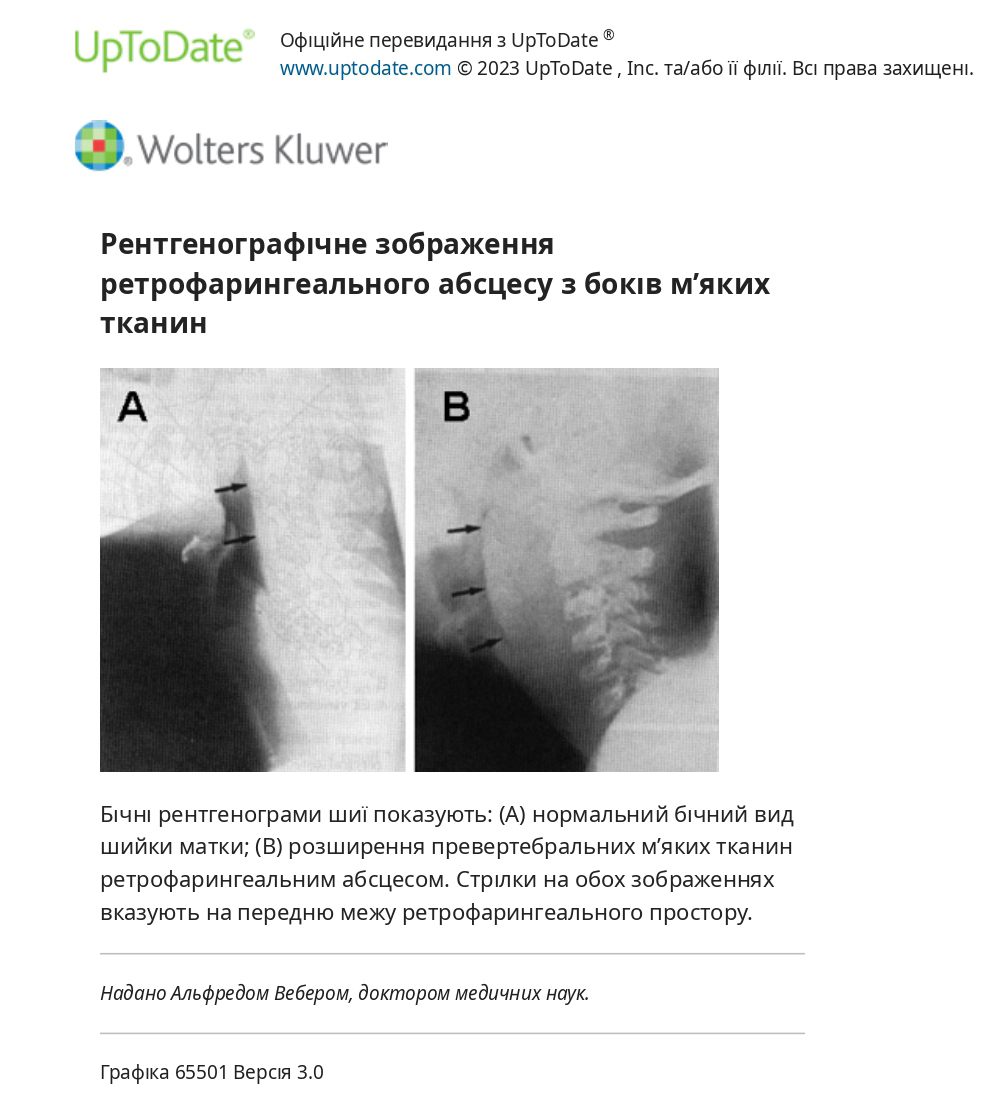
Клінічно початок гострого некротичного медіастиніту є швидким і характеризується наступним:
- Поширений некротичний процес, що поширюється на заднє середостіння, іноді в заочеревинний простір.
- Розрив абсцесу середостіння в плевральну порожнину з емпіємою або розвитком локалізацій.
- Плевральний або перикардіальний випіт, часто з тампонадою.
Смертність від гострого некротичного медіастиніту у дорослих висока (25 відсотків), навіть якщо вводять відповідні антибіотики.
Аспіраційна пневмонія є ще одним потенційним ускладненням інфекції ретрофарингеального простору. Пневмонія може виникнути внаслідок порушення ковтання або спонтанного розриву абсцесу в дихальні шляхи.
Діагноз. Діагноз інфекції парафарингеального або ретрофарингеального простору підозрюють на підставі клінічної картини та встановлюють за допомогою візуалізації (зазвичай комп’ютерної томографії [КТ]). На додаток до візуалізації всім пацієнтам з інфекцією парафарингеального або ретрофарингеального простору необхідно провести посів крові, незалежно від наявності лихоманки, щоб ідентифікувати потенційних патогенів.
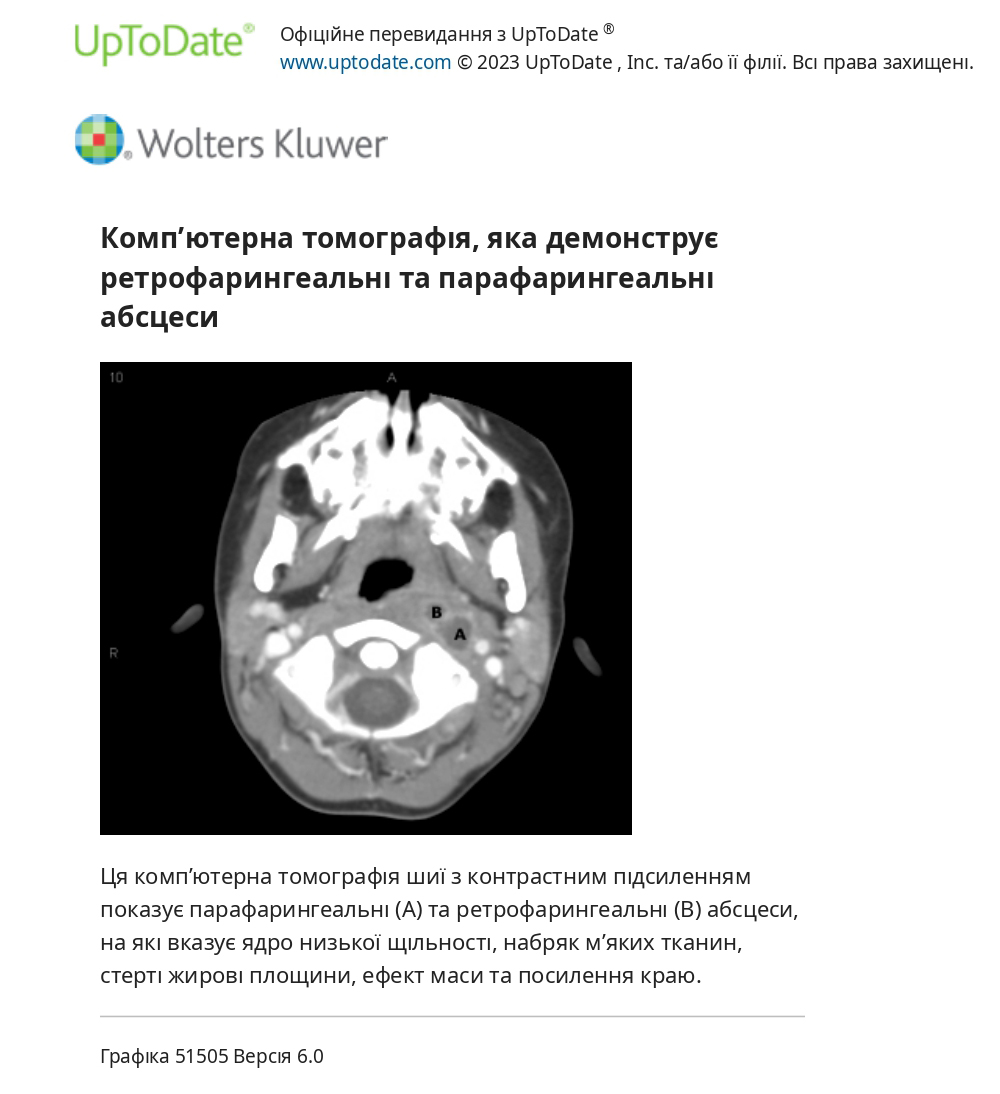
Загальні результати КТ глибоких інфекцій комірцевого простору включають втрату чіткості між анатомічними проміжками на шиї, скупчення підшкірних тканин, збільшення тканини та явне утворення абсцесу; розташування знахідок вказує на те, чи це інфекція парафарингеального, чи ретрофарингеального простору.
Іноді некротичні лімфатичні вузли (наприклад, внаслідок злоякісного метастатичного захворювання) можуть бути схожими на абсцес на КТ (периферичне посилення з центральним низьким ослабленням); у таких випадках магнітно-резонансна томографія (МРТ) може бути корисною для диференціації між ними.
Незважаючи на те, що КТ або МРТ є кращими, ніж звичайні рентгенограми, певні результати звичайної рентгенограми, якщо вони виконані, також можуть свідчити про інфекцію ретрофарингеального простору. До них відносяться збільшення товщини паравертебральних м’яких тканин, рівень повітря або повітряно-рідинної рідини та сторонні тіла. Може спостерігатися шийний лордоз із набряком і скупченням газу в ретрофарингеальному просторі, що спричиняє зміщення гортані та трахеї вперед. При наявності інфекції ретрофарингеального простору глотка або верхні дихальні шляхи зміщуються вперед більш ніж на половину ширини тіла четвертого шийного хребця (C4; у нормі м’які тканини задньої стінки гіпофаринкса становлять близько 5 мм). глибокий, менше однієї третини діаметра C4). Сфокусоване ультразвукове дослідження співвідношення товщини язика до висоти ротової порожнини є надійним методом оцінки ураження дихальних шляхів.
Тендиноз довгого м’яза хребта внаслідок відкладення кристалів гідроксиапатиту кальцію в сухожиллях довгого м’яза хребта може викликати запальну реакцію та імітувати інфекційний процес у ретрофарингеальному просторі. Проте накопичення рідини є неінфекційним за своєю природою, і типові результати КТ включають кальцифікацію всередині сухожилля та просте накопичення рідини без периферичного посилення.

Лікування
Показання та методи дренування — для пацієнтів, у яких є стоматологічне джерело інфекції, ми рекомендуємо раннє видалення цього джерела. Додаткові первинні рішення щодо дренування при інфекціях парафарингеального або ретрофарингеального простору залежать від того, чи розвинулося місцеве нагноєння, чи наявна лише початкова фаза дифузного целюліту. Утворення абсцесу часто важко визначити клінічно, але його можна визначити за допомогою візуалізаційних досліджень. Ця диференціація важлива, оскільки дренування слід відкласти на стадії целюліту, тоді як локалізовані абсцеси слід дренувати.
Відкритий хірургічний дренаж був традиційним підходом до лікування абсцесу. Для пацієнтів із чітко вираженими інфекціями глибокого комірцевого простору без порушення дихальних шляхів аспірація під ультразвуковим контролем є ефективною альтернативою та пов’язана зі скороченням терміну перебування в стаціонарі та покращенням економії коштів. При інфекції ретрофарингеального простору, ускладненої гострим некротичним медіастинітом, потрібне хірургічне дренування середостіння, яке може бути виконано шийно-медіастинальним або трансторакальним доступом. Хоча цервікальний підхід може бути ефективним на ранніх стадіях медіастиніту, торакотомія, як правило, показана, коли некротичний процес увійшов у «небезпечний» простір.
Ендоскопічний дренаж протипоказаний через близькість магістральних судин.
Антибіотикотерапія
Позалікарняна інфекція. Початкове емпіричне антимікробне лікування інфекцій парафарингеального або ретрофарингеального простору в імунокомпетентних пацієнтів із позалікарняними інфекціями частково залежить від ймовірного місця походження інфекції:
● Для імунокомпетентних пацієнтів із ймовірним оральним або одонтогенним (тобто із зубів) джерелом ми пропонуємо режим, який має активність проти стрептококів (включаючи стійкі до кліндаміцину viridans streptococci), H. influenzae та анаеробних бактерій. Ми зазвичай не включаємо покриття проти метицилін-резистентного S. aureus (MRSA), але робимо це, якщо існують фактори ризику інфікування або колонізації MRSA, як показано нижче.
Приклади емпіричних режимів включають:
- Ампіцилін-сульбактам (3 г внутрішньовенно [в/в] кожні шість годин) або
- Цефтріаксон (2 г внутрішньовенно кожні 24 години) або левофлоксацин (750 мг внутрішньовенно кожні 24 години) плюс
- Метронідазол (500 мг внутрішньовенно кожні вісім годин) або Кліндаміцин (600 мг внутрішньовенно кожні вісім годин).
● Для імунокомпетентних пацієнтів із ймовірним отогенним (тобто з вуха чи соскоподібного відростка) джерелом ми пропонуємо режим, який має активність проти стрептококів (включаючи стійкі до кліндаміцину стрептококи viridans), H. influenzae та анаеробних бактерій, а також факультативних грамнегативних бактерій. охоплення, включаючи P. aeruginosa. Ми зазвичай не включаємо покриття проти MRSA, але робимо це, якщо існують фактори ризику інфікування MRSA або колонізації.
Приклади емпіричних режимів включають:
- Цефепім (2 г внутрішньовенно кожні 8 годин) плюс метронідазол (500 мг внутрішньовенно кожні 8 годин) або
- Піперацилін-тазобактам (4,5 г внутрішньовенно кожні шість годин).
- Іміпенем (1 г внутрішньовенно кожні шість годин) або меропенем (2 г внутрішньовенно кожні 8 годин).
Для імунокомпетентних пацієнтів із можливим синогенним (тобто із пазух) джерелом ми пропонуємо режим, який має активність проти S. pneumoniae, M. catarrhalis, S. aureus (включаючи MRSA) та анаеробних бактерій.
Приклади емпіричних режимів включають:
- Ванкоміцин плюс ампіцилін-сульбактам (3 г внутрішньовенно кожні шість годин) або
- Ванкоміцин плюс Цефтріаксон (2 г внутрішньовенно кожні 24 години) або левофлоксацин (750 мг внутрішньовенно кожні 24 години) плюс
- Метронідазол (500 мг внутрішньовенно кожні вісім годин) або кліндаміцин (600 мг внутрішньовенно кожні вісім годин).

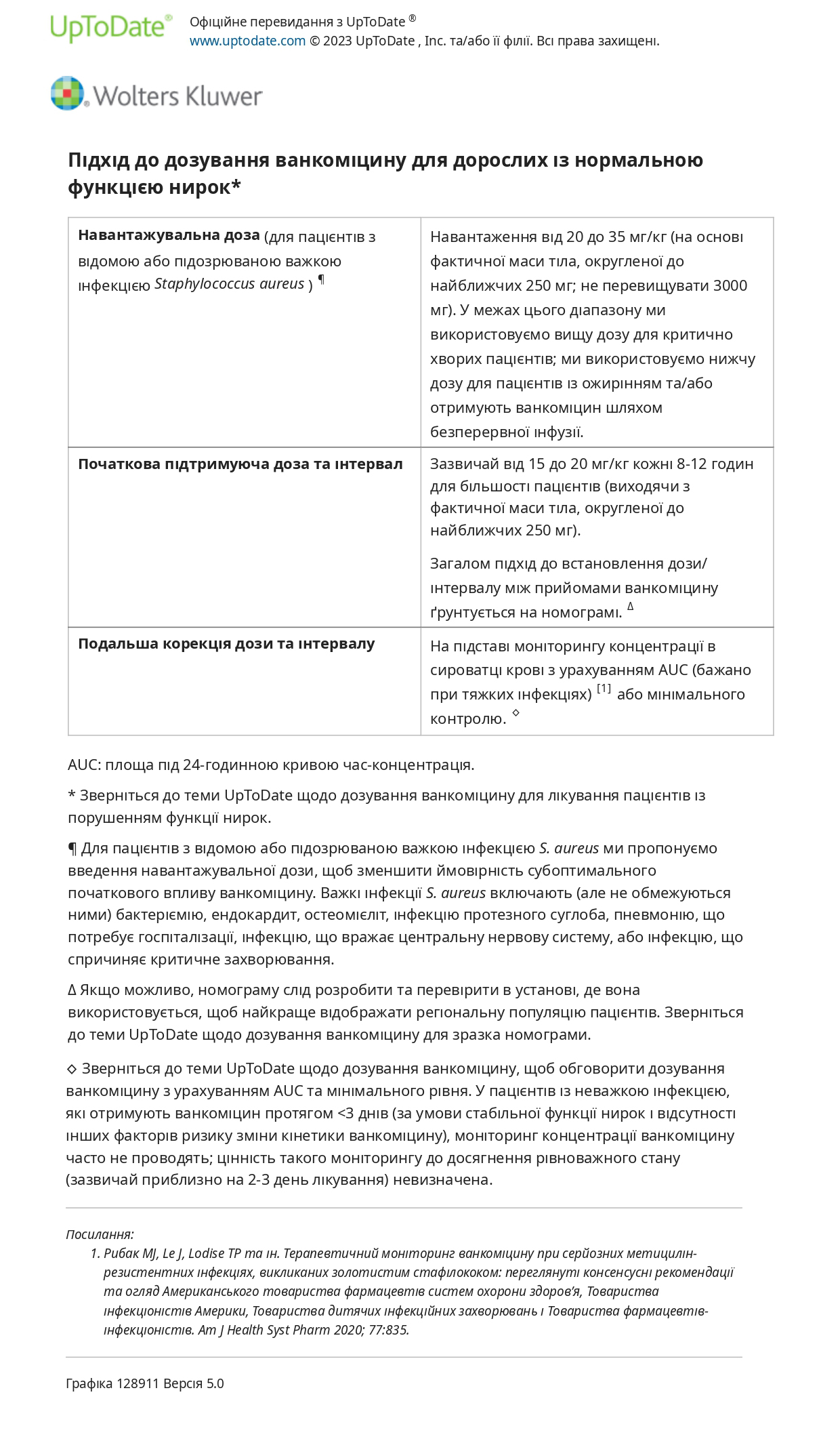
Як і вище, ми включаємо покриття проти MRSA для інфекцій орального/одонтогенного або отогенного джерела, якщо у пацієнта є фактори ризику інфікування або колонізації MRSA, а також інфекцій синогенного походження. Зазвичай цього досягають додаванням до схеми ванкоміцинуабо лінезоліду (600 мг перорально або внутрішньовенно кожні 12 годин).
Дози антибіотиків призначені для пацієнтів з нормальною функцією нирок; у пацієнтів із порушенням функції нирок необхідно зменшити дозування багатьох із цих засобів.
Емпірична антибіотикотерапія може бути скоригована після отримання результатів посіву.
Інфекція, пов’язана з наданням медичної допомоги, або пацієнт із ослабленим імунітетом — для пацієнтів із ослабленим імунітетом або інфекцією, пов’язаною з наданням медичної допомоги (наприклад, мешканці закладів тривалого догляду, ті, хто нещодавно був госпіталізований), ми пропонуємо схему широкого спектра, яка забезпечує покриття проти MRSA та P. aeruginosa, на додаток до інших грампозитивних і грамнегативних аеробів і анаеробів. Приклади:
● Ванкоміцин або лінезолід (600 мг внутрішньовенно кожні 12 годин) плюс одне з наступного:
- Цефепім (2 г внутрішньовенно кожні 8 годин) плюс метронідазол (500 мг внутрішньовенно кожні 8 годин) або
- Іміпенем (1 г внутрішньовенно кожні шість годин) або
- Меропенем (2 г внутрішньовенно кожні вісім годин) або
- Піперацилін-тазобактам (4,5 г внутрішньовенно кожні шість годин).
Дози антибіотиків призначені для пацієнтів з нормальною функцією нирок; у пацієнтів із порушенням функції нирок необхідно зменшити дозування багатьох із цих засобів.
Емпірична антибіотикотерапія може бути скоригована після отримання результатів посіву.
Спрямована терапія та тривалість — антибіотикотерапія може бути скоригована до більш вузької схеми, якщо доступні інформативні результати посіву; однак анаеробне покриття зазвичай зберігається, навіть якщо анаероби не ізольовані. Загалом терапію слід продовжувати протягом двох-трьох тижнів, доки лихоманка та лейкоцитоз не зникнуть, а місцева чутливість і набряк не зменшаться. Більш тривалі курси можуть бути виправданими, якщо є ускладнення, що стосуються кісткових або судинних структур.
Зазвичай ми віддаємо перевагу внутрішньовенному введенню антибіотиків протягом усього періоду лікування; однак антибіотики, які мають відмінну біодоступність при пероральному прийомі, такі як лінезолід, левофлоксацин і метронідазол, можна застосовувати перорально, коли пацієнт покращиться, за умови нормального всмоктування.
Інфекції паравертебрального простору
Мікробіологія. Мікробіологія інфекцій паравертебрального простору значно відрізняється від мікробіології інших глибоких інфекцій шиї. Інфекції паравертебрального простору зазвичай виникають внаслідок постійного поширення інфекції шийного відділу хребта (такої як дисцит або вертебральний остеомієліт), місцевих інструментів трахеї чи стравоходу або гематогенного посіву. Переважають грампозитивні мікроорганізми, найпоширенішим є S. aureus. Менш поширені організми включають різні факультативні грамнегативні бацили (включаючи P. aeruginosa), мікобактерії та гриби.
Фактори ризику. Фактори ризику інфекцій паравертебрального простору в основному такі ж, як і для остеомієліту хребців. Зокрема, відомими факторами ризику є внутрішньовенне вживання наркотиків, імуносупресія, алкогольні розлади та цукровий діабет.
Клінічні прояви та ускладнення. Клінічні прояви інфекцій превертебрального простору варіюються залежно від локалізації первинного джерела інфекції (наприклад, шийний спондилодисцит і остеомієліт) і від того, чи є асоційований спінальний епідуральний абсцес або компресія спинного мозку.
У деяких пацієнтів фізикальне обстеження ротоглотки може виявити опуклість задньої стінки глотки. Огляд шийного відділу хребта також може виявити набряк або еритему.
Ускладнення інфекцій превертебрального простору в основному пов’язані зі спінальними епідуральними колекціями, які викликають компресію канатика. Серед пацієнтів зі спінальним епідуральним абсцесом приблизно одна третина має неврологічні розлади, починаючи від болю в нервових корінцях до паралічу.
Оскільки превертебральный простір простягається від основи черепа до куприка і примикає до оболонки поперекового м’яза, у пацієнта з інфекцією паравертебрального простору всередині поперекового м’яза можуть утворюватися, здавалося б, віддалені абсцеси. Повідомлялося також про інфекцію шийного паравертебрального простору, що є вторинною причиною висхідного поширення від інфікованої псевдокісти підшлункової залози.
Діагностика. Діагноз інфекції паравертебрального простору встановлюється за характерними ознаками візуалізації у пацієнтів із симптомами інфекції глибокого шийного простору або підозрою на шийний остеомієліт. На додаток до візуалізації всім пацієнтам з інфекцією паравертебрального простору, незалежно від наявності лихоманки, необхідно провести посів крові для виявлення потенційних патогенів.
При інфекціях паравертебрального простору посилення флегмони або абсцесу можна візуалізувати в паравертебральному просторі. Візуалізація також часто демонструє асоційований спондилодисцит або остеомієліт хребців.
Лікування — лікування інфекцій превертебрального простору полягає в швидкому дренуванні будь-якого абсцесу та застосуванні антибіотиків широкого спектру дії.
Дренування. Слід спробувати провести дренаж при всіх інфекціях паравертебрального простору, у яких є явний абсцес або локалізована рідина. Черезшкірний дренаж під ультразвуковим контролем є ефективною та безпечною альтернативою традиційному хірургічному розрізу та дренажу для деяких пацієнтів.
У разі інфекції превертебрального простору, пов’язаної з шийним остеомієлітом, також може бути виправданим видалення некротичної кістки.
Антибіотикотерапія
Вибір початкової схеми — для пацієнтів з інфекціями паравертебрального простору ми пропонуємо початкову схему лікування антибіотиками, які мають активність проти S. aureus (включаючи MRSA), грамнегативних бацил і анаеробів (див. «Мікробіологія» вище).Пацієнтам з інфекціями, пов’язаними з наданням медичної допомоги, або з факторами ризику інфікування мікроорганізмами, що продукують бета-лактамази широкого спектру дії, емпіричне лікування агентом, активним проти MRSA (наприклад, ванкоміцином), плюс карбапенем (іміпенем 1 г внутрішньовенно кожні шість годин або меропенем 2 г внутрішньовенно кожні вісім годин).
Ми включаємо покриття для анаеробів (наприклад, додавання метронідазолу до цефепіму або ципрофлоксацину) під час ранньої емпіричної терапії через потенційну невизначеність паравертебральної чи ретрофарингеальної інфекції або можливість поширення інфекції паравертебрального простору з ретрофарингеального місця. Якщо встановлено, що інфекція паравертебрального простору пов’язана з вертебральним остеомієлітом, продовження специфічного анаеробного покриття не є обов’язковим.
Спрямована терапія та тривалість — антибіотикотерапія може бути скоригована до більш вузької схеми, якщо доступні інформативні результати посіву. Для неускладнених інфекцій паравертебрального простору без ознак дискиту або остеомієліту, ймовірно, достатньо буде двох-трьох тижнів терапії. Однак більшість інфекцій паравертебрального простору є результатом поширення інфекції внаслідок дискиту або вертебрального остеомієліту, у цьому випадку зазвичай рекомендується більша тривалість терапії
Інші специфічні глибокі інфекції шиї
Паратонзилярний абсцес (ангіна) — дивіться Клінічні настанови: менеджмент паратонзиліту та паратонзилярного абсцесу.
Інфекції привушної залози — гострий гнійний паротит характеризується раптовою появою одностороннього ущільнення та еритеми, яка поширюється від щоки до кута щелепи. Привушна залоза стає набряклою і надзвичайно чутливою. Гнійні виділення можуть виражатися легким стисненням навколо отвору привушної протоки (протоки Стенсена). Незважаючи на те, що камінь, що закупорює слинну протоку, може спричинити бактеріальну інфекцію, ущільнені виділення та/або стаз є більш поширеними ознаками схильності. Три фактори, які сприяють розвитку гнійного паротиту, - це різке зниження виділення слини, погана гігієна ротової порожнини та підвищена сприйнятливість до інфекції. Таким чином, гострий гнійний паротит зазвичай спостерігається у літніх, ослаблених та/або зневоднених пацієнтів, які можуть страждати на цукровий діабет або приймати антихолінергічні препарати, що зменшують виділення слини.
Мікробіологія гострого гнійного паротиту досить різноманітна і часто полімікробна. S. aureus є найбільш часто виділеним патогеном, але анаероби також є поширеними.
Ангіна Людвіга — це двостороння інфекція піднижньощелепного, під’язикового та підчелюстного просторів, яка починається на дні ротової порожнини, найчастіше пов’язана з другим або третім моляром нижньої щелепи. Зазвичай це полімікробна інфекція, що залучає флору ротової порожнини. Це агресивний, швидко розповсюджуваний «дерев’янистий» або м’язистий целюліт без лімфаденопатії. Зараження дихальних шляхів є потенційним ускладненням і вимагає ретельного моніторингу та швидкого втручання для запобігання асфіксії та аспіраційної пневмонії.
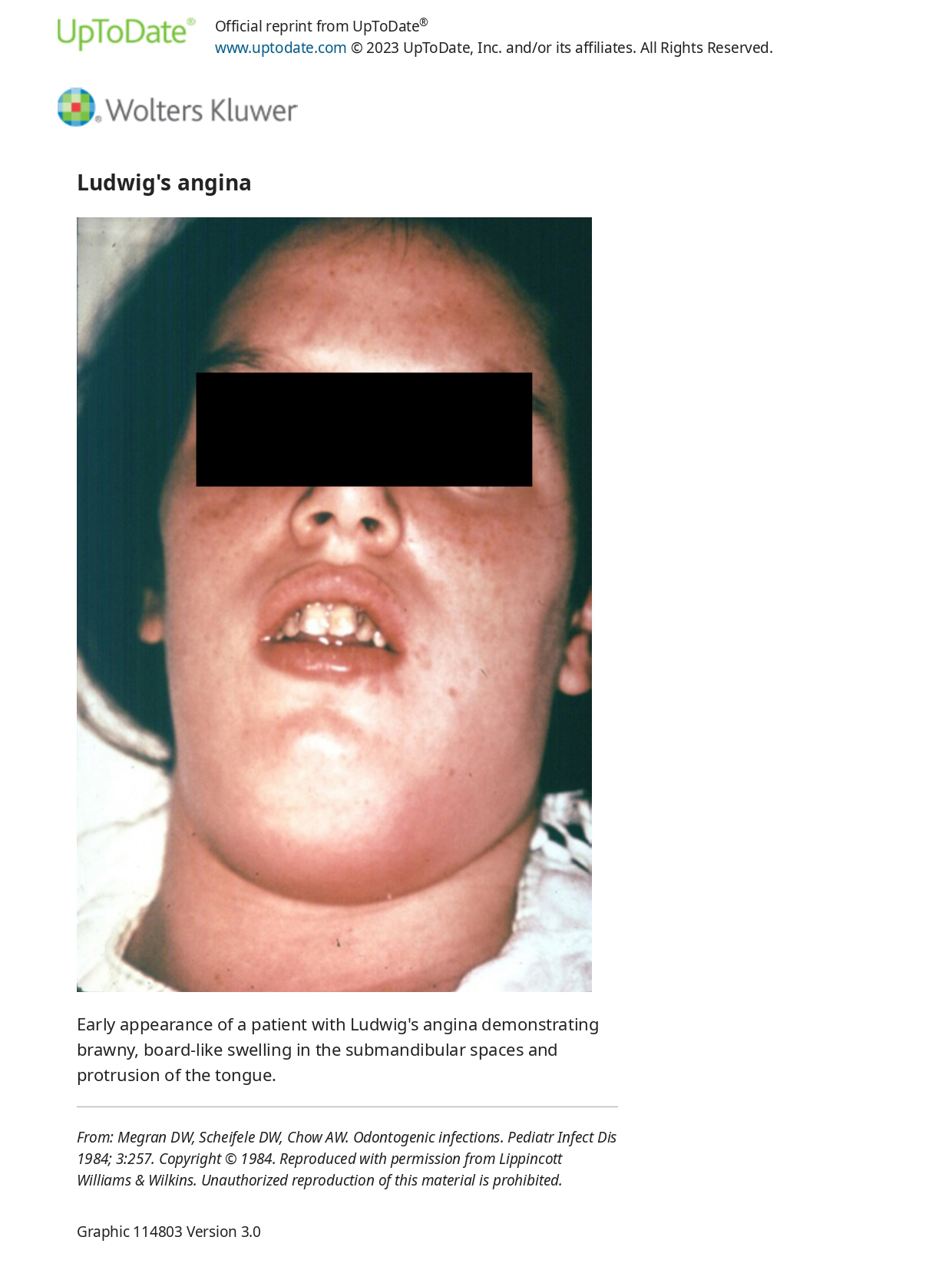
Інфекції паратрахеального простору — інфекції паратрахеального простору найчастіше виникають як наслідок перфорації передньої стінки стравоходу, іноді через безперервне розширення через інфекцію ретрофарингеального простору або як наслідок тривалої трахеостомії. Клінічна картина характеризується сильною задишкою, але першою скаргою може бути захриплість. Ковтання може бути утрудненим, а рідина може викидатися через ніс. Інфекція паратрахеального простору завжди серйозна через загрозу обструкції дихальних шляхів і можливе поширення в середостіння. Швидке хірургічне дренування має вирішальне значення для запобігання таким ускладненням.
Резюме та рекомендації
● Огляд. Глибокі інфекції шиї найчастіше виникають із септичного вогнища зубів нижньої щелепи, мигдаликів, привушної залози, глибоких шийних лімфатичних вузлів, середнього вуха або синусів. Оскільки ці інфекції часто починаються швидко і можуть прогресувати до ускладнень, що загрожують життю, клініцисти повинні знати про такі інфекції та не недооцінювати їх потенційний ступінь чи тяжкість.
● Анатомія. Глибока шийна фасція має три шари, поверхневий, середній і глибокий, які, як можна вважати, визначають серію циліндричних відділів, що простягаються поздовжньо від основи черепа до середостіння
● Мікробіологія. Інфекції шийного простору, як правило, є полімікробними і представляють нормальну резидентну флору суміжних поверхонь слизової оболонки, з яких походить інфекція. Найпоширенішими мікроорганізмами, виділеними з оральних або одонтогенних джерел інфекції, є стрептококи, зокрема стрептококи viridans, що відображає їх велику кількість у роті. Більшість абсцесів, що походять із зубів або горла, також містять ротові анаероби. Haemophilus influenzae також може бути збудником. Інфекції отогенного або синогенного джерела мають дещо іншу мікробіологію.
● Клінічні ознаки. Клінічні ознаки глибоких інфекцій шийного простору залежать від локалізації інфекції та зазвичай включають сильний біль у шиї або горлі та набряк із лихоманкою та системною токсичністю. При парафарингеальних і ретрофарингеальних інфекціях може спостерігатися випинання стінки глотки. Ускладнення включають ураження каротидної оболонки з інфекціями парафарингеального простору, поширення в середостіння з інфекціями ретрофарингеального простору та епідуральні абсцеси хребта з інфекціями паравертебрального простору, пов’язаними з шийним остеомієлітом.
● Діагностика. Пацієнти з підозрою на інфекцію глибокого шийного простору повинні пройти негайне обстеження, щоб підтвердити діагноз, визначити точне місце інфекції та оцінити потенційне поширення. Комп’ютерна томографія (КТ) є методом вибору. Магнітно-резонансна томографія (МРТ) корисна для оцінки ступеня ураження м’яких тканин і для визначення судинних ускладнень.
● Лікування — лікування глибоких інфекцій комірцевого простору включає антибіотикотерапію та аспірацію або хірургічний дренаж локалізованих утворень. Емпіричний вибір схеми антибіотиків залежить від джерела інфекції та певних особливостей пацієнта.
● Парафарингеальні та ретрофарингеальні інфекції — серед пацієнтів з парафарингеальними та ретрофарингеальними інфекціями ми пропонуємо наступне емпіричне охоплення. Приклади режимів наведено вище. Антибіотикотерапію можна скорегувати до більш вузької схеми, якщо є інформативні результати культурального дослідження (хоча анаеробне покриття зазвичай підтримується, навіть якщо анаероби не виділені). Тривалість терапії зазвичай становить два-три тижні, але ускладнення можуть вимагати більш тривалих курсів.
● Інфекції паравертебрального простору — інфекції паравертебрального простору зазвичай виникають через безперервне поширення інфекції шийного відділу хребта (такої як дисцит або вертебральний остеомієліт), через місцеві інструменти трахеї чи стравоходу або гематогенний посів. S. aureus є найпоширенішим патогеном; інші включають стрептококи, грамнегативні палички, включаючи P. aeruginosa, і анаероби. Для початкового лікування пацієнтів з інфекціями паравертебрального простору ми пропонуємо схему лікування антибіотиками, які мають активність проти S. aureus (включаючи MRSA), грамнегативних бактерій та анаеробів (ступінь 2C). Тривалість терапії ізольованої інфекції паравертебрального простору зазвичай становить два-три тижні, але довше, якщо також присутній остеомієліт.
● Інші інфекції глибокого шийного простору. Лікування інших інфекцій глибокого шийного простору, включаючи паратонзилярний абсцес, інфекції привушного та підщелепного простору, детально обговорюється в іншому місці. (Див. Клінічні настанови: менеджмент паратонзиліту та паратонзилярного абсцесу).
ДЖЕРЕЛО: https://www.uptodate.com/
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу
Пацієнти, які вакцинувалися проти COVID-19 ...

Вакцини проти COVID-19 та побічні ефекти, ...

Вплив COVID-19 на функціональні, когнітивн ...

Здавайте кров, нехай у світі пульсує життя ...
Типові проблеми з інфекційним контролем

5 щеплень, які потрібні дорослим, окрім CO ...