Рекомендації ESGO/ESHRE/ESGE по збереженню фертильності у пацієнток при лікуванні карциноми ендометрію
Дата публікації: 18.07.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: рак, фертильність, ендометрій, карцинома, синдром Лінча
Карцинома ендометрія є шостим за частотою діагностованим раком у жінок у всьому світі, при цьому зростає частота випадків у жінок у постменопаузі. Очікувана кількість нових випадків карциноми ендометрію у Європі у 2020 році становила 130 051 з 29 963 смертельними випадками, і захворюваність зростає зі старінням і збільшенням ожиріння населення. Хоча карцинома ендометрію не так часто зустрічається у жінок у пременопаузі, та її стандартне лікування в обсязі повної гістеректомії з двосторонньою сальпінгоофоректомією різко впливає на якість життя пацієнток і створює проблеми для клініцистів. Останні науково-обґрунтовані рекомендації Європейського товариства гінекологічної онкології (ESGO), Європейського товариства променевої терапії та онкології (ESTRO) і Європейського товариства патології (ESP) містять вичерпні рекомендації щодо всіх актуальних питань діагностики та лікування карциноми ендометрію. в міждисциплінарному середовищі. Розглянувши також підготовку до лікування, саме лікування та подальше спостереження для збереження фертильності, було визнано доцільним подальше розширення настанов щодо лікування карциноми ендометрія, що зберігає фертильність.
Було налагоджено співпрацю між ESGO, Європейським товариством репродукції людини та ембріології (ESHRE) та Європейським товариством гінекологічної ендоскопії (ESGE) з метою розробки клінічно значущих і науково обґрунтованих рекомендацій, зосереджених на ключових аспектах збереження фертильності під час лікування (відбір пацієнток, клініко-патологічна характеристика пухлини, лікування та спеціальні питання). Ці настанови призначені для використання всіма медичними працівниками, які беруть участь у лікуванні пацієнток із карциномою ендометрія, та у всіх суміжних дисциплінах. Незважаючи на те, що наша мета полягає в тому, щоб представити найвищий стандарт доказів щодо оптимального лікування, що зберігає фертильність, ESGO та ESHRE визнають, що існуватимуть великі відмінності в практиках між різними центрами в усьому світі, а також значні відмінності в інфраструктурі, доступі до медичних і хірургічних технологій, навчанні, медичних, фінансових і культурних аспектах, які впливатимуть на впровадження будь-яких рекомендацій щодо лікування
Обов'язки
Ці рекомендації є доказами та консенсусом міждисциплінарної групи розробників, що ґрунтується на їхніх поглядах і перспективах щодо прийнятих зараз підходів до лікування пацієнток із карциномою ендометрія, що зберігає фертильність. Очікується, що будь-який клініцист, який застосовує або консультується з цими рекомендаціями, буде використовувати незалежне медичне судження в контексті індивідуальних клінічних обставин для визначення плану лікування будь-якого пацієнта. Ці вказівки не надають жодних гарантій щодо їхнього вмісту, використання чи застосування, а автори відмовляються від будь-якої відповідальності за їх застосування чи використання будь-яким способом.
Що це означає для пацієнток
Карцинома ендометрію діагностується у жінок у пременопаузі не дуже часто. Стандартним лікуванням карциноми ендометрію є видалення матки та яєчників (тотальна гістеректомія з двосторонньою сальпінгоофоректомією). Незважаючи на ефективне збільшення шансів вижити після хвороби, це лікування є руйнівним для молодих жінок, які більше не зможуть виносити вагітність. Ця стаття містить клінічні вказівки для онкологів і спеціалістів з фертильності щодо лікування карциноми ендометрія, що зберігає фертильність, тобто лікування, яке може призупинити подальше прогресування раку та дозволити пацієнткам завагітніти до видалення матки та яєчників. Посібник містить рекомендації щодо найефективнішого лікування, а також те, як відібрати пацієнток, яким цей підхід може принести користь.
Методи
Рекомендації були розроблені за допомогою п’ятиетапного процесу, як визначено в посібнику стандартних оперативних процедур Комітету з настанов ESGO. Сильні сторони процесу включають створення мультидисциплінарної міжнародної групи розвитку, використання наукових доказів і консенсусу міжнародних експертів для підтримки настанов, а також міжнародний зовнішній процес перевірки (лікарів і пацієнток).
ESGO/ESHRE/ESGE призначив практикуючих клініцистів, які беруть участь у лікуванні пацієнток з карциномою ендометрію та які продемонстрували лідерство завдяки своєму досвіду в клінічній допомозі та дослідженнях, національній та міжнародній участі та профілю, а також відданості темам, що розглядаються, для роботи в експертній групі. Щоб переконатися, що твердження базуються на доказах, поточну літературу було переглянуто та критично оцінено. На основі зібраних доказів і клінічної експертизи група розробників склала настанови для всіх тем. Ці рекомендації обговорювалися та зберігалися, якщо вони були підкріплені науковими доказами достатньо високого рівня та/або коли було досягнуто широкого консенсусу серед експертів. За відсутності будь-яких чітких наукових доказів судження ґрунтувалося на професійному досвіді та консенсусі групи розробників.
Відбір пацієнток
Лікування карциноми ендометрія, що зберігає фертильність, є варіантом для підгрупи жінок, відібраних на основі ретельної оцінки репродуктивного потенціалу. Лікування, що зберігає фертильність, слід застосовувати виключно жінкам із ранньою стадією неметастатичного захворювання. Неявна оцінка пацієнтки повинна брати до уваги репродуктивний потенціал, а також фактори ризику, які впливають на можливість пацієнтки успішно виносити вагітність, включаючи стан матки.
На сьогодні немає літератури про репродуктивний потенціал конкретно для жінок з карциномою ендометрія, хоча слід припустити, що ті самі маркери фертильності застосовуються до цієї групи пацієнток, як і до будь-якої жінки фертильного віку. Маркери оваріального резерву, такі як антимюллерів гормон, кількість антральних фолікулів і рівні фолікулостимулюючого гормону на 2–5 день, а також вік та індекс маси тіла (ІМТ) пацієнток, можливо, можуть бути використані для оцінки функції яєчників і здатності яєчників виробляти зрілі ооцити після контрольованої стимуляції яєчників. Пацієнтки зі зниженим резервом яєчників все ще можуть отримати користь від операції зі збереження фертильності, намагаючись завагітніти гетерологічними ооцитами.
Як і для будь-якої жінки, яка бажає завагітніти, вік також є прогностичним фактором успіху у жінок з карциномою ендометрію. У нещодавньому метааналізі було виявлено, що найвищі шанси на живонародження у жінок з карциномою ендометрія були у жінок віком молодше 35 років (рівень живонароджуваності 30,7%). У дослідженнях, в яких брали участь жінки віком до 40 років, рівень народжуваності живих дітей становив 23,0%.
Кілька доказів вказують на тісний зв’язок між вагою та карциномою ендометрію. Дійсно, підтримка здорової ваги або ІМТ, а також зниження ваги за допомогою баріатричної хірургії або зміни способу життя у жінок із ожирінням знижують ризик карциноми ендометрія. Вважається, що надмірна вага або ожиріння негативно впливають на фертильність, зачаття, час до вагітності та результати вагітності. У жінок із надмірною вагою та ожирінням, які отримували терапію карциноми ендометрію для збереження фертильності, втрата ваги може позитивно вплинути на частоту вагітності та підвищити рівень живонароджуваності. Нещодавнє дослідження показало, що втрата ваги ≥5% значно збільшує шанси на вагітність і живонароджуваність у жінок із надмірною вагою та ожирінням. Дослідження продемонстрували позитивний ефект баріатричної хірургії щодо позитивної відповіді на внутрішньоматковий прогестин, зменшення системного запалення та рекрутування типів імунних клітин, що захищають ендометрій, і зниження циркулюючих біомаркерів резистентності до інсуліну (HbA1c та HOMA-IR).
Синдром полікістозних яєчників — це захворювання ендокринної системи жінок репродуктивного віку, яке проявляється полікістозом яєчників з патологічною матковою кровотечею. Він відомий як одна з причин карциноми ендометрію через тривалий вплив естрогену, а також постійний дефіцит прогестерону. Синдром полікістозних яєчників часто зустрічається у пацієнток з карциномою ендометрію віком до 35 років. Ці пацієнтки частіше страждають ожирінням, інсулінорезистентністю або мають більш пізні стадії захворювання. Інсулінорезистентність, стан із гіперінсулінемією та гіперглікемією через нездатність м’язів, печінки та жирових клітин поглинати та накопичувати глюкозу достатньою мірою, часто спостерігається у пацієнток із ожирінням і в найгіршому випадку може призвести до діабету 2 типу. Було виявлено, що жінки з синдромом полікістозних яєчників і карциномою ендометрію частіше не реагують на терапію медроксипрогестерону ацетатом. Супутні аномалії, такі як ожиріння, неплідність, безпліддя та діабет, можуть незалежно діяти як фактори ризику карциноми ендометрію. Ожиріння та синдром полікістозних яєчників додатково сприяють розвитку метаболічного синдрому. Морфологія полікістозних яєчників (не обов’язково синдром полікістозних яєчників) може бути прогностичним фактором у пацієнток з карциномою ендометрія, які досягли повної ремісії після фертильнозберігаючої терапії прогестинами, незалежно від ІМТ.Через ризики, пов’язані з метаболічним синдромом, важливо, щоб жінки з синдромом полікістозних яєчників знали про позитивні наслідки зміни способу життя та медикаментозного лікування для зниження ризику серцево-судинних захворювань і діабету 2 типу.
Синдром Лінча пов’язаний з розвитком карциноми ендометрію, часто з більш раннім віком, разом із передраковою або ранньою злоякісною стадією, яка виявляється та піддається лікуванню. Щодо лікування, що зберігає фертильність, немає консенсусу щодо того, чи можна розглядати пацієнток із карциномою ендометрія та синдромом Лінча як відповідних кандидатів, оскільки немає доказів безпеки консервативного підходу в цій популяції. Нещодавно було опубліковано систематичний огляд, що оцінює потенційні прогностичні фактори пацієнток із ранньою стадією карциноми ендометрія та комплексною атиповою гіперплазією ендометрію, які отримували лікування, що зберігає фертильність, але серед 1099 пацієнток лише дев’ять (0,8%) мали сімейний анамнез синдрому Лінча. Результати лікування жінок за допомогою цього консервативного підходу хороші, навіть якщо були описані летальні випадки після цього лікування.
Враховуючи особливості синдрому Лінча та його асоціації з іншими злоякісними пухлинами, при прийнятті рішення слід враховувати деякі моменти, зокрема:
- Молодший вік діагностики карциноми ендометрія та ймовірно вищий ризик прогресування захворювання.
- Ризик синхронного раку яєчників, який є третім за поширеністю раком у жінок із цим синдромом.
- Різні молекулярні механізми викликають хворобу, і не ясно, чи може гормональна терапія бути ефективною. Дійсно, при цьому синдромі ураження викликані генетичними мутаціями, а молекулярні механізми, задіяні в захворюванні, здається, відрізняються від механізмів спорадичного раку. Однак пацієнтки з синдромом Лінча можуть водночас також мати гіперестрогенний стан, який може бути причиною карциноми ендометрію і який потенційно можна лікувати прогестинами.
- Стійкість до консервативного лікування та рецидиви частіше зустрічаються у пацієнток з дефіцитом репарації невідповідності. У цьому випадку гістероскопічна резекція була описана як варіант для покращення результату.
Немає даних про різницю в лікуванні карциноми ендометрію та комплексної гіперплазії ендометрію, зокрема, у популяції з синдромом Лінча.
Рекомендації
Загальні рекомендації
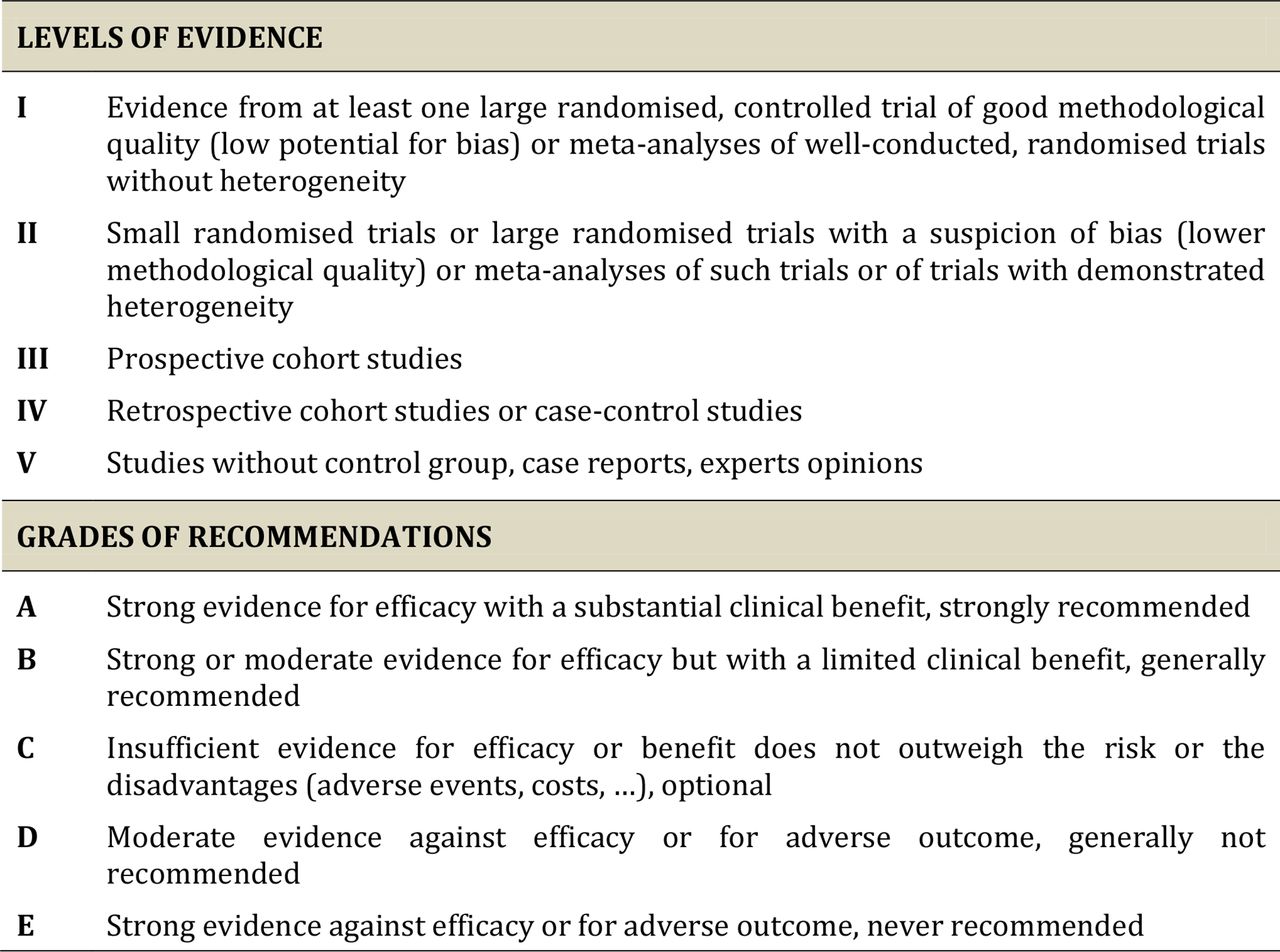
- Пацієнток, які бажають завагітніти, слід направити до спеціалізованої допомоги, особливо тих, хто має генетичний синдром (рівень доказовості V, ступінь A).
- Усім пацієнткам, які бажають завагітніти, слід запропонувати спільне спостереження і консультування за участю мультидисциплінарної команди щонайменше гінекологів-онкологів, спеціалістів з фертильності, патологів і радіологів (рівень доказовості V, ступінь A).
Репродуктивний потенціал
- На основі літератури не можна дати жодних рекомендацій. Однак оцінка репродуктивного потенціалу та консультація спеціалістів з фертильності повинні бути проведені перед лікуванням, що зберігає фертильність (рівень доказовості V, ступінь B).
Вікові обмеження залежно від віку
- Жінок слід проконсультувати щодо їхнього зменшення шансів народити живих дітей із власними гаметами з віком (рівень доказовості II, ступінь A).
Стан здоров'я, ожиріння
- Після лікування карциноми ендометрія, що зберігає фертильність, втрата ваги у жінок із надмірною вагою та ожирінням або підтримання здорового ІМТ є важливими для підвищення шансів на вагітність (природну або після допоміжних репродуктивних технологій) і живонародження. Тому наполегливо рекомендується якомога швидше втрачати вагу жінкам із надмірною вагою та ожирінням або підтримувати здоровий ІМТ після лікування, що зберігає фертильність (рівень доказовості II, ступінь A).
Синдром Лінча
- Необхідно визначити наявність будь-якого супутнього/метахронного раку (рівень доказовості II, ступінь A).
- Пацієнток слід поінформувати про вищий ризик персистенції/рецидиву порівняно з іншими пацієнтами (рівень доказовості II, ступінь A).
- Лікування, що зберігає фертильність у жінок із синдромом Лінча, слід обговорювати в кожному конкретному випадку (рівень доказовості II, ступінь A).
Клініко-патологічна характеристика пухлини
Патоморфологічна діагностика гіперплазії ендометрія та карциноми ендометрію має вирішальне значення для оптимальної стратифікації ризику та прийняття рішень щодо лікування; тому діагностичні помилки можуть сильно вплинути на результат лікування пацієнта. Було показано, що використання дворівневої класифікації Всесвітньої організації охорони здоров’я (ВООЗ) із двома діагностичними категоріями, гіперплазією без атипії та гіперплазією ендометрію/ендометріоїдною внутрішньоепітеліальною неоплазією, покращило відтворюваність. Розрізнення між атиповою гіперплазією ендометрія та добре диференційованою карциномою ендометрія показало погану згоду між спостерігачами. На додаток, існує погана згода між спостерігачами при оцінці ступеня карциноми ендометрія, особливо в матеріалі кюретажу. Три додаткові ретроспективні дослідження в одному закладі продемонстрували слабку кореляцію між взяттям зразків ендометрія перед операцією та остаточним діагнозом. Хоча Міжнародне товариство гінекологів-патологів рекомендує використовувати бінарну систему класифікації шляхом об’єднання оцінок 1 і 2 в одну категорію низького ступеня, що зменшує ступінь незгоди, для пацієнток, які бажають підходу до лікування, що зберігає фертильність, і надалі необхідно буде розрізняти 1 і 2 класи.
Взяття зразків ендометрія має неоптимальну точність у прогнозуванні ступеня пухлини порівняно з інтраопераційною біопсією, особливо на ранній стадії карциноми ендометрія при пухлинах низького/середнього ступеня (G1–G2). Тому, як було запропоновано в багатоцентровому проспективному дослідженні операцій зі збереження фертильності при карциномі ендометрія, друга думка експерта-патологоанатома є важливою для мінімізації ризику, пов’язаного зі збереженням матки.
Останні публікації підтримують використання імуногістохімічної оцінки кількох біомаркерів, таких як PTEN, PAX2, ARID1A або β-катенін, щоб виявити гіперплазію ендометрію/ендометріоїдну інтраепітеліальну неоплазію, згодом посилюючи згоду між спостерігачами. Однак, використання вищевказаних маркерів для діагностичних цілей все ще обговорюється.
Диференціація карциноми ендометрію є найважливішим предиктором стадії та відповіді на лікування прогестинами. Жінки з ендометріоїдною карциномою ендометрію ступеня 1 стадії IA (без інвазії в міометрій) мають більше шансів відповісти на лікування прогестинами, тоді як ймовірність розвитку прогресуючої хвороби в майбутньому є дійсно низькою. У доступній літературі є кілька повідомлень про випадки консервативного лікування карциноми ендометрія ступеня II стадії II. У багатоцентровому всесвітньому проєкті, схваленому Gynecologic Cancer Intergroup, серед 23 пацієнток з ендометріоїдною карциномою ендометрію ступеня IA стадії 2, які отримували гістероскопічну резекцію та прогестин, 17 пацієнток показали повну відповідь. Частота рецидивів склала 41,1%. П’ять молодих жінок з аденокарциномою ендометрію ступеня IA стадії 2, які бажали зберегти фертильність і з лікувальною метою отримували комбінований пероральний медроксипрогестерон ацетат/левоноргестрел-внутрішньоматковий пристрій, продемонстрували повну відповідь у трьох із п’яти випадків із частковою відповіддю у двох інших пацієнток. Серед чотирьох пацієнток із карциномою ендометрію ступеня IA стадії 2, яким призначали пероральний прийом мегестролу ацетату (160 мг на день) і метформіну (500 мг тричі на день) у випадках метаболічного синдрому, 75% (3/4) пацієнток мав повну відповідь; в однієї пацієнтки зафіксовано рецидив і знову досягнення повної відповіді, а четверта пацієнтка мала інвазію міометрія під час лікування, що зберігало фертильність. З восьми пацієнток із передбачуваною ендометріоїдною аденокарциномою 2 ступені стадії IA, які пройшли терапію, що зберігає фертильність, повна відповідь була виявлена у семи з восьми випадків, у трьох розвинувся рецидив, і вони отримували терапію, що зберігає фертильність.
Наріжним дослідженням для діагностики раку ендометрія є біопсія ендометрія. Використовується кілька методів отримання зразків тканини ендометрія, наприклад методи кюретажу за допомогою Pipelle, Novak, Vabra або дилатація та кюретаж із застосуванням гострих металевих кюреток, а також гістероскопічна біопсія ендометрія. Розширення та кюретаж протягом тривалого часу вважалися стандартними методами для отримання гістологічного діагнозу, і, незважаючи на численні недоліки, багато авторів все ще віддають їм перевагу. Falcone та інші показали, що порівняно з біопсією Pipelle дилатація та кюретаж асоціюються з найнижчою частотою (<10%) гістологічної недостатньої оцінки та краще корелюють з гістологічним результатом остаточного зразка. Кілька інших досліджень заперечують це і стверджують, що сліпий підхід дозволить взяти менш як 50% зразків порожнини ендометрію. Отже, майже 10% уражень ендометрія можна було пропустити — зокрема, вогнищеві аномалії з високим відсотком хибнонегативних результатів. Передбачається, що сліпі методи більше не повинні пропонуватися для отримання гістології ендометрія, а перевагу слід віддати візуально орієнтованому гістероскопічному підходу для діагностики карциноми ендометрію.
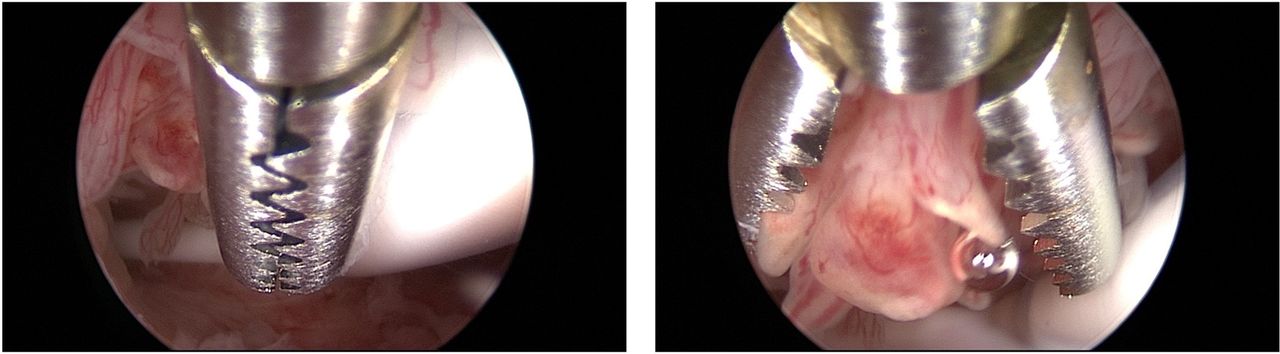
За останні 25 років гістероскопія та спрямована біопсія ендометрія були визнані золотим стандартом у діагностиці злоякісних новоутворень ендометрію. Біопсія ендометрія з технікою «захоплення» замінила традиційну гістероскопічну панч-біопсію, оскільки вона дозволяє видалити більшу частину тканини ендометрію. Ця методика забезпечує високу відповідність гістологічного типу та ступеня пухлини, особливо за наявності пухлини ендометріоїдного типу. Після визначення ділянки для біопсії крокодилові щипці розташовують із розкритими щелепами на рівні ендометрію, який потрібно взяти. Далі щелепи проводять по тканині приблизно на 0,5–1 см. У цей момент щелепи закриваються, захоплюючи шматок тканини, який потрібно дослідити, який потім разом із гістероскопом витягують із порожнини матки, не втягуючи кінчик щипців у операційний канал. гістероскопа.
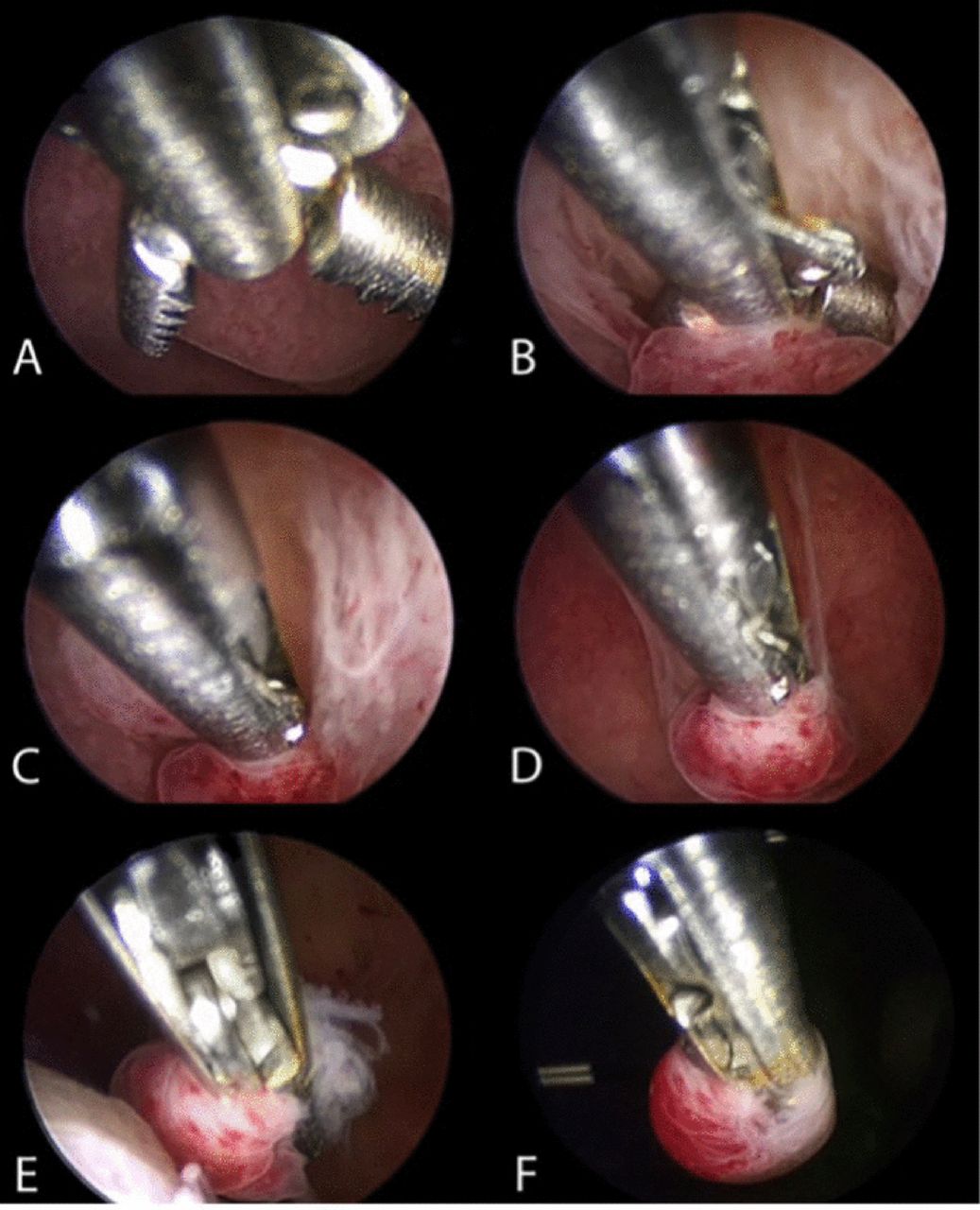
Якщо ділянка, яка підлягає біопсії, є гіпотрофічною/атрофічною, доцільнішою є інша техніка. Використовуючи біполярний електрод або ножиці 5 Fr, можна зробити точні розрізи для збору відповідних зразків тканини, які потім видаляються за допомогою щипців. Іншим варіантом може бути використання пристрою для внутрішньоматкового видалення тканини, який дозволяє забрати більшу кількість тканини, або біполярного офісного резектоскопа 15 Fr з ріжучою петлею, що дозволяє забирати тканину також із субендометріального шару.
Метааналіз 65 досліджень точності гістероскопії в діагностиці карциноми ендометрію, включаючи 26 346 жінок (29% у постменопаузі), оцінив діагностичну точність гістероскопії для виявлення карциноми та гіперплазії ендометрію. Загальна чутливість гістероскопії становила 86,4% зі специфічністю 99,2% для виявлення карциноми ендометрію. Метааналіз оцінював діагностичну точність біопсії ендометрія, виконаної під прямою гістероскопічною візуалізацією, порівняно зі сліпою або гістероскопічною діагностикою патології ендометрію. Дослідження включали загалом 1470 жінок і показали, що біопсія ендометрію під гістероскопічним контролем є точнішою для діагностики патології ендометрія, ніж сліпа або гістероскопічна біопсія.
Чи може гістероскопія збільшити розповсюдження пухлинних клітин у черевну порожнину, це стара дискусія; фактично було показано, що можливе поширення злоякісних клітин ендометрію в черевну порожнину після діагностичної гістероскопії не змінює стадію пухлини та не має негативного впливу на прогноз пацієнта. Пристрої для видалення тканин також не призводять до посиленого розповсюдження злоякісних клітин у черевну порожнину, якщо їх використовують як початковий метод біопсії при діагностиці карциноми ендометрію, і не пов’язані з хірургічним відновленням стадії пацієнток порівняно зі звичайними методами біопсії ендометрію. Система визначення стадії Міжнародної федерації гінекології та акушерства (FIGO) стверджує, що підтверджений діагноз позитивного перитонеального лаважу не змінює стадію пухлини та реєструється окремо від звіту, виданого про визначення стадії.
Слід визначити відсутність інвазії міометрія перед прийняттям рішення про продовження підходу, що зберігає фертильність. Переважна більшість опублікованих досліджень зосереджена на оцінці ефективності різних методів візуалізації для оцінки глибокої інвазії міометрія. Таким чином, методологія та статистичний аналіз налаштовані на оцінку чутливості та специфічності для визначення 50% інвазії міометрія. Немає конкретних даних для розрізнення між відсутністю інвазії міометрія та неглибокою інвазією міометрія. Отже, ефективність трансвагінального УЗД або МРТ для визначення відсутності інвазії міометрія або неглибокої інвазії міометрія екстраполюється з даних про діагностику глибокої інвазії міометрія.
Інвазію міометрія можна оцінити за допомогою різних методів, включаючи трансвагінальне ультразвукове дослідження та МРТ органів малого таза. Трансвагінальне ультразвукове дослідження та МРТ органів малого таза демонструють співставну діагностичну ефективність при оцінці інвазії міометрія та інвазії строми шийки матки на ранніх стадіях карциноми ендометрію. Систематичний огляд і метааналіз показали, що чутливість і специфічність трансвагінального УЗД для діагностики глибокої інвазії міометрія становить 75% і 82% відповідно. Чутливість і специфічність для МРТ згідно з тим же оглядом становить 83% і 82% відповідно, без будь-яких статистичних відмінностей. Переважна більшість досліджень повідомляє про подібні результати з чутливістю та специфічністю від 75% до 84% для трансвагінального ультразвуку та від 82% до 90% для МРТ (для діагностики глибокої інвазії міометрія). Чутливість і специфічність інвазії в строму шийки матки становить від 69% до 82% і від 93% до 96% як для трансвагінального УЗД, так і для МРТ.
Суб’єктивна оцінка інвазії міометрія дає найвищу діагностичну точність (загальна точність 75,7 %) порівняно з об’єктивними методами, такими як співвідношення найглибшої інвазії/нормального міометрія (загальна точність 67,3 %) або співвідношення пухлини/передньозаднього діаметра матки (загальна точність 68,1 %). Діагностична точність трансвагінального УЗД та МРТ є найвищою при проведенні фахівцями-практиками. Перевага МРТ перед трансвагінальним УЗД полягає головним чином у його внеску в оцінку позаматкових захворювань (тобто оцінка лімфатичних вузлів).
Імовірність позаматкового захворювання або ураження лімфатичних вузлів для ранньої стадії карциноми ендометрія низького ризику надзвичайно низька. Однак слід виконати основне клініко-рентгенологічне визначення стадії (оскільки хірургічне визначення стадії неможливе при підході, що зберігає фертильність). Усім жінкам з карциномою ендометрію слід проводити рентгенологічне дослідження органів грудної клітки, або комп’ютерну томографію, або звичайне рентгенівське дослідження, щоб виключити поширення в легенях. Абдомінальне ультразвукове дослідження (УЗД) або КТ можна використовувати для оцінки поширення на органи черевної порожнини. Лімфатичні вузли можна оцінити за допомогою КТ, МРТ або позитронно-емісійної томографії (ПЕТ-КТ). МРТ є хорошим діагностичним інструментом для виявлення тазових або парааортальних лімфатичних вузлів із низькою та помірною чутливістю, але високою специфічністю. ПЕТ-КТ показує найвищу специфічність, але помірну чутливість для виявлення метастазів у лімфатичних вузлах. Вибір діагностичного інструменту (УЗД, КТ, ПЕТ-КТ, МРТ) повинен здійснюватися індивідуально відповідно до особливостей пацієнта та доступності зображення. Синхронний або метастатичний рак яєчників зустрічається у 5–29% пацієнток з карциномою ендометрія, а молоді жінки у віці менше ніж 45 років мають у п’ять разів більше шансів мати синхронний рак яєчників, ніж жінки старше 45 років. Однак у жінок з низьким ризиком захворювання (відсутність інвазії міометрія, ендометріоїдна гістологія 1 ступеня, нормальні яєчники) випадків раку яєчників виявлено не було. Ураження придатків можна визначити за допомогою МРТ тазу або трансвагінального УЗД. Немає даних про систематичне використання біопсії сторожових лімфатичних вузлів в умовах збереження фертильності. Імовірність ураження лімфатичних вузлів при карциномі ендометрія низького ризику без інвазії в міометрій надзвичайно низька, тому біопсія сторожового лімфатичного вузла не рекомендована в рамках підходу, що зберігає фертильність.
Рекомендації
Огляд первинної патології досвідченим гістопатологом
- Рекомендується запитати другу думку досвідченого гістопатолога, якщо розглядається лікування, що зберігає фертильність (рівень доказовості III, ступінь A).
- Рекомендується система оцінювання G1, G2, G3. Бінарну систему класифікації карциноми ендометрія не слід використовувати для цих пацієнток (рівень доказовості III, ступінь A).
- Використання імуногістохімії (PTEN, ARID1A тощо) для оцінки кількох біомаркерів не рекомендується для діагностичних цілей (рівень доказовості IV, ступінь D).
Диференціація пухлини
- Лікування, що зберігає фертильність, розглядається для пацієнток з карциномою ендометрія 1 ступеня, стадія IA без інвазії міометрія та без факторів ризику (рівень доказовості V, ступінь A).
- Докази щодо ендометріоїдної карциноми ендометрію 2 ступні обмежені. Тому лікування, що зберігає фертильність, слід обговорювати в кожному конкретному випадку (рівень доказовості IV, ступінь C).
Отримання надійної гістопатологічної картини
- Для підтвердження діагнозу карциноми ендометрія гістероскопічно керована біопсія ендометрія є кращою перед сліпою біопсією (рівень доказовості III, ступінь A).
Інвазія міометрія
- Передопераційну оцінку інвазії міометрія у пацієнток з карциномою ендометрію слід проводити за допомогою МРТ або трансвагінального ультразвуку спеціалізованим рентгенологом/сонографістом. Для досягнення максимально можливої точності слід використовувати стандартизовані високоякісні протоколи МРТ (рівень доказовості III, ступінь A).
- КТ не слід використовувати для передопераційної оцінки інвазії міометрія у пацієнток з карциномою ендометрію (рівень доказовості III, ступінь A).
Виключити позаматкове захворювання/синхронне або метастатичне
- МРТ або КТ рекомендовано для виявлення тазових або парааортальних лімфатичних вузлів і віддалених метастазів (рівень доказовості II, ступінь B).
- Ураження придатків слід виключити за допомогою МРТ тазу або трансвагінального УЗД (рівень доказовості II, B).
Лікування
Наріжним каменем лікування, що зберігає фертильність, карциноми ендометрію та її попередника гіперплазії ендометрія традиційно є безперервна терапія на основі прогестину. Сьогодні немає рандомізованих контрольованих досліджень, які б порівнювали різні типи медикаментозного лікування у жінок з гіперплазією ендометрію або ендометріальною карциномою ендометрія 1 ступеня.
Метааналіз оцінював безпеку та ефективність доступного медичного лікування. Медроксипрогестерону ацетат і мегестролу ацетат є найбільш використовуваними прогестинами. Обидва застосовувалися перорально щодня, але дозування різнилися в різних дослідженнях, тоді як медроксипрогестерону ацетат також вводили внутрішньом’язово двічі на тиждень. Було показано, що мегестролу ацетат призводить до вищих показників ремісії, ніж медроксипрогестерону ацетат та інші гормональні препарати, можливо, завдяки його відносно вищій біодоступності після перорального прийому. Пацієнти, які отримували пероральний прогестин як монотерапію, мають більшу ймовірність рецидиву захворювання та більшої кількості системних побічних ефектів. Альтернативним способом введення прогестину є використання внутрішньоматкової спіралі з левоноргестрелом, але її ефективність не порівнювалася з пероральними прогестинами. Було показано, що цей пристрій у поєднанні з пероральними прогестинами або аналогами гонадотропін-рилізинг-гормону має задовільний рівень ремісії та низьку частоту рецидивів, з вищою сукупною ефективністю порівняно з лише внутрішньоматковим засобом левоноргестрелу. Аналоги гонадотропін-рилізинг-гормону демонструють задовільний рівень відповіді при застосуванні окремо та в поєднанні з внутрішньоматковою терапією прогестином або пероральними інгібіторами ароматази. У пацієнток із ожирінням аналоги гонадотропін-рилізинг гормону в комбінації з внутрішньоматковим засобом левоноргестрелу або пероральними інгібіторами ароматази вважаються кращими.
Тамоксифен оцінювався при лікуванні прогресуючої та рецидивуючої карциноми ендометрія, що дало суперечливі результати, тому цей вид лікування не використовувався на ранній стадії карциноми ендометрію. У літературі описано різні схеми лікування, включаючи використання гідроксипрогестерону капроату, норетистерону ацетату, природного прогестерону, інгібіторів ароматази (летрозол, анастрозол) і комбінованих оральних контрацептивів. Немає порівняльних досліджень для визначення їхньої ефективності. Кілька досліджень оцінювали їх, і немає досліджень, які б оцінювали окрему ефективність.
Комбіноване лікування з гістероскопічною резекцією з подальшим пероральним/внутрішньоматковим вивільненням прогестинів або аналогів гонадотропін-рилізинг-гормону виявляється ефективною альтернативою традиційному лікуванню, що зберігає фертильність, у молодих жінок з ендометріоїдною карциномою та гіперплазією ендометрія. Було показано, що він забезпечує точність визначення стадії пухлини, а також ураження міометрія та забезпечує оптимальну циторедукцію, сприяючи наступному терапевтичному ефекту прогестинів.
Mazzon та ін. вперше описали триетапну гістероскопічну резекцію вогнищевої ендометріоїдної карциноми ендометрія, що складається з резекції пухлинного вогнища (етап 1), ендометрія, прилеглого до ураження (4–5 мм назовні) (етап 2), і міометрія що лежить під вогнищем (3–4 мм) (крок 3); після того, як звіт про патологію підтвердив карциному ендометрію 1 ступеня (G1) без інвазії в міометрій, було призначено медикаментозне лікування мегестролу ацетатом (160 мг на день) протягом 6 місяців.
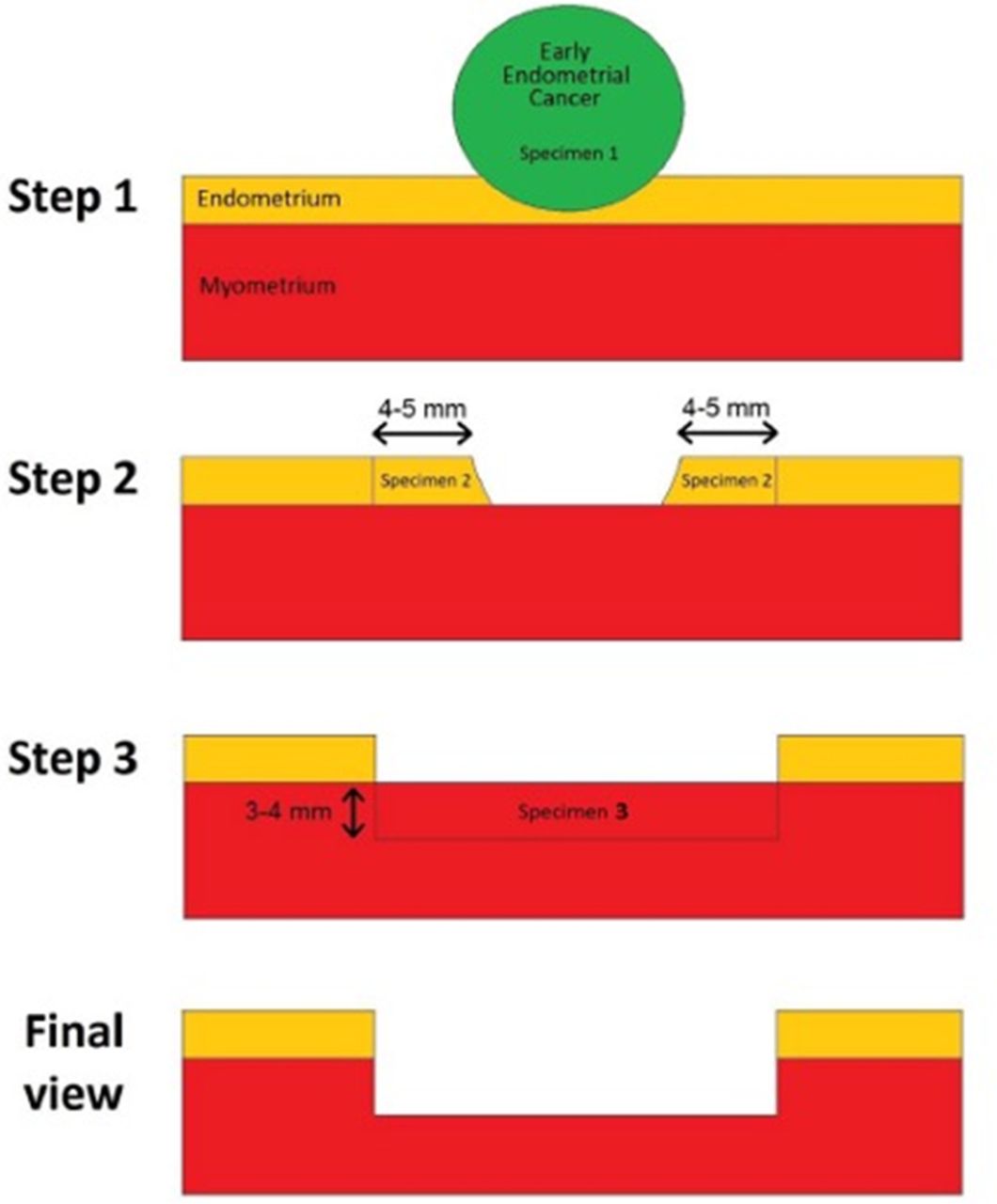
Giampaolino та інші описали комбіноване лікування для збереження фертильності, але вони розрізняли ранню карциному ендометрія та гіперплазію ендометрія. Пацієнткам з раннім діагнозом карциноми ендометрію проводили гістероскопічну резекцію за триетапною технікою Mazzon та ін., додаючи кілька випадкових біопсій ендометрію; левоноргестрелвмісний внутрішньоматковий пристрій було встановлено, коли гістологічне дослідження підтвердило ранню карциному ендометрію G1 на ураженні, при цьому навколишній ендометрій і міометрій, що лежить під ним, не мають захворювання. При діагностованій гіперплазії ендометрію хірургічне лікування полягало в поверхневій резекції ендометрію зі збереженням базального шару ендометрія з наступним встановленням левоноргестрелвмісної внутрішньоматкової спіралі одразу після процедури.
Систематичний огляд свідчить про вищу ефективність протоколу високих доз прогестинів. Як монотерапія рекомендована доза мегестролу ацетату становить 160–320 мг/добу, а медроксипрогестерону ацетату – 400–600 мг/добу. Левоноргестрел у дозі 52 мг є єдиним внутрішньоматковим прогестином, який коли-небудь оцінювався.
Точна тривалість лікування чітко не визначена. Однак більшість досліджень показали, що середній час до регресії становить від 4 до 6 місяців. Наявність факторів ризику, таких як ожиріння та резистентність до інсуліну, може вимагати більш тривалого лікування. Таким чином, 6–12 місяців є рекомендованою тривалістю терапії, протягом якої має бути досягнута повна відповідь. При відсутності відповіді через 6–12 місяців пропонується радикальне хірургічне втручання. Пороговою точкою для тривалості лікування для отримання повної відповіді було запропоновано 15 місяців: після цього часу відповіді не спостерігалося та/або онкологічну безпеку неможливо оцінити.
Метою консервативного лікування є отримання повної відповіді, яка визначається як негативна біопсія. Загальні показники відповіді після консервативного медикаментозного лікування з попереднім хірургічним гістероскопічним видаленням або без нього при ранній стадії карциноми ендометрія низького ступеня злоякісності є високими — від 75% до 79,4%. Значно найвищі показники повної відповіді досягаються при комбінації гістероскопічної резекції з подальшим лікуванням прогестином, пероральним або внутрішньоматковим введенням, який варіюється від 90% до 95,3%. Високі дози пероральних прогестинів показали повну відповідь від 76,3% до 77,7%, а левоноргестрелвмісний внутрішньоматковий пристрій з пероральними прогестинами — від 71,3% до 72,9%. Рівень часткової відповіді коливається від 4,7% до 7%, а рівень відсутності відповіді – від 17,2% до 20,9%.
Фактори, що впливають на частоту відповіді, визначені не повністю, але вони включають молекулярний профіль захворювання, вагу пацієнта (покращена швидкість відповіді у пацієнток з ІМТ <25 кг/м²), низький сироватковий маркер HE4 і низький гістологічний ступінь, а також морфологію полікістозних яєчників на УЗД, серед іншого; хоча недостатньо доказів їх клінічної користі для їх рутинного використання.
Немає доступних рандомізованих контрольованих досліджень, щоб встановити чіткий і суворий інтервал або метод оцінки для подальшого спостереження за пацієнтками після збереження фертильності при карциномі ендометрію. Однак, оскільки потрібне інтенсивне спостереження для оцінки відповіді ендометрію, більшість авторів рекомендують брати зразки ендометрію кожні 3–6 місяців шляхом дилатації та кюретажу або гістероскопічної біопсії. Найбільш встановленим і розумним варіантом спостереження є гістероскопічна біопсія ендометрія через 3 і 6 місяців. Дві послідовні біопсії ендометрія з повною відповіддю з мінімальним інтервалом у 3 місяці необхідні, щоб оцінити успіх лікування, що зберігає фертильність, і рекомендувати вагітність. Тоді, якщо досягнуто повної відповіді, необхідна контрольна біопсія rj;ys 3-6 місяців до настання вагітності або до виконання остаточної операції. У зв’язку з таким частим спостереженням, згода пацієнта є важливою для раннього виявлення повної відповіді або рецидиву після лікування, що зберігає фертильність.
Правильний метод виконання гістероскопічної біопсії ендометрію було описано вище, але слід зазначити, що внутрішньоматковий пристрій з левоноргестрелом не слід видаляти для виконання біопсії. Крім того, під час наступних візитів можуть бути рекомендований огляд органів малого таза та ультразвукове сканування. Якщо рецидив захворювання діагностовано під час спостереження, друга спроба збереження фертильності може дати повну відповідь, навіть якщо рівень повної відповіді дещо нижчий, ніж під час першого лікування.
Різні систематичні огляди свідчать про важливість застосування допоміжних репродуктивних технологій для досягнення вагітності у жінок, які пройшли курс лікування карциноми або гіперплазії ендометрія, що зберігає фертильність, щоб мінімізувати час до остаточної операції та таким чином мінімізувати ризик рецидиву. Попередні дослідження показали вищу ймовірність рецидиву, коли час досягнення повної відповіді довший. Тип стимуляції яєчників і протокол допоміжних репродуктивних технологій слід пристосовувати до особливостей кожної пацієнтки за погодженням з мультидисциплінарною командою, оскільки немає чіткої оптимальної тривалості, протоколу або кількості спроб стимуляції яєчників у цих пацієнток. Як і у випадку з протоколами стимуляції у пацієнток із раком молочної залози, застосування летрозолу з гонадотропінами показало додатковий захист при карциномі ендометрію.
Встановлено, що після лікування пероральними прогестинами, що зберігає фертильність, спостерігається вищий рівень вагітності та народжуваності порівняно з використанням лише внутрішньоматкового пристрою з левоноргестрелом. Метааналіз і систематичний огляд, що включав 28 досліджень і 1038 пацієнток, виявив, що частота настання вагітності в групі, яка отримувала пероральний прогестин, становила 34 %, а частота народжуваності — 20 %. У групах, які отримували лише левоноргестрелвмісний внутрішньоматковий пристрій або одночасно левоноргестрелвмісний внутрішньоматковий пристрій і прогестин, частота настання вагітності становила 18% і 40% відповідно, а частота народжуваності — 14% і 35% відповідно. Було виявлено, що комбіноване лікування з гістероскопічною резекцією з подальшою гормональною терапією дозволяє досягти вищих показників живонародження, ніж пероральний прийом прогестагену. Метааналіз, що включає 54 дослідження, показав, що рівень народжуваності живими становить 53% у групі гістероскопії порівняно з 33% у групі лише прогестину (p=0,09). Певні фактори пов’язані з кращим результатом вагітності. У ретроспективному дослідженні 68 жінок з ранньою стадією ендометріоїдного раку або гіперплазії ендометрія багатофакторний аналіз показав, що нормальний ІМТ, коротший час до повної ремісії, тривале 3-місячне лікування, менша кількість гістероскопічних процедур і товщий ендометрій пов’язані з успішною вагітністю.
Не вистачає досліджень, які б безпосередньо порівнювали допоміжні репродуктивні технології з вичікувальним лікуванням у жінок з карциномою ендометрія та без безпліддя в анамнезі. Пацієнти молодшого віку без відомого безпліддя в анамнезі можуть намагатися завагітніти природним шляхом за умови ретельного моніторингу та протягом визначеного часу, заохочуючи ширше використання допоміжних репродуктивних технологій без значних затримок. У проспективному дослідженні 232 жінок з ранньою карциномою або гіперплазією ендометрія, які намагалися завагітніти, 38% використовували допоміжні репродуктивні технології. На відміну від попередніх даних, показники вагітності та народжуваності живими були вищими в групі природного зачаття, ніж у групі допоміжних репродуктивних технологій (54,7 проти 40,7 і 49% проти 34% відповідно; p=0,04). У цьому дослідженні жінки, які використовували допоміжні репродуктивні технології, були значно старшими (p=0,03). Таким чином, пацієнтам було б корисно звернутися до фахівця з фертильності для ранньої консультації. Використання допоміжних репродуктивних технологій скорочує час до зачаття та дозволяє уникнути тривалої безперешкодної стимуляції естрогеном, що призводить до онкологічної безпеки та зниження ризику рецидиву та прогресування захворювання. Немає даних щодо акушерських та неонатальних результатів у дітей, народжених матерями з карциномою ендометрія.
Пацієнткам, які відмовляються від остаточного хірургічного втручання після пологів, і тим, хто не планує другу вагітність відразу після першої, слід рекомендувати відновити підтримуючу терапію за допомогою внутрішньоматкової спіралі з левоноргестрелом.
Gunderson та інші проаналізували 45 досліджень, у тому числі 280 пацієнток з карциномою ендометрію G1, які отримували прогестини. Вони виявили, що повна відповідь склала 48% із середнім часом відповіді 6 місяців; крім того, частота рецидивів після повної відповіді становила 35% і, нарешті, стійке або прогресуюче захворювання було виявлено у 25% зареєстрованих суб’єктів. Інший метааналіз, який включав молодих жінок з ранньою стадією карциноми ендометрія, показав, що повна відповідь на лікування спостерігається приблизно у 80% пацієнток, а плато відповіді настає через 12 місяців лікування прогестином. Рецидив виник у 17% через 12 місяців і у 29% через 24 місяці після лікування. Qin та інші повідомили про більш-менш подібні результати з частотою регресії 82,4% (95% ДІ від 75,3% до 88,7%) і частотою рецидивів 25,0% (95% ДІ від 15,8% до 35,2%). Віддалені онкологічні наслідки гістероскопічної резекції не були належним чином вивчені, але повідомляється, що частота рецидивів у дослідженнях жінок, які отримували комбіноване лікування, нижча, ніж в останніх дослідженнях лише прогестинової терапії. Casadio та інші провели найдовше спостереження з середнім періодом 36 місяців (діапазон 24–60) і повідомили про частоту рецидивів у 8,7% у жінок з гіперплазією ендометрія та 11,11% у жінок з карциномою ендометрія G1.
Повна відповідь на прогестини виявилася рідше серед пацієнток з ожирінням, ніж серед пацієнток без ожиріння (4/12 (33%) проти 35/41 (85%); p=0,001), а також у пацієнток з ІМТ ≥25 кг /м² (p=0,0007, OR=2,5; 95% ДІ від 1,4 до 4,3). Крім того, під час медіани спостереження протягом 39 місяців у 22,3% жінок розвинувся рецидив. Один хворий (0,09%) помер від захворювання. Обмежені дані вказують на те, що метформін може підвищити ризик рецидиву у пацієнток з ІМТ ≥25 кг/м². Хоча Новікова та інші повідомили, що левоноргестрел-внутрішньоматковий пристрій + аналоги гонадотропін-рилізинг-гормону + три процедури дилатації та вишкрібання були кращими порівняно з іншими методами лікування (повна відповідь=96%, p=0,026), коли проводилися дві дилатації та вишкрібання або перорально медроксипрогестерону ацетат, більшість інших даних не показали різниці в ефективності та частоті рецидивів між пероральними прогестинами та левоноргестрел-внутрішньоматковим засобом. Метааналіз показав, що гістероскопічна резекція з наступною терапією прогестином призвела до повної відповіді та частоти рецидивів 95,3% (95% ДІ від 87,8% до 100%) і 14,1% (95% ДІ від 7,1% до 26,1%), відповідно.
Пацієнтам, які частково відповідають на терапію прогестином через 6 місяців, можна порадити продовжити лікування ще на 3–6 місяців, а пацієнтам, які не відповіли на 6-місячне спостереження з персистуючим захворюванням, підтвердженим біопсією, слід рекомендувати гістеректомію.
Показання до ведення після вагітності, невдалих спроб завагітніти та консервативного рецидиву після лікування у цих пацієнток досі не з’ясовані. Немає загальноприйнятих рекомендацій щодо цього менеджменту. Усі звіти обмежені невеликими розмірами вибірки. За відсутності настанов і одностайної згоди керівництво покладається на рекомендації, ретроспективні дослідження та огляди.
Остаточне хірургічне лікування складається з тотальної гістеректомії з або без двосторонньої сальпінгоофоректомії та хірургічного стадіювання. Його слід рекомендувати після завершення виношування дитини через високу частоту рецидивів, у випадках рецидиву або відсутності відповіді на 6-12 місяців гормонального лікування, а також у випадках прогресування захворювання в матці або в іншому місці.
Метою остаточного хірургічного лікування є видалення матки, де найчастіше виникає рецидив. Таким чином, апріорне видалення яєчників не є виправданим (оскільки визначення стадії захворювання після первинного консервативного лікування більше не показано). Крім того, видалення яєчників не має терапевтичного ефекту. Метааналіз показав, що немає істотної різниці в загальній виживаності, якщо яєчники були або не були видалені під час гістеректомії на ранній стадії карциноми ендометрію. Таким чином, видалення яєчників має бути індивідуальним відповідно до віку пацієнтки, ймовірності ураження яєчників, генетичного/знайомого високого ризику первинного раку яєчників або наявності захворювання придатків. У випадках збереження яєчників рекомендується сальпінгектомія. Слід враховувати баланс між ризиками раку яєчників і наслідками хірургічної менопаузи, а також можна розглянути можливість замісної терапії естрогенами після двосторонньої сальпінгоофоректомії в пременопаузі. У пацієнток з високим ризиком хірургічного втручання або пацієнток, які відмовляються від остаточної операції, можна провести другий курс консервативного лікування (медикаментозна терапія або комбіноване лікування).
Оскільки деякі жінки, можливо, бажають зберегти свій репродуктивний потенціал, незважаючи на рецидив, можна розглянути повторне лікування для збереження фертильності. У відповідній літературі є обмежені повідомлення про ефективність повторного лікування для збереження фертильності у пацієнток із рецидивом, і не було досягнуто консенсусу щодо лікування рецидиву після збереження фертильності. У одноцентровому ретроспективному дослідженні було залучено 51 пацієнта, у яких була стійка хвороба (залишкова карцинома або гіперплазія ендометрія за результатами біопсії ендометрія), підтверджена дилатацією та кюретажною біопсією після 9 місяців терапії на основі прогестину. Усі пацієнти отримували ту саму дозу та тип прогестину, що й початкова терапія: 72,5% досягли повної відповіді за середній час 17,3 місяця; серед цих пацієнток у 32,4% стався рецидив. Якщо хвороба прогресує, настійно рекомендується тотальна гістеректомія з двосторонньою сальпінгоофоректомією та хірургічним стадіюванням.
Рекомендації
Підбір ліків
- Комбінований підхід, що включає гістероскопічну резекцію пухлини з наступним прийомом пероральних прогестинів та/або внутрішньоматкового пристрою з левоноргестрелом, є найефективнішим лікуванням, що зберігає фертильність як для повної відповіді, так і для живонароджуваності порівняно з іншими варіантами лікування (Рівень доказовості II , клас Б).
- Аналоги гонадотропін-рилізинг-гормону не слід розглядати як лікування першої лінії (рівень доказовості II, ступінь B).
Роль гістероскопічної резекції
- Якщо за матеріалом резекції є підозра на ранню та вогнищеву інвазію міометрія (1–2 мм), у кожному конкретному випадку можна обговорити підхід, що зберігає фертильність. За цих обставин повна гістероскопічна резекція вогнища з подальшим пероральним прийомом прогестинів та/або внутрішньоматкового пристрою з левоноргестрелом може бути запропонована як лікування, що зберігає фертильність (рівень доказовості IV, ступінь C).
Доза прогестинів
- Рекомендується пероральний прийом мегестролу ацетату в дозі 160–320 мг/добу або медроксипрогестерону ацетату в дозі 400–600 мг/добу (рівень доказовості III, ступінь В).
- Внутрішньоматковий пристрій з левоноргестрелом у дозі 52 мг окремо або в комбінації з пероральними прогестинами є безпечним і ефективним підходом (рівень доказовості III, ступінь B).
Тривалість лікування
- Рекомендована тривалість терапії становить 6–12 місяців, протягом яких має бути досягнута повна відповідь (рівень доказовості III, ступінь B).
- Максимальний час досягнення повної відповіді не повинен перевищувати 15 місяців (рівень доказовості IV, ступінь C).
- За відсутності будь-якої відповіді через 6 місяців рекомендується мультидисциплінарне консультування для адаптації лікування в кожному конкретному випадку (рівень доказовості IV, ступінь B).
Відповідь (часткова чи повна, чи відсутність відповіді)
- Рекомендується гістероскопічна резекція з подальшим введенням прогестинів перорально та/або внутрішньоматково, щоб досягти як найвищого рівня повної відповіді, так і найвищого рівня живонародження (рівень доказовості II, ступінь B).
- Настійно рекомендується контролювати вагу під час лікування, що зберігає фертильність, щоб збільшити ймовірність відповіді (рівень доказовості II, ступінь A).
Подальше спостереження з підтримуючим лікуванням для пацієнток, які бажають або не бажають завагітніти негайно
- Дві послідовні біопсії ендометрія, які демонструють повну відповідь з мінімальним інтервалом у 3 місяці, необхідні для оцінки успіху лікування, що зберігає фертильність (рівень доказовості IV, ступінь C).
- Повна відповідь є обов’язковою для подальшого спостереження з підтримуючим лікуванням до планування вагітності (рівень доказовості II, ступінь A).
- Клінічне обстеження органів малого таза та ультразвукове сканування рекомендовано під час кожного 3-місячного контрольного візиту (рівень доказовості IV, ступінь B).
- Гістологічний аналіз ендометрію слід проводити кожні 3–6 місяців за допомогою гістероскопії відповідно до результатів візуалізації (рівень доказовості IV, ступінь B).
- МРТ можна розглядати в кожному окремому випадку (рівень доказовості IV, ступінь C).
Вагітність
- Жінок, які проходять лікування гіперплазії або карциноми ендометрія для збереження фертильності, слід заохочувати активно прагнути завагітніти, як тільки буде досягнуто повної відповіді (рівень доказовості V, ступінь B).
- Слід розглянути допоміжні репродуктивні технології, щоб підвищити рівень успішності та скоротити проміжок часу до зачаття без підвищеного ризику рецидиву (рівень доказовості III, ступінь B). Проте природне зачаття може розглядатися у жінок з хорошим репродуктивним потенціалом протягом визначеного часу (6–9 місяців) (рівень доказовості V, ступінь C).
- Жінкам, які відмовляються від хірургічного втручання після пологів і не планують другу вагітність одразу після першої, слід продовжувати ретельний нагляд міждисциплінарної групи та рекомендувати підтримуючу терапію за допомогою внутрішньоматкового пристрою з левоноргестрелом (рівень доказовості III, ступінь). Б).
Частота рецидивів після лікування, що зберігає фертильність
- Ризик рецидиву після лікування карциноми ендометрія, що зберігає фертильність, може бути однаковим для прогестинів або левоноргестрелу внутрішньоматкового пристрою (рівень доказовості II, ступінь B).
Остаточні та завершальні операції
- Радикально операція рекомендована у випадках відсутності відповіді, неможливості завагітніти, рецидиву або прогресування захворювання (рівень доказовості II, ступінь A).
- Для пацієнток із сильним бажанням зберегти фертильність можна розглядати другий консервативний підхід у кожному конкретному випадку (рівень доказовості IV, ступінь B).
- Завершальна операція рекомендована після завершення дітородіння (рівень доказовості II, ступінь A).
- Видалення яєчників слід розглядати в кожному конкретному випадку (рівень доказовості III, ступінь B).
Особливі питання
Незважаючи на невелику кількість доступних досліджень, докази яких не настільки надійні, консервативне лікування може розглядатися у жінок з ранньою стадією ендометріоїдної аденокарциноми G2 (стадія IA G2 карциноми ендометрію) або з добре диференційованою ендометріоїдною аденокарциномою G1 з мінімальною інвазією в міометрій (1– 2 мм). Обидва ці результати були критеріями виключення консервативного лікування в минулому. Комбіноване лікування, описане вище, що складається з гістероскопічної резекції ендометрію з подальшим пероральним/внутрішньоматковим вивільненням прогестинів або аналогів гонадотропін-рилізинг-гормону, здається можливим і безпечним для цих жінок.
Позитивний статус рецепторів естрогену та рецепторів прогестерону асоціюється з більш сприятливим результатом у більшості пацієнток з карциномою ендометрію I типу. Однак їх прогностичне значення не є загальновизнаним і залишається незрозумілим. Zhang та інші провели систематичний огляд і мета-аналіз швидкості експресії рецепторів естрогену та прогестерону в карциномі ендометрія, який включав 48 і 38 досліджень відповідно. Вони показали, що позитивність рецепторів естрогену та прогестерону є незалежним сприятливим прогностичним фактором для виживання.
Метааналіз 13 досліджень, які включали 635 пацієнток, показав, що експресія рецепторів естрогену та прогестерону є значним прогностичним фактором відповіді при гіперплазії ендометрія та ранній карциномі ендометрія на консервативне лікування з використанням внутрішньоматкового пристрою з левоноргестрелом, але не пероральними прогестинами. Однак автори прийшли до висновку, що їх точність недостатня для визначення в клінічній практиці.
Гормональне лікування прогестинами може бути лікуванням вибору для молодих жінок з гіперплазією ендометрія або карциномою ендометрія низького ступеня злоякісності, які бажають зберегти фертильність. Проте повна відповідь і частота рецидивів коливаються відповідно від 66,7% до 79,7% і від 19% до 34%. Після цього включення біології пухлини в алгоритми лікування може допомогти в розробці більш точних моделей стратифікації ризику для спрямування лікування. Недостатньо даних для рутинного використання кількох імуногістохімічних прогностичних маркерів у клінічній практиці. Імуногістохімічна оцінка рецепторів естрогену та прогестерону перед лікуванням не виявилася точною для прогнозування відповіді на лікування, тоді як на їх експресію впливають інші параметри, такі як ожиріння. Дослідження інших молекул, які, як повідомляється, беруть участь у канцерогенезі ендометрію, таких як PTEN, ARID1A, L1CAM і β-катенін, можуть виявитися корисними. Зокрема, мутаційний аналіз CTNNB1 і TP53 може допомогти виявити підгрупу пацієнток із ранньою стадією карциноми ендометрія низького ступеня тяжкості, які мають вищий ризик рецидиву, у той час, як було виявлено, що імуногістохімічна експресія β-катеніну була значно підвищена у пацієнток із карциномою ендометрію з прогресуванням порівняно з без прогресування після лікування для збереження фертильності.
Молекулярний класифікатор ProMisE продемонстрував прогностичну значущість при карциномі ендометрію, що дозволяє провести ранню стратифікацію клінічних випробувань, направлення на тестування на спадковий рак і визначення ризику безпосереднього лікування. Його можна застосовувати у зразках біопсії ендометрія або кюретажу з високою відповідністю з матеріалом гістеректомії. ProMisE ідентифікує чотири молекулярні підтипи карциноми ендометрію на основі Атласу геному раку за допомогою імуногістохімії та секвенування для домену екзонуклеази POLE. Відповідні чотири підгрупи – це ті, у яких недостатня репарація невідповідності, POLE-мутації, пов’язані з дуже сприятливими результатами, і експресія р53 дикого типу або аномальна (p53wt або p53abn, відповідно), остання пов’язана з агресивним захворюванням. Що стосується невеликої групи пухлин, які називаються «кількома класифікаторами», які містять більше ніж одну молекулярну класифікаційну ознаку, зокрема ті, що мають профіль p53abn або POLEmut-p53abn з дефіцитом репарації невідповідності, були підтверджені докази, щоб віднести їх до категорії репарації невідповідності одного класифікатора — дефіцитний або POLEmut, оскільки результати відповідають прогнозованим молекулярним підтипом драйвера. Після цього всі молекулярні тести слід проводити разом.
У молодшій віковій групі з карциномами ендометрія низького ступеня злоякісності стадії IA найбільшу користь від лікування прогестероном спостерігають у жінок, які мають пухлини дикого типу p53. Оскільки рідкісні пухлини p53abn мають більшу ймовірність прогресування, консервативна терапія, ймовірно, буде недоречною, тоді як для POLE-мутованих карцином вибір лікування в консервативну еру все ще неясний. Що стосується пухлин з дефіцитом репарації невідповідності, вони, здається, зазвичай мають вищу стадію, менше реагують на терапію прогестероном і мають високий прогностичний ризик рецидиву після початкової регресії. Крім того, жінки з пухлинами з дефіцитом репарації невідповідності повинні пройти тестування на синдром Лінча, оскільки вони можуть бути носіями патологічних варіантів гена з дефіцитом репарації невідповідності. Якщо виявлено синдром Лінча, необхідна відповідна консультація щодо ризику розвитку додаткових видів раку.
На жаль, кількість досліджень, які оцінювали, чи може класифікація ProMisE надати важливу інформацію щодо вибору лікування для молодих жінок з карциномою ендометрія низького ступеня злоякісності та низькою стадією, які бажають зберегти фертильність, обмежена. Наявні дані не показують, що в контексті захворювань низького ризику молекулярна класифікація додає прогностичну цінність. Необхідні великі проспективні дослідження, щоб підтвердити його клінічну корисність.
Рекомендації
Стан рецепторів естрогену та/або прогестерону
- Експресія естрогену та прогестерону, здається, є прогностичною відповіддю на консервативне лікування та може бути корисною для консультування пацієнток (рівень доказовості III, ступінь C).
- Негативний рівень естрогену та прогестерону не є протипоказанням для лікування, що зберігає фертильність (рівень доказовості III, ступінь C).
Молекулярний профіль карциноми ендометрія з раннім початком і кореляція з відповіддю на лікування
- Виконання молекулярного класифікатора ProMisE у всіх молодих пацієнток із карциномою ендометрію 1 ступеня низької стадії, які бажають зберегти фертильність, рекомендується, хоча наявні дані не дозволяють клінічне застосування (рівень доказовості IV, ступінь B).
- Імуногістохімія для ідентифікації пухлин з дефіцитом репарації невідповідності є обов’язковою для виявлення пацієнток із високим ризиком синдрому Лінча (рівень доказовості III, ступінь A).
- Якщо виявлено синдром Лінча, пацієнти повинні пройти відповідне консультування щодо ризику розвитку додаткових видів раку (рівень доказовості III, ступінь A).
- У пухлини з фенотипом p53abn слід розглянути тестування на мутацію MSH-H і POLE, щоб визначити, чи належить пухлина до множинних класифікаторів або до високомолекулярної підгрупи з числом копій (рівень доказовості III, ступінь A).
- У жінок, які мають пухлини з високим числом копій (p53abn), консервативна терапія буде недоречною (рівень доказовості IV, ступінь D).
ДЖЕРЕЛО: https://ijgc.bmj.com/
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Обсяг та інтенсивність щоденної фізичної а ...

Генетичні асоціації ключових генів у патог ...

Березень — місяць обізнаності про колорект ...
Як діяти онкопацієнтам, якщо в лікарні зак ...

Ризик раку через газові плити виявився май ...

Вчені з'ясували, як клітини-кілери організ ...