Біопсія плеври
Дата публікації: 01.04.2024
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: біопсія, пункція, плевра, торакоцентез
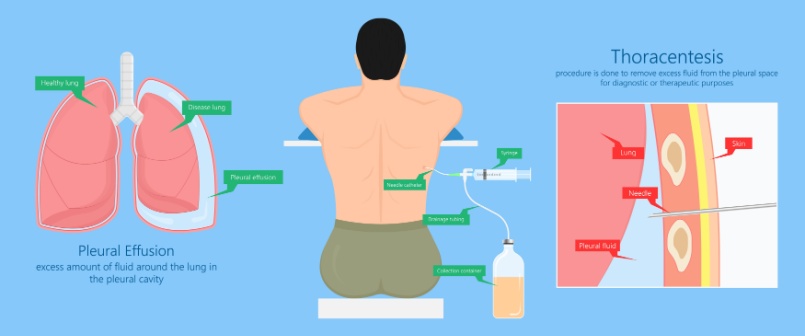
Вступ
Захворювання плеври вражають парієтальну та вісцеральну плевру і можуть мати інфекційне, запальне або злоякісне походження, що часто призводить до плеврального випоту. Діагностична оцінка плеврального випоту повинна включати відповідний анамнез, клінічний перебіг та рентгенологічні аномалії та брати до уваги бажання пацієнта продовжувати агресивне лікування. Початкова оцінка починається з торацентезу та характеристики рідини як транссудату або ексудату, її зовнішнього вигляду, каламутності та навіть запаху (тобто уринотораксу). Подальший аналіз включає хімічні, мікробіологічні, цитологічні та специфічні аналізи залежно від підозрюваної етіології. Транссудативна плевральна рідина помилково класифікується як ексудат у 25% випадків. Для того, щоб зменшити помилкову класифікацію, особливу увагу слід приділяти відмінностям між сироватковим і плевральним білком і альбуміном сироватки та плеврального альбуміну. Різниця понад 3,1 г/дл і понад 1,2 г/дл відповідно вказує на транссудат. Рідко пухлинні захворювання плеври можуть проявлятися у вигляді транссудату. Однак 40% плевральних випотів залишаються недіагностованими після первинного торакоцентезу.
Первинні злоякісні новоутворення плеври, як правило, походять із парієтальної плеври та поширюються на вісцеральну плевру, тоді як метастатичне захворювання (тобто бронхогенна карцинома) починається на вісцеральній плеврі та поширюється на парієтальну плевру. КТ грудної клітини з контрастним підсиленням показана при недіагностованому ексудативному випоті для оцінки аномалій паренхіми та ступеня ураження плеври. Наступна плевральна біопсія показана для оцінки та виключення інфекційної та злоякісної етіології, зокрема злоякісної мезотеліоми. Розлади сполучної тканини, такі як ревматоїдна хвороба, також можуть проявлятися ураженням плеври, що потребує біопсії плеври для діагностики. Крім того, потовщення плеври за відсутності плеврального випоту може потребувати подальшого гістологічного дослідження. Попри широке обстеження, етіологія плеврального випоту залишається неясною майже у 20–25 % випадків.
Karpathiou та інші провели ретроспективний аналіз 100 випадків неспецифічного плевриту, пов’язаного з доброякісною етіологією, і запропонували гістопатологічну систему оцінки для подальшої характеристики основного захворювання. Напівкількісні оцінки базувалися на ступенях запалення, фіброзу, судинної проліферації, крововиливів, фібрину, набряку та мезотеліальної гіперплазії на плевральній біопсії. Найвищі загальні бали були пов’язані з бактеріальними та аутоімунними захворюваннями, потім ліками та вірусами, а найнижчі – з пневмотораксом та серцевою етіологією. Більш високі ступені фіброзу та проліферації судин були пов’язані з бактеріальною етіологією. Автори припускають, що система оцінки та гістологічні картини можуть допомогти визначити основну етіологію.
Якщо показана біопсія плеври, доступні різні методики біопсії для діагностики захворювання плеври. Вони варіюються від старих методів, таких як «сліпа» або закрита біопсія плеври, до біопсії під контролем зображення та торакоскопії. Останні методи мають вищу діагностичну ефективність і забезпечують кращу діагностичну чутливість. Крім того, застосування імуногістохімії забезпечує підвищення діагностичної точності.
Показаннями до проведення біопсії плеври є:
- Недіагностований ексудативний лімфоцитарний плевральний випіт
- Плевральна маса, потовщення або вузлуватість
- Рецидивний плевральний випіт невідомої етіології
Закрита голкова біопсія плеври
Голки Копа та голки Абрамса, як показано на зображеннях нижче, найчастіше використовуються для сліпої або закритої пункційної біопсії. Ця процедура, як правило, виконується в умовах великого плеврального випоту без будь-яких зображень, крім рентгенографії грудної клітки.

Голка Cope містить зовнішню голку 11G (B) з регульованим упором голки (A). Внутрішній троакар для біопсії 13G (C) має форму гачка для взяття зразка плевральної біопсії. Внутрішня голка (D) має підігнаний стилет. (Зображення використано з дозволу, люб’язно наданого Dyna Medical Corporation.)

Голка Cope містить зовнішню голку 11G з регульованим упором голки та внутрішню петлю для біопсії 13G (A). Внутрішня голка має припасований стилет (B). (Зображення використано з дозволу, люб’язно наданого Dyna Medical Corporation.)

Голка Абрамса (A) зовнішня канюля з наконечником троакара та ріжучим вікном, яке можна закрити поворотом внутрішньої трубки (B) внутрішнього стилета. (Зображення використано з дозволу, люб’язно наданого Dyna Medical Corporation.)

Повна збірка голки Abrams з голкою для стилета. Голка знаходиться в закритому положенні. (Зображення використано з дозволу, люб’язно наданого Dyna Medical Corporation.)
Процедура
Пацієнта встановлюють у положення та вибирають місце для біопсії після ретельного фізичного огляду та перегляду зображень. У асептичних умовах місцево вводять лідокаїн для анестезії обраного місця. Лезом скальпеля робиться невеликий надріз на шкірі.
Голку Копа зі стилетом вводять через розріз шкіри на верхній поверхні ребра з метою запобігання пошкодженню судинно-нервового пучка. Голку просувають до отримання плевральної рідини. Потім стилет видаляють і вводять троакар для біопсії. Шприц об’ємом 50 мл приєднується до біопсійної голки, яка забезпечує замкнуту систему, через яку плевральну рідину можна забрати, підтверджуючи розташування біопсійної голки в плевральній порожнині. Біопсійну голку повертають прямокутним виступом вниз. І зовнішня канюля, і троакар для біопсії частково витягуються, доки не буде залучена парієтальна плевра. Троакар для біопсії обережно витягується однією рукою, а зовнішня канюля просувається обертальними рухами. Ця дія дозволяє розсікти тканину плеври та міжреберні м’язи.
Голку для біопсії видаляють, під час чого пацієнта просять вимовити звук «ЕЕЕЕЕ», щоб мінімізувати ризик потрапляння повітря. Зразок для біопсії збирають доданим шприцом із застосуванням позитивного тиску. Місце введення голки спостерігають на наявність ускладнень кровотечі та накладають пов’язку, що давить, щоб запобігти підшкірному накопиченню плевральної рідини.
Плевральна біопсійна голка Abrams складається з 3 частин, з 2 концентричними трубками та стилетом. Зовнішня трубка має вістря троакара та глибоку виїмку позаду вістря троакара, яку можна закрити обертальним рухом внутрішньої трубки, що дозволяє розрізати тканину плеври. Загальна техніка плевральної біопсії за допомогою голки Абрамса подібна до описаної для голки Копа.
Сліпа біопсія плеври також виконується з використанням голки Tru-cut у разі помірного та великого плеврального випоту з результатами, які можна порівняти з результатами, отриманими голками для плевральної біопсії Abrams і Cope. Однак голка Tru-cut зазвичай використовується з контролем зображення за допомогою ультразвукового дослідження або КТ.
Новіший метод із застосуванням щипців для ретроградної біопсії (Retroforceps, Karl Storz, Tuttlingen, Німеччина) був запропонований Wiewiorski та ін. Техніка, здійсненність і продуктивність плеври були оцінені під час торакоскопічного дослідження трупа. Хірург не бачив торакоскопії, і було виконано 20 закритих біопсій плеври (10 лівого гемітораксу та 10 правого гемітораксу). Дев'ятнадцять із 20 спроб біопсії призвели до взяття зразка парієтальної плеври, підтвердженого торакоскопічно. Автори постулювали, що ця методика може зменшити ускладнення, пов’язані із закритою біопсією плеври, такі як ризик пневмотораксу та ускладнень кровотечі, використовуючи закриту систему з відсмоктуванням і необов’язковим шприцевим приєднанням, а також конструкцію з тупим кінчиком. Одним з обмежень запропонованої методики є те, що біопсійні щипці необхідно видаляти після кожної біопсії. Ця закрита методика та техніка з використанням УЗД вимагає подальшої оцінки в клінічних умовах із порівнянням з іншими доступними методами біопсії плеври.
Ускладнення та запобіжні заходи
Пошкодження суміжних органів під час біопсії плеври, включаючи печінку, нирки та селезінку, зустрічається рідко. Рентгенографія грудної клітки рекомендована для виключення негайних післяопераційних ускладнень, включаючи пневмоторакс. Частота пневмотораксу при закритій пункційній біопсії становить приблизно 8-18%.
Відносним протипоказанням до проведення біопсії плеври вважаються геморагічні стани. Коагуляційний профіль слід відкоригувати перед будь-якою процедурою біопсії, щоб мінімізувати ризик кровотечі, включаючи гематому грудної стінки та гемоторакс.
Діагностичні переваги та обмеження
Біопсія плеври під контролем зображення є безпечною та дає можливість зробити біопсію аномальної тканини плеври, збільшити ефективність діагностики незалежно від потовщення плеври та отримати зразки в областях, розташованих ближче до середньої лінії та діафрагми, де більша ймовірність появи злоякісних відкладень. Ріжуча біопсійна голка виявляється більш чутливою до злоякісних пухлин, ніж тонкоголкова аспірація, з чутливістю 91% у діагностиці мезотеліоми. Попередні дослідження демонструють чутливість до 88% для чутливості ріжучої голки за зображенням у діагностиці злоякісних пухлин та чутливість майже 100% у діагностиці мезотеліоми, якщо ураження становить не менше 20 мм у будь-якому напрямку.
Наведення зображень також можна використовувати з голкою Абрамса з чутливістю, як повідомляється, 60%-77,4% при виборі місця за допомогою УЗД і 87,5% при біопсії плевральної голки Абрамса під контролем КТ. Koegelenberg та ін. у 2010 і 2015 роках повідомили про ефективність діагностики пункційної біопсії Абрамса за допомогою ультразвукового дослідження 80%-90% для туберкульозу плеври та 83%-90% для злоякісних пухлин плеври.
Діагностична ефективність біопсії плеври під контролем КТ також збільшується при потовщенні плеври 1 см або більше. За цих обставин чутливість біопсії ріжучою голкою зростає до 87%, а чутливість біопсії голкою Абрамса під КТ-контролем – до 95%.
Рівень ускладнень нижчий для біопсії під контролем зображення, ніж для сліпої плевральної біопсії, особливо у зв’язку з пневмотораксом. Цей захисний ефект також було продемонстровано в порівнянні між біопсіями під контролем УЗД і КТ, з меншою кількістю пневмотораксів у групі УЗД (5,5% проти 14,7%), хоча пацієнти не були рандомізовані. Пацієнти, які не можуть затримати дихання під час біопсії, або через основну патологію легенів, або через вентиляцію з позитивним тиском, більш схильні до розвитку ускладнень пневмотораксу та травми легенів.
Висновок
Закриту біопсію плеври слід зарезервувати для підозрюваних дифузних процесів у місцях з обмеженими ресурсами та високою поширеністю туберкульозу, де біопсія плеври під контролем зображення недоступна, а оператори можуть підтримувати процедурну компетентність. КТ з контрастним підсиленням виділяє уражені ділянки плеври та визначає аномалії паренхіми, які слід отримати до біопсії або торакоскопії під контролем зображення. Біопсія плеври під контролем зображення має бути основним методом дослідження, коли торакоскопія недоступна для недіагностованих ексудативних плевральних випотів, особливо на тлі потовщення плеври, завдяки її діагностичній ефективності, низькій частоті ускладнень і доступності. Торакоскопія (плевроскопія або VATS) залишається стандартним критерієм для оцінки захворювань плеври завдяки незмінному профілю безпеки, діагностичній ефективності та терапевтичним перевагам, але вона може бути непридатною для всіх пацієнтів.
ДЖЕРЕЛО: https://emedicine.medscape.com
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Захисна роль грудного вигодовування при ра ...
Світловий датчик може виявляти низькі конц ...
Відстрочка хірургічного лікування меланоми ...

Переваги 3D мамографії у скринінгу раку мо ...
Як діяти онкопацієнтам, якщо в лікарні зак ...
В Україні вперше з’явився медичний стандар ...

.jpg)
