Папіломавірусне ураження шийки матки: патогенез і лікувальні заходи
Дата публікації: 10.10.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: лікування, профілактика, онкологія, вакцина, рак шийки матки, ВПЛ, папіломавірус
Вірус папіломи людини (ВПЛ) дуже поширений серед жінок репродуктивного віку. 1 Залежно від патогенності ВПЛ поділяють на типи високого та низького ризику. ВПЛ високого ризику (HR-HPV) включають типи 16, 18, 31, 33, 35, 39, 45, 52, 56, 58, 59, 66 і 68. Більшість інфекцій ВПЛ протікають безсимптомно та проходять самостійно, протягом 12-24 місяців після інфікування. Однак невелика частина інфекцій зберігається або прогресує до передпухлинних уражень, що в кінцевому підсумку призводить до раку. Найбільш поширеними типами канцерогенних ВПЛ є ВПЛ 16 і 18, які пов’язані з приблизно 70% випадків раку шийки матки, пов’язаного з ВПЛ.
Переглянте записи семінарів, що пройшли в межах «Ukrainian Vaccination and Epidemiology Week».
Віріон ВПЛ має сферичну морфологію без оболонки, що характеризується 20-гранною кубічною симетрією. Він містить кільцевий дволанцюговий геном ДНК розміром приблизно 8 кб, укладений у білкову оболонку, що складається з L1 і L2. Діаметр віріона коливається від 50 до 60 нм. Геном організований у три функціональні частини: рання (E) область (E1–E8), пізня (L) область (L1, L2) і довга контрольна область (LCR). Область E кодує сім вірусних неструктурних білків: E1, E2, E1ˆE4, E5, E6, E7 і E8ˆE2. Ці білки беруть участь у реплікації, транскрипції, трансляції та трансформації ВПЛ. Ділянка L кодує два вірусних капсидних білки: L1 і L2. Ділянка LCR, яку також називають передовою регуляторною областю (URR), не кодує жодних білків. Постійна інфекція HR-HPV призводить до захворювання шийки матки, що зрештою прогресує до раку шийки матки. Зона трансформації (TZ), розташована на з’єднанні між ектоцервіксом та ендоцервіксом (плоскостовпчасте з’єднання), є джерелом ураження шийки матки. Пренеоплазія шийки матки, яку також називають інтраепітеліальною неоплазією шийки матки (CIN), далі класифікується на CIN I, CIN II та CIN III, що відповідає плоскоклітинним внутрішньоепітеліальним ураженням низького ступеня (LSIL), спонтанно регресує приблизно у 80–90% випадків. Під час цієї стадії вірус піддається активній реплікації і незначні зміни відбуваються в епітеліальних клітинах шийки матки. CIN II-III відповідає плоскоклітинним внутрішньоепітеліальним ураженням високого ступеня (HSIL). Незважаючи на відносно низьку реплікацію вірусу на цій стадії, вірус зберігається через імунне ухилення вірусу, порушення регуляції мікрооточення піхви та інших кофакторів. Експресія вірусних онкопротеїнів порушує клітинний цикл і вірусний геном може інтегруватися в геном хазяїна. Інфіковані клітини неконтрольовано розмножуються та піддаються злоякісній трансформації, що зрештою призводить до раку шийки матки.
Розробка профілактичних вакцин проти ВПЛ є важливою віхою в профілактиці та лікуванні раку шийки матки. Ці вакцини продемонстрували ефективність у зниженні захворюваності на рак шийки матки та передпухлинні ураження. Однак через такі фактори, як вартість, профілактичні вакцини не набули широкого поширення в економічно слаборозвинених регіонах. Крім того, профілактичні вакцини мають обмежену ефективність проти існуючих інфекцій ВПЛ та уражень шийки матки. Наразі не існує специфічного лікування ВПЛ-інфекції, наголошуючи на ліквідації інфекції та реверсії передракових уражень як головному фокусі лікування пов’язаних з ВПЛ уражень шийки матки. Стандартним лікуванням раку шийки матки залишається поєднання хірургічного втручання та хімієпроменевої терапії. Однак пацієнтки з прогресуючим метастатичним раком шийки матки все ще мають негативний клінічний прогноз, незважаючи на стандартне лікування. У 2014 році бевацизумаб отримав схвалення для лікування метастатичного раку шийки матки. Пізніше, у 2018 році, пембролізумаб було схвалено для лікування рецидивуючого та метастатичного раку шийки матки. Поява цих таргетних препаратів викликала широкі клінічні дослідження, зосереджені на дослідженні комбінацій таргетних препаратів, імуномодулюючих препаратів і стандартної радіохімієтерапії. Розвиток цих клінічних випробувань і дослідження нових таргетних ліків є перспективними для майбутніх пацієнтів із прогресуючим раком шийки матки.
ВПЛ ТА ЙОГО ПАТОГЕНЕЗ
Життєвий цикл ВПЛ
ВПЛ вражає базальний шар багатошарового плоского епітелію. Після проникнення в клітину-хазяїна він ініціює початкову реплікацію та індуковану диференціюванням реплікацію, кульмінацією якої є збирання та вивільнення вірусних частинок у верхніх епітеліальних клітинах. Розуміння життєвого циклу вірусу та відповідних факторів хазяїна має першочергове значення для лікування інфекції ВПЛ.
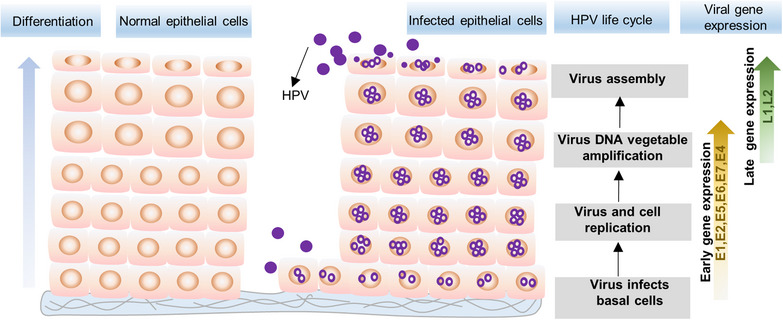
Життєвий цикл ВПЛ починається з інфікування клітин базального шару багатошарового плоского епітелію, що відбувається через порушення епітеліального бар'єра, спричинені незначними травмами. У нормальному епітелії базальні клітини являють собою єдині проліферуючі клітини, на відміну від диференційованих клітин у верхньому шарі, які вийшли з клітинного циклу. На початковій стадії інфекції вірус долає клітинні бар’єри, включаючи плазматичну мембрану та ядерну оболонку. ВПЛ проникає в цитоплазму шляхом самостійного ендоцитозу. ВПЛ потрапляє в ендосому і згодом переміщується до трансмережі Гольджі та апарату Гольджі. Вірус повинен пройти через ці компартменти, щоб досягти ядра та ініціювати інфекцію. Вірус залишається в Гольджі до переходу клітинного циклу до мітозу, коли руйнування ядерної мембрани сприяє накопичення вірусної ДНК у ядерних тільцях, де знаходиться сайт транскрипції та реплікації вірусу.
Життєвий цикл вірусу корелює з диференціацією інфікованих клітин, під час якої вірус мігрує з базального шару в шипоподібний, запускаючи пізню стадію життєвого циклу вірусу. Ця стадія включає вегетативну реплікацію генома та експресію капсидних білків L1 і L2.
Ухилення від імунітету та стійка ВПЛ-інфекція
Більшість інфекцій ВПЛ вирішуються протягом 1-2 років. Однак стійка ВПЛ-інфекція може призвести до ураження шийки матки й, зрештою, до раку шийки матки. Різні механізми імунного ухилення, індукованого ВПЛ, можуть призвести до імунної толерантності, сприяючи стійкій ВПЛ-інфекції. Пацієнти з ураженням шийки матки, пов’язаними з ВПЛ, демонструють імуносупресивне мікросередовище. Крім того, люди з ВІЛ більш схильні до розвитку ВПЛ-інфекції та ураження шийки матки, пов’язаного з ВПЛ, що є додатковим доказом імунних факторів у розвитку ураження шийки матки, пов’язаного з ВПЛ.
У нормальних жінок інфекцію ВПЛ можна усунути через вроджену та адаптовану імунну відповідь, причому лише невелика частина інфекцій ВПЛ стає стійкою. Вроджена імунна відповідь, створена дендритними клітинами (ДК), макрофагами, природними клітинами-кілерами та природними Т-клітинами-кілерами, які служать першою лінією захисту від інфекції ВПЛ. Подальший захист передбачає, що цитотоксичні Т-лімфоцити (ЦТЛ), націлені на онкопротеїн ВПЛ, імовірно, знищують клітини, інфіковані ВПЛ.
Вроджена імунна відповідь
ВПЛ може впливати на рецептори розпізнавання образів (PRR) і низхідні шляхи, таким чином порушуючи розпізнавання вірусу та пригнічуючи реакцію інтерферону (IFN). Це також може впливати на функціональність клітин вродженого імунітету та модулювати експресію цитокінів, що не сприяє виведенню вірусу.
І клітини вродженого імунітету, і кератиноцити мають здатність експресувати PRR, здатні ідентифікувати мікробні патогени та сигнали, пов’язані з пошкодженням, включаючи молекулярні структури та молекулярні структури, пов’язані з пошкодженням.
Вірусні онкопротеїни ВПЛ можуть модулювати вироблення кількох цитокінів, таким чином впливаючи як на вроджений, так і на адаптований імунітет. Крім того, ВПЛ може підвищувати експресію людського лейкоцитарного антигену (HLA)-G, сприяючи тому, щоб інфіковані клітини не були виявлені клітинами імунного нагляду та сприяли персистенції ВПЛ.
Адаптивна імунна відповідь
Антигенпрезентуючі клітини (АПК) відіграють вирішальну роль в ініціації адаптивного імунітету, презентуючи антиген CD4+ T help і CD8+ CTL через молекули основного комплексу гістосумісності (MHC) II і MHC I відповідно. Окрім впливу на диференціацію та проліферацію ДК у контексті вродженого імунітету, онкопротеїни ВПЛ також можуть впливати на адаптивний імунітет, впливаючи на презентацію антигену. Зокрема, HPV16 E6 може порушувати функцію транспортера, пов’язаного з антигенпроцесинговим комплексом.
Стійкість ВПЛ-інфекції значною мірою залежить від складу підмножин Т-клітин у мікрооточенні пухлини. Інфільтрація Т-клітин, які пригнічують ріст пухлини, може перешкоджати прогресуванню раку, тоді як протилежний результат також вірогідний. Роль гуморального імунітету в кліренсі вірусу в першу чергу залежить від продукції антитіл. У життєвому циклі ВПЛ експресія L1 і L2 обмежена верхніми епітеліальними шарами, що призводить до сповільненого імунного розпізнавання. На ранніх стадіях ВПЛ-інфекції вірус використовує розширену версію білка L1, щоб уникнути виявлення імунною системою. Ця стратегія використовує той факт, що антитіла, які розпізнають більш довгий білок L1, не мають нейтралізуючої здатності та не здатні перешкоджати поширенню вірусу. Отже, у вірусу є достатньо часу для інфікування.
Піроптоз
Піроптоз, глибоко запальний спосіб запрограмованої смерті клітин, може бути викликаний інфламмасомами і служить механізмом захисту від патогенної інфекції. Дослідники виявили, що ВПЛ E7 може пригнічувати клітинний піроптоз, сприяючи опосередкованій TRIM21 деградації та повсюдному поширенню інфламасоми IFI16, що також сприяє суттєвій стратегії ухилення від імунітету.
Злоякісна трансформація ВПЛ-інфікованих клітин
Розвиток уражень шийки матки тягне за собою молекулярні модифікації за межами стійкої інфекції HR-HPV. Зміни в цих молекулах призводять до змін у фенотипах клітин, що охоплює регуляцію клітинного циклу, проліферацію, смерть, адгезію та агресивність. Крім того, модифікації в геномі хазяїна формують основу молекулярних змін і взаємодіють з ними. З часом ці аномальні клітинні фенотипи поступово накопичуються, викликані аномальним клітинним метаболізмом і окисним стресом. Згодом клітини піддаються прогресуючій злоякісній трансформації, що зрештою призводить до виникнення раку.

Аномальна регуляція клітинного циклу та проліферація злоякісних клітин
Клітини людини піддаються мітозу, щоб забезпечити збереження хромосомної стабільності в клітинах потомства. Клітинний цикл охоплює повний процес від завершення одного поділу до завершення наступного поділу. Він поділяється на інтерфазу та фазу поділу. Інтерфаза підрозділяється на три стадії: фаза G1, фаза S і фаза G2. М-фаза або мітоз, під час якого відбувається реплікація ДНК у S-фазі. Правильна регуляція клітинного циклу залежить від різноманітних білків, включаючи цикліни та циклінзалежні кінази (CDK), інгібітори циклінзалежних кіназ (CKI), сімейство білків ретинобластоми (RB), сімейство факторів транскрипції E2F і сімейство p53. Порушення регуляції цих білків спостерігалося в клітинах, інфікованих ВПЛ, що призводило до аномального входу в клітинний цикл і нестримної проліферації. Регуляція клітини відбувається на нижньому рівні, а зміни в шляхах вище за течією можуть впливати на регуляцію клітинного циклу та клітинну проліферацію прямо чи опосередковано.
Цільові білки господаря, що беруть участь у проліферації клітин
Теломераза, яка активується при всіх видах раку, пов’язаних з ВПЛ, може подовжувати теломерну ДНК, перешкоджати чутливості та апоптозу, а також дарувати безсмертя клітинам. Фактором, що визначає швидкість теломерази, є експресія її каталітичної субодиниці, hTERT. HPV16 E6 зв’язується з ділянкою промотора hTERT, індукуючи його експресію та зрештою активуючи функцію теломерази. Нещодавно дослідники виявили, що взаємодія HPVE6 з AuyB посилює експресію hTERT і посилює активність теломерази.
Крім теломерази, онкопротеїни ВПЛ взаємодіють з іншими маломолекулярними білками, щоб контролювати проліферацію клітин. Еукаріотичні фактори ініціації трансляції полегшують синтез білка, сприяючи проліферації клітин, сприяючи перенесенню специфічних мРНК і експресії генів, пов’язаних з регуляцією клітинного циклу. Деякі з цих генів пов’язані з білками, пов’язаними з клітинним циклом. Дослідження показали, що HPVE6 посилює експресію eIF5A-1 і модулює активність білка eIF4E через шляхи MEK/ERK і AKT/PKB.
Клітинне старіння, апоптоз і аутофагія
Клітинне старіння, апоптоз і аутофагія відіграють значну роль у ураженнях шийки матки, пов’язаних з ВПЛ. Онкопротеїни ВПЛ можуть порушувати рівновагу кількості клітин, модулюючи молекули та сигнальні шляхи, пов’язані з цими процесами. Це призводить до накопичення аберрантних клітин і сприяння злоякісній трансформації.
Клітинне старіння є поширеним явищем у біологічній сфері. Старіння може спричинити незворотну зупинку клітинного циклу, що визнано автономним механізмом пригнічення пухлини. Придушення клітинного старіння може сприяти неконтрольованій проліферації клітин, що в кінцевому підсумку сприяє злоякісним змінам. Активація відповіді на пошкодження ДНК викликає клітинне старіння, опосередковане P53. Однак білок E2 може зв'язуватися з P53, послаблюючи його здатність індукувати клітинне старіння у відповідь на пошкодження ДНК. Примітно, що білок E2 HPV-18 може знижувати регуляцію антисмислової некодуючої мітохондріальної РНК-2, отже, затримуючи реплікативне старіння в HK.
Клітини тканини підтримують кількісний баланс завдяки взаємодії проліферації та апоптозу. Порушення цього балансу може сприяти розвитку захворювань, зокрема раку. Зараз апоптоз в еукаріотичних клітинах переважно опосередковується зовнішнім шляхом, опосередкованим рецептором смерті, внутрішнім шляхом мітохондрій, шляхом, опосередкованим В-гранідазою, і шляхом стресу біля ендоплазматичного ретикулуму. До складу механізму апоптозу в основному входять чотири сімейства білків: протеази апоптозу (каспази), білки-адаптори, білки сімейства Bcl-2 і білки-інгібітори апоптозу. HPV E6 націлений на фактор, що індукує апоптоз (AIF), для деградації, тим самим перешкоджаючи AIF-опосередкованому апоптозу. Крім того, HPV16 E6 порушує апоптоз шляхом дерегуляції білка, пов’язаного з доменом смерті, і пригнічення активності каспази-8. HPVE6 знижує ядерний транспорт, порушуючи IFN-γ-залежний апоптоз. HPVE1/E6 активізує UHRF7, який пригнічує експресію генів-супресорів пухлин (TSG), дозволяючи клітинам уникати апоптозу та сприяючи прогресуванню раку.
Аутофагія передбачає фагоцитоз і деградацію пошкоджених або надлишкових клітинних компонентів, таких як старіючі білки та органели, що зрештою сприяє виживанню клітин. Однак надмірна аутофагія може виснажити внутрішньоклітинні білки та енергію до такої міри, коли життєздатність клітин порушується, що призводить до апоптозу. Аутофагія демонструє подвійну роль у розвитку раку. На ранніх стадіях клітинної трансформації аутофагія пригнічує утворення ракових клітин. Однак, як тільки ракові клітини створюються, аутофагія може підвищити виживання ракових клітин і придушити апоптоз. Експресія онкобілків ВПЛ може активувати аутофагію різними шляхами, що сприяє виживанню інфікованих ВПЛ клітин. Однак надмірно посилена аутофагія може індукувати апоптоз. З цієї точки зору аутофагія — це палиця з двома кінцями. Для майбутніх досліджень регулювання аутофагії представляє новий шлях для лікування пов’язаних з ВПЛ уражень шийки матки.
Клітинне метастазування та інвазія
Злоякісна трансформація гістіоцитів характеризується зниженням адгезії, посиленим метастазуванням і підвищеною агресивністю. Агресивність і метастазування клітин залежать від матричних металопротеїназ (ММР), зокрема ММР-2 і ММР-9, які руйнують компоненти позаклітинного матриксу (ПКM), руйнуючи гістологічну барикаду для метастазування пухлинних клітин. Крім того, метастазування є основною ознакою пухлинних клітин, численні дослідження підкреслюють ключову роль епітеліально-мезенхімальної трансформації переходу (EMT) у метастазуванні пухлини. Онкопротеїни ВПЛ можуть руйнувати ПКМ і викликати ЕМТ, таким чином сприяючи метастазуванню та інвазії ВПЛ-позитивних клітин раку шийки матки.
У процесі інвазії та метастазування пухлинні клітини повинні зруйнувати бар’єр ПКМ та КМ, що складається з міжклітинного матриксу та КМ. Ураження та злоякісні новоутворення, асоційовані з ВПЛ, демонструють зміни у складі та функції ПКМ. HPVE6 сприяє експресії ADAM10, який регулює адгезію клітин і руйнує міжклітинні речовини, тим самим полегшуючи інвазію та метастазування ракових клітин.
EMT позначає процес, за допомогою якого епітеліальні клітини фенотипово змінюються, щоб набути фенотипу інтерстиціальних клітин за певних фізіологічних або патологічних умов. Основні морфологічні ознаки ЕМТ включають втрату структур міжклітинного з’єднання в епітеліальних клітинах, ремоделювання цитоскелету, що призводить до переходу від полігональної до веретеноподібної морфології фібробластів, підвищену рухливість клітин і стійкість до апоптозу. Основні молекулярні характеристики ЕМТ охоплюють змінену експресію та виснаження епітеліальних маркерів, таких як E-кадгерин і оклюдин, поряд із надмірною експресією маркерів мезенхімальних клітин, таких як N-кадгерин і віментин. Онкобілки ВПЛ, зокрема Е6 і Е7, здатні сприяти ЕМТ.
Інтеграція генома ВПЛ
Гени ВПЛ можуть викликати нестабільність геному за допомогою багатьох механізмів, включаючи модуляцію клітинного циклу, взаємодію зі шляхами відновлення пошкоджень ДНК, які перенаправляють високоточні механізми відновлення на вірусні епісоми, а не на геном господаря, індукцію ДНК‐шкідливого окислювального стресу і зміну довжини теломер. Інтеграція ВПЛ в геном хазяїна є результатом підвищеної нестабільності геному в клітинах, інфікованих ВПЛ. Частота інтеграції ВПЛ прогресивно зростає під час прогресування уражень шийки матки, що робить його вірогідним біомаркером для спостереження за раком шийки матки та передраковими захворюваннями.

Окрім вищезгаданих клітинних і молекулярних змін, які викликають злоякісну трансформацію клітин шийки матки після інфікування ВПЛ, інші елементи, включаючи перепрограмування клітинного метаболізму, окислювальний стрес і ангіогенез у мікрооточенні пухлини, значно сприяють цьому процесу.
Порушення регуляції клітинного метаболізму
Під час росту пухлини клітини, інфіковані ВПЛ, зазнають метаболічних змін, які сприяють їх злоякісному розвитку. Дослідники продемонстрували, що HPV E6/E7 може підвищувати гліколіз. У гострих кондиломах, спричинених ВПЛ, інфекція ВПЛ викликає накопичення глікогену та посилення метаболізму глікогену через фактор 1а, що індукує гіпоксію, важливий для виживання та проліферації кератиноцитів.
Ці процеси дають додаткові джерела енергії для проліферації пухлини та метастазування. Крім того, під час канцерогенезу або персистенції раку інші метаболічні шляхи, такі як метаболізм глутаміну, зазнають модифікації. Дослідники виявили, що E6/E7 посилює проліферацію клітин залежно від глутаміну, забезпечуючи енергією процеси, пов’язані з раком.
Окислювальний стрес
Окислювальний стрес сприяє виникненню карциноми, оскільки надлишок активних форм кисню може спричинити окисне пошкодження клітинних структур і біомолекул, включаючи білки, ліпіди та розрив ДНК, сприяючи інтеграції ДНК вірусу ВПЛ у геном хазяїна. Клітини, інфіковані HR-HPVs, можуть адаптуватись до окислювального стресу шляхом підвищення синтезу ендогенних антиоксидантів, включаючи каталазу, глутатіон і пероксиредоксин, які підтримують роботу вірусних онкобілків.
Ангіогенез
Ангіогенез глибоко впливає на перехід від дисплазії до агресивного раку шийки матки. Однак зв'язок між ВПЛ-інфекцією та ангіогенезом залишається невизначеним. Експерименти in vitro показали, що Е6 активує міграцію ендотеліальних клітин, спричинену фактором росту ендотелію судин (VEGF), і виявляє потужну проангіогенну активність.
Сприяючі фактори ураження шийки матки
Не всі інфекції ВПЛ призводять до раку шийки матки, і на прогресування ураження шийки матки впливають різні сприяючі фактори, включаючи вагінальне мікрооточення та інші фактори.
Шийка матки знаходиться у вагінальному мікрооточенні, і зміни у вагінальному мікрооточенні неминуче впливають на ураження шийки матки, пов’язані з ВПЛ. Вагінальне мікрооточення охоплює вагінальний мікробіом (VMB), ендокринну систему хазяїна, анатомію піхви та місцевий імунітет слизової оболонки. Цервіко-вагінальна рідина є важливим компонентом мікроекології піхви, що містить муцини, антитіла та різні метаболіти, такі як молочна кислота та сіалідаза (sld). VMB, діючи як центральний елемент вагінального мікрооточення, можна класифікувати на п’ять різних типів станів спільноти (CST): CST I–III та CST V, які переважно включають Lactobacillus crispatus, Lactobacillus gasseri, Lactobacillus iners та Lactobacillus jensenii, відповідно. CST IV окреслює гетерогенну групу, що характеризується зниженою чисельністю видів Lactobacillus. Нормативні вагінальні мікробні спільноти у жінок зазвичай мають низьку біорізноманітність і в них домінують Lactobacillus . Підвищена вагінальна мікробна різноманітність часто тісно корелює з розладами жіночої репродуктивної системи.
Нещодавно було широко задокументовано тісний зв’язок між складом мікробіоти піхви та інфекцією ВПЛ. Встановлено, що VMB корелює з тяжкістю уражень шийки матки. У міру прогресування ураження шийки матки різноманітність VMB зростає, супроводжується збільшенням кількості Lactobacillus iners і бактерій, пов’язаних з дисбактеріозом, таких як Porphyromonas, Prevotella, Bacteroides і переважаючими видами Anaerococcus . ВПЛ-інфекція також може негативно впливати на VMB, і ці два фактори синергічно сприяють прогресуванню ураження шийки матки.
Інші ендогенні та екзогенні фактори сприяють прогресуванню ВПЛ-асоційованих уражень шийки матки та раку шийки матки. Генетичні фактори визначають сприйнятливість хазяїна до ВПЛ, а імуногенетичні варіанти відіграють важливу роль у інфікуванні та персистенції HR-HPV. Куріння є поширеним фактором ризику раку шийки матки, компоненти сигаретного диму можуть посилювати експресію HPV16 E6/E7 через сигнальний шлях EGFR/PI3K/Akt/c-Jun. Нікотин може сприяти проліферації епітелію шийки матки, імморталізованої ВПЛ, шляхом активації шляху AKT/mTOR. Конденсат сигаретного диму може збільшити активність YAP1 в епітеліальних клітинах шийки матки людини. Повідомлялося, що вживання гормонів пов’язане з фізіопатологією; рівні експресії ERα, ERβ, PRLR підвищуються під час прогресування раку. Також виявлено, що естроген може індукувати нестабільність геному в інфікованій HR-HPV шийці матки. Також встановлено, що контрацептиви, такі як депо-медроксипрогестерон (DMPA), посилюють інфікування ВПЛ, хоча, здається, не прискорюють прогресування захворювання. Поліциклічні ароматичні вуглеводні також розглядаються як кофактор канцерогенезу, опосередкованого ВПЛ, тоді як цей механізм заслуговує на подальше вивчення. Цікаво, що дослідники також виявили, що хронічний стрес і денний кортизол також відіграють важливу роль в інфікуванні HR-HPV і асоційованому з HPV канцерогенезі шийки матки.
ТЕРАПЕВТИЧНІ ЗАХОДИ
В даний час лікування передракових утворень, викликаних канцерогенним ВПЛ, включає в себе перш за все хірургічні втручання, включаючи лазерне лікування, процедуру петлевого електрохірургічного висічення та конізацію холодним ножем. Вибір лікування залежить від тяжкості ураження, типу ВПЛ та стану пацієнта. Однак у деяких пацієнтів післяопераційна інфекція ВПЛ продовжує зберігатися, що підвищує ризик подальшого рецидиву. На жаль, досі відсутні ефективні препарати для лікування персистуючої ВПЛ-інфекції. Основне лікування раку шийки матки передбачає хірургічне втручання в поєднанні з променевою та хімієтерапіяю. Однак жінки, з метастазами у лімфатичні вузли, рецидивуючим раком або метастатичним раком шийки матки, все ще мають песимістичний прогноз, що посилює попит на інноваційні стратегії лікування. У наступному розділі наведено підсумок сучасних методів лікування та нових підходів до лікування ВПЛ-інфекції, передракових уражень, пов’язаних з ВПЛ, і раку шийки матки.
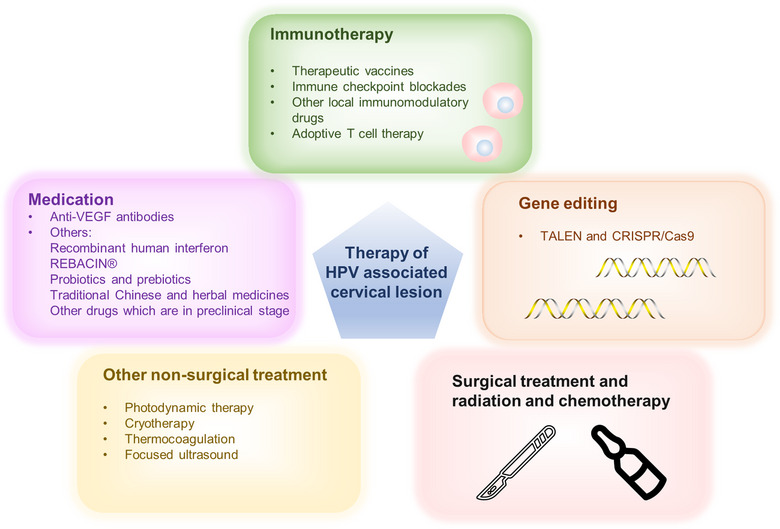
Імунотерапія
Широке впровадження вакцини проти ВПЛ призвело до зниження поширеності ВПЛ-асоційованих уражень шийки матки. Проте, здається, вакцина має обмежену ефективність у лікуванні встановлених інфекцій ВПЛ та уражень шийки матки. Для боротьби з персистуючими інфекціями ВПЛ та вже існуючими ураженнями шийки матки, пов’язаними з ВПЛ, дослідники розробляють терапевтичні вакцини. Крім того, поточні клінічні випробування вивчають імунотерапевтичні препарати, такі як антитіла до PD-1/LI, і нові підходи, такі як адаптивна клітинна терапія, яка спрямована на очищення ВПЛ-інфекції та пригнічення ураження шийки матки шляхом посилення вроджених і адаптивних імунних реакцій. Ці підходи в поєднанні зі стандартними методами лікування можуть запропонувати нові варіанти лікування.
Терапевтичні вакцини
На відміну від профілактичних вакцин, терапевтичні вакцини спрямовані на стимуляцію вироблення CD8+ цитотоксичних і CD4+ хелперних Т-клітин. Ці вакцини здебільшого націлені на білки E6/E7, хоча деякі вакцини, які використовуються в дослідженнях раку, намагаються націлитися на інші білки, такі як p16 і теломераза (NCT 01462838 і NCT 03946358). Нижче наведено різні типи терапевтичних вакцин.
Загалом терапевтичні вакцини бувають таких різновидів:
- вакцини на основі вірусних векторів (аденовірус, аденоасоційований вірус, альфавірус, лентивіруси, вірус везикулярного стоматиту та віруси осповакцини);
- вакцини на основі бактеріальних векторів (Listeria та Lactobacillus є найбільш широко вивченими векторами);
- вакцини на основі пептидів;
- вакцини на основі нуклеїнових кислот (на основі ДНК);
- вакцини на основі РНК;
- цільноклітинні вакцини
Регуляція імунного середовища
Як обговорювалося раніше, ВПЛ-інфекція перешкоджає вродженому та адаптованому імунітету за допомогою різних механізмів, що призводить до імуносупресивного середовища, яке погіршує активність імунних клітин. ВПЛ-інфіковані клітини можуть уникнути імунного нагляду та сприяти прогресуванню уражень шийки матки та раку шийки матки. Таким чином, відновлення імуносупресивного статусу стало важливою терапевтичною метою.
Блокади імунних контрольних точок
Запрограмована вісь смерті-ліганду 1 (PD-L1)/PD-1 має вирішальне значення для підтримки аутоімунної толерантності. PD-L1 функціонує як ліганд для PD-1, і їх взаємодія призводить до дезактивації Т-клітин. Часто пухлинні клітини демонструють підвищений рівень експресії PD-L1. Як пояснювалося раніше, онкопротеїни HPV E6/E7 можуть посилювати експресію PD-1. Блокування PD-1 виявилося перспективним при раку шийки матки, індукованому ВПЛ. У 2018 році FDA схвалило пембролізумаб, антитіло проти PD-1, для лікування раку шийки матки. Клінічне випробування NCT04712851 зараз оцінює використання пембролізумабу при CIN. Інші анти-PD-1 антитіла, включаючи Durvalumab і Nivolumab, залишаються на етапі клінічних досліджень.
На додаток до вищезазначених таргетних препаратів, інші ліки можуть моделювати імунну відповідь, сприяючи елімінації ВПЛ-інфекції та ураження шийки матки. Nr-CWS є ефективним і безпечним препаратом для лікування HSIL у китайських жінок, і нещодавні дослідження показали, що він може через стимуляцію FPR3 посилити диференціювання, опосередковане DC, активувати імунну відповідь тканини шийки матки.

Адаптивна Т-клітинна терапія
ATT передбачає розширення ex vivo та маніпуляції з аутологічними імунними клітинами для посилення їхньої протипухлинної активності з подальшим їх повторним введенням пацієнту, щоб Т-клітини націлювалися на пухлинні антигени для сприяння регресії пухлини. ATT має три основні категорії: лімфоцити, що інфільтрують пухлину (TILs), T-клітини рецепторів T-клітин (TCR-T), і T-клітини рецепторів химерного антигену (CAR-Т). CAR-T були схвалені FDA для терапії гострого лімфолейкозу. Що стосується раку шийки матки, NCT02280811 і NCT01585428 є вже завершеними дослідженнями щодо TCR-T і TIL при раку шийки матки, пов’язаному з ВПЛ, які показали значну валідність. Технологія індукованих плюрипотентних стовбурових клітин (iPSC) посилює цитотоксичність вірусоспецифічних CTL, які можуть довго виживати in vivo, як молоді Т-клітини пам’яті, забезпечувати стійке пригнічення пухлини та являти собою перспективну імунотерапію раку шийки матки.
Ліки
HPVE6/E7 є основним патогенним фактором, і триває дослідження специфічних антитіл, націлених на E6/E7. Однак внутрішньоклітинне розташування E6/E7 створює проблему для звичайних терапевтичних антитіл, перешкоджаючи їх проникненню в клітини. Недавні дослідження, спрямовані на нанотіла, націлені на E6/E7, показали перспективність обходу цього обмеження. З усім тим, необхідні подальші дослідження, оскільки ці дослідження залишаються на доклінічній стадії. Отже, на цей момент не існує специфічних ліків проти ВПЛ-інфекції. Постійне поглиблене дослідження патогенезу ВПЛ призвело до визначення різних патогенних шляхів як потенційних терапевтичних мішеней для пов’язаних з ВПЛ уражень шийки матки. Вони охоплюють інгібування клітинного циклу, пригнічення клітинної проліферації, сприяння апоптозу,
У контексті таргетної терапії раку шийки матки, на додаток до цільових інгібіторів імунних контрольних точок, які використовуються в імунотерапії, антитіла до VEGF широко використовуються в лікуванні раку шийки матки. На цей час стандартна терапія першої лінії рецидивуючого або метастатичного раку шийки матки включає комбінацію хімієтерапії та бевацизумабу.
Додаткові препарати використовувалися для лікування ВПЛ-інфекції та передракових утворень шийки матки. Рекомбінантний людський IFN α-2b, противірусний препарат, отримав схвалення для терапії інфекції ВПЛ. Його місцеве застосування сприяє виведенню інфекції ВПЛ шляхом підвищення імунітету слизової оболонки.
Клінічне випробування (NCT03372395) виявило, що тривале вагінальне використання Lactobacillus rhamnosus BMX 54 може відновити вагінальну екосистему та сприяти виведенню ВПЛ. Крім того, нещодавнє доклінічне дослідження продемонструвало, що супернатанти лізатів і інактивованих теплом Lacticaseibacillus casei LH23 можуть пригнічувати експресію HPV E6/E7, таким чином ілюструючи потенційні протипухлинні ефекти пробіотиків. Традиційні китайські та рослинні ліки, такі як пейтлінг, мирт і куркумін також досліджувалися в клінічних випробуваннях для лікування ВПЛ-інфекції. Крім того, у доклінічних експериментах інші китайські традиційні та рослинні ліки, а також деякі природні фітохімічні речовини, такі як реальгар, секурідака-сапоніни, ficus carica, juglone також можуть виконувати ту ж роль. Певні препарати, що використовуються для лікування інших захворювань, наприклад протизапальні препарати, метформін, артесунат, і протигрибковий засіб циклопірокс також можуть мати широке застосування в клінічному лікуванні ВПЛ-інфекції.

Редагування генів
Як зазначалося раніше, надекспресія онкогенів E6 і E7 тісно корелює з прогресуванням уражень шийки матки. Отже, безпосередній нокаут цих цільових генів може ефективно пригнічувати прогресування ураження. Останні досягнення в технології редагування генів реалізували цю перспективу. Нуклеази цинкового пальця (ZFN), ендонуклеази типу активатора транскрипції (TALEN) і ендонуклеази Cas9, асоційовані з CRISPR, є трьома основними поколіннями інструментів редагування геному. Серед них CRISPR/Cas9 є більш специфічним, ефективним і пов’язаним з меншою кількістю нецільових ефектів порівняно з іншими. Дослідження показали, що вибивання онкогенів E6 і E7 за допомогою системи CRISPR/Cas може безпосередньо гіперактивувати p53 і знищувати клітини раку шийки матки, спричинені ВПЛ.
Інше нехірургічне лікування
Радикальна хірургія є кращим варіантом лікування для більшості пацієнтів з ранньою стадією раку шийки матки, і вона не буде далі обговорюватися тут. У випадках передракових станів пацієнтам із CINII-III рекомендується ексцизійна техніка, включаючи висічення вогнища ураження великою петлею або конізацію холодним ножем. Однак багато жінок можуть вагатися проходити ці процедури через занепокоєння щодо потенційних передчасних пологів внаслідок неспроможності шийки матки та ризику спайок шийки матки, що призведе до вторинної аменореї.
Фотодинамічна терапія (ФДТ) — це сучасний і неінвазивний метод лікування, який використовується для лікування як онкологічних, так і неонкологічних захворювань. Він ґрунтується на місцевому або системному введенні фоточутливої сполуки, яка називається фотосенсибілізатором (ФС). Фотоцитотоксичні реакції, індуковані ФДТ, відбуваються виключно в патологічних тканинах поблизу розподілу ФС, що забезпечує вибіркове руйнування. У випадку ураження шийки матки, пов’язаного з ВПЛ, ФДТ знаходить широке застосування в лікуванні передракових уражень і раку шийки матки на ранніх стадіях. Дослідники також виявили, що ФДТ може сприяти регресу інфекції ВПЛ у пацієнтів після конізації або у постменопаузі. Оскільки ефективність лікування ФДТ залежить від ФС, поточні дослідження та розробка ефективного ФС можуть покращити терапевтичні результати ФДТ, що є важливою сферою дослідження для майбутніх досліджень. Окрім ФДТ, інші методи лікування, такі як кріотерапія, термокоагуляція та сфокусований ультразвук зазвичай застосовуються для лікування передракових уражень шийки матки. Вибір конкретного методу лікування має залежати від ступеня та масштабу ураження шийки матки.
ВИСНОВОК
ВПЛ-інфекція накладає на пацієнтів значні економічні та психологічні навантаження. Патогенність ВПЛ тісно пов’язана з вірусними онкобілками. Мікроскопічне пошкодження епітелію слизової оболонки шийки матки сприяє зараженню ВПЛ та інвазії базальних клітин. Після інвазії вірус синтезує онкобілки, використовує компоненти хазяїна для реплікації та вивільняє інфекційні вірусні частинки під час диференціювання базальних клітин, завершуючи таким чином свій життєвий цикл. Віруси можуть уникати імунної відповіді, впливаючи як на вроджений, так і на адаптований імунітет. Численні дослідження, спрямовані на пошук оптимальної терапії ВПЛ-асоційованого раку шийки матки вже досягли значних успіхів, а нові технології обіцяють прорив у цій сфері.
ДЖЕРЕЛО: https://www.ncbi.nlm.nih.gov
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу
Всесвітній день боротьби з остеопорозом

Галина Коваль: Імунологія генітального енд ...

Проблеми вагітності жінок із хронічними за ...
Интересный случай из врачебной практики: П ...

Менструальне здоров’я, а не лише гігієна: ...
Доброякісні та передракові захворювання ши ...