Веноартеріальна екстракорпоральна мембранна оксигенація при стрептококовому синдромі токсичного шоку групи B: опис випадку та огляд літератури
Дата публікації: 03.10.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: інтенсивна терапія, сепсис, екмо, шок, стрептококи, ЕКМО

Синдром стрептококового токсичного шоку (СТШ) є відносно рідкісним захворюванням із поганим прогнозом. Це швидко призводить до шоку та поліорганної недостатності серед пацієнтів, за повідомленнями, рівень смертності становить приблизно 40%, і більшість пацієнтів помирають протягом кількох днів після початку. СТШ зазвичай викликається стрептококом групи A (СГА; S. pyogenes), але також може бути викликаний іншими групами бета-гемолітичних стрептококів. Останнім часом стрептокок групи B (СГВ; S. agalacticae) у невагітних дорослих і стрептокок групи G все частіше повідомляють як збудники, причому рівень смертності такий же високий, як і внаслідок СТШ, спричиненого СГА. Механізм СТШ не повністю зрозумілий; однак це було пов’язано з поєднанням ефектів стрептококових суперантигенних токсинів, інших стрептококових ферментів і токсинів, а також реакції організму на стрептококову інфекцію. Рання діагностика та мультидисциплінарне лікування, включаючи інтенсивну терапію при поліорганній недостатності, контроль джерела інфекції, хірургічне лікування та призначення антибіотиків, включаючи кліндаміцин для пригнічення вироблення токсинів, є критичними для пацієнтів із СТШ.
Стан здоров’я деяких пацієнтів із СТШ, у тому числі здорових осіб без супутніх захворювань, може швидко погіршуватися після початку СТШ, що призводить до рефрактерного шоку та, нарешті, зупинки серцево-легеневої діяльності (СЛД). В останні роки було опубліковано кілька звітів про випадки дорослих пацієнтів із СТШ, які проходили веноартеріальну екстракорпоральну мембранну оксигенацію (VA-ECMO). Однак ефективність VA-ECMO у лікуванні септичного шоку у дорослих є суперечливою. У пацієнтів віком 60 років і старше дистрибутивний шок із нормальною серцевою функцією і СЛД перед початком ЕКМО вважалися поганими прогностичними факторами терапії ЕКМО для септичного шоку. Проте, чи відіграє VA-ECMO роль у покращенні прогнозу пацієнтів із СТШ, залишається невідомим.
Звіт про клінічний випадок
Жінка 60 років (зріст 164 см, вага 51,6 кг) госпіталізована з приводу діареї та порушення електролітного балансу внаслідок хіміопроменевої терапії раку прямої кишки. У неї була гіпертонія в анамнезі. Після госпіталізації її загальний стан поступово покращився; її гемодинамічний і респіраторний статуси були стабільними, а ознаки інфекції, такі як лихоманка, були відсутні.
Однак на 7-й день госпіталізації вона відчула легку дезорієнтацію з наступною сонливістю. У неї була тахікардія, ЧСС 120 ударів на хвилину, але артеріальний тиск був стабільним — 119/73 мм рт.ст., температура тіла 36,9°C. Через зниження оксигенації було розпочато подачу кисню через ніс зі швидкістю 2 л/хв, і вона перебувала під наглядом. Рано вранці на 8-й день госпіталізації вона раптово впала в коматозний стан і піднялася температура (температура тіла 39,8°C). У неї був рефрактерний шок, який швидко прогресував до зупинки серцевої діяльності з відсутністю електричної активності. Негайно була проведена звичайна серцево-легенева реанімація (СЛР). Електрокардіограма, отримана під час СЛР, показала асистолію або відсутність електричної активності. СЛР, включаючи 7 інфузій 1 мг внутрішньовенного адреналіну, не вдалося досягти відновлення спонтанного кровообігу (ВСК), тому хворій було розпочато VA-ECMO через 38 хвилин після початку СЛР. Венозна дренажна канюля та артеріальна зворотна канюля для ЕКМО були вставлені в праві стегнові судини. ЕКМО підтримували зі швидкістю кровотоку 3,0 л/хв за допомогою відцентрового насоса і мембранного оксигенатора. ВСК було досягнуто ненадовго після початку VA-ECMO. Біохімічні аналізи крові показали гіперкаліємію (рівень калію 7,1 ммоль/л), що ймовірно є однією з причин зупинки серця. На рентгенограмі органів грудної клітки виявлені двосторонні дифузні інфільтративні тіні, що дають підстави підозрювати гострий респіраторний дистрес-синдром (ГРДС), вільне повітря в черевній порожнині.
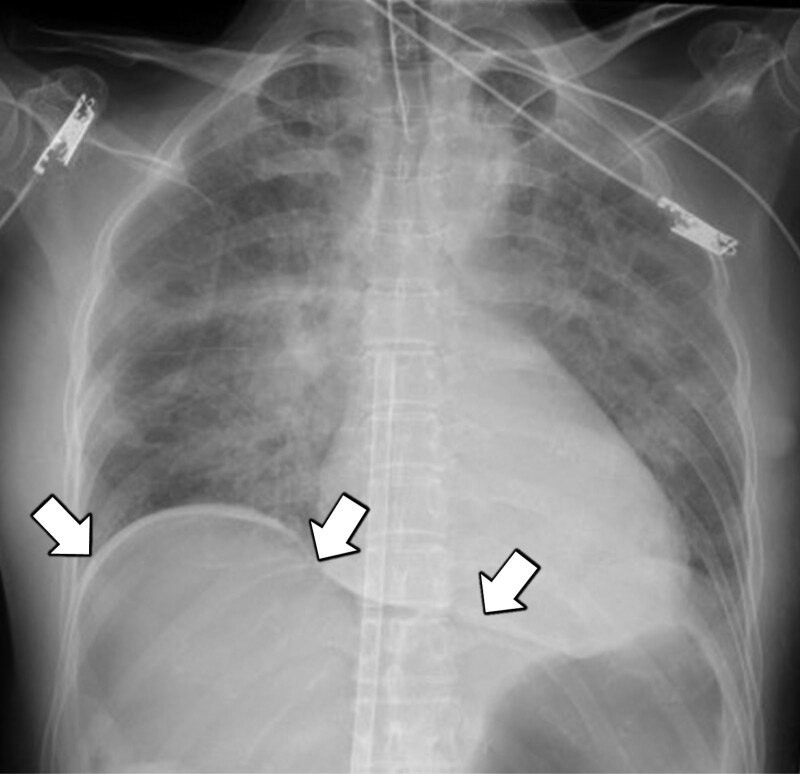
Після проведення комп’ютерної томографії з контрастним підсиленням пацієнтку перевели у відділення інтенсивної терапії; спостерігалася периферична гіпоперфузія, рівень лактату становив 15,0 ммоль/л. Їй потрібен був норадреналін (0,8 мкг/кг/хв) і вазопресин (1,8 од/год) для підтримки перфузійного тиску за підтримки VA-ECMO з кровотоком 3,0 л/хв. Трансторакальна ехокардіографія виявила нормальну серцеву функцію з фракцією викиду 50% і відсутність інших серцевих аномалій, але у пацієнтки була сильна периферична гіпоперфузія, і їй вводили олприноном, інгібітором фосфодіестерази 3, який розпочали з низької дози 0,05 мкг/кг/хв. Крім того, у неї була поліорганна недостатність; результати біохімічного дослідження крові: лейкоцити 2000/мкл; рівень гемоглобіну 5,1 г/дл; кількість тромбоцитів 11000/мкл; протромбіновий час — міжнародне нормалізоване співвідношення 4,77; рівень D-димера 94,2 мкг/мл; рівень аспартатамінотрансферази 804 МО/л; рівень аланінамінотрансферази 255 МО/л; і рівень креатиніну 2,15 мг/дл.
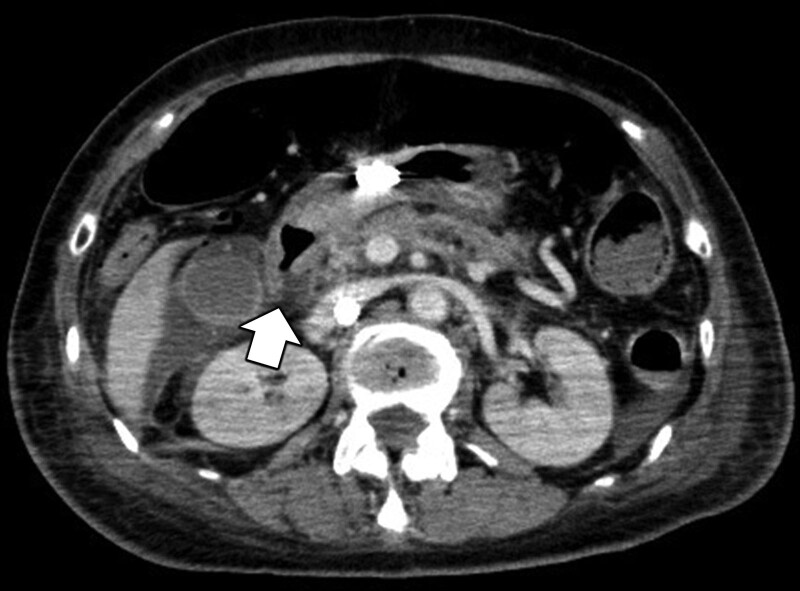
Крім того, комп’ютерна томографія з контрастуванням виявила перфорацію дванадцятипалої кишки, тому був діагностований септичний шок внаслідок перитоніту. Проведено екстрене оперативне втручання під супроводом VA-ECMO з внутрішньоочеревинним лаважем і дренажем у поєднанні з закриттям перфорації ДПК. Негайно було розпочато емпіричне лікування антибіотиками меропенемом, ванкоміцином і мікафунгіном. Для адсорбції цитокінів і ендотоксину було розпочато терапію очищення крові за допомогою мембранного гемофільтра AN69ST та прямої гемоперфузії на колонці з іммобілізованими волокнами поліміксину B. Додатково проведена терапія гідрокортизоном (200 мг/добу). На 2-й день у відділенні інтенсивної терапії також вводили кліндаміцин для пригнічення вироблення токсину, оскільки бета-гемолітичні стрептококи були виявлені в культуральному аналізі крові, проведеному під час госпіталізації у відділенні інтенсивної терапії, і посіві на асцитну рідину, проведеному під час операції. Нарешті було діагностовано СТШ, викликаний СГВ з перфорацією дванадцятипалої кишки та перитонітом відповідно до критеріїв CDC. Після цього спостерігалося швидке поліпшення гемодинаміки; рівень лактату нормалізувався на 4-й день у відділенні інтенсивної терапії, і пацієнта було відключено від VA-ECMO на 5-й день госпіталізації у відділення інтенсивної терапії. У зв'язку з тривалим порушенням свідомості на 8 добу після госпіталізації у ВІТ виконана трахеотомія, а на 12 добу у ВІТ відключена від апарату ШВЛ. Хоча у неї розвинулась кандидемія, цитомегаловірусна інфекція та сильна слабкість, набута у відділенні інтенсивної терапії, вона одужала від поліорганної недостатності та була переведена в загальну палату на 22 день після надходження у відділення інтенсивної терапії. Через 88 днів після виписки з відділення інтенсивної терапії пацієнтка була переведена на реабілітацію, згодом виконана радикальна резекція раку прямої кишки. Через 1 рік спостереження зберігалися порушення короткочасної пам'яті та порушення ходи, які могли бути спричинені постреанімаційною енцефалопатією. Однак її виписали з лікарні під амбулаторне спостереження.
Обговорення
Тут ми повідомляємо про випадок успішного лікування СТШ, викликаного СГВ, у якому VA-ECMO було введено для CPA. У пацієнтки була тяжка поліорганна недостатність, включаючи рефрактерний шок після ВСК; однак вона швидко одужала і вижила завдяки 4 дням підтримки ECMO. Пацієнтка не реагувала на звичайну СЛР, і її неможливо було врятувати без ECMO.
Незважаючи на високу смертність хворих на СТШ, специфічного лікування захворювання не створено. Швидке прогресування недостатності кровообігу внаслідок СТШ призводить до рефрактерного шоку і, нарешті, припинення серцевої діяльності. Нещодавно деякі звіти про випадки продемонстрували ефективність VA-ECMO у порятунку життя таких пацієнтів, однак його ефективність залишається невідомою.
Тому було проведено огляд звітів про випадки VA-ECMO для дорослих пацієнтів із СТШ, дослідження його характеристик та результатів.
Було виявлено 7 звітів про випадки, що описують 8 пацієнтів, і 1 ретроспективне обсерваційне дослідження, що описує 10 пацієнтів. Крім того, 1 повідомлення про випадок було здійснено вручну. Таким чином, були досліджені дані 20 пацієнтів, включаючи нашого пацієнта. У більшості випадків спостерігалася тяжка гіперлактатемія, перед введенням ЕКМО у 9 пацієнтів (45%) була потрібна СЛР. Тривалість ЕКМО становила 4,6 (4,0–7,2) дня. Загальна виживаність у стаціонарі склала 90%. В аналізі, який включав лише випадки з обсерваційного дослідження з невеликим занепокоєнням щодо упередженості публікації, виживаність також становила 90%. Рівень виживаності пацієнтів, які мали СЛР до введення ЕКМО, становив 89%, тоді як рівень виживаності пацієнтів без СЛР становив 80%. Виживаність пацієнтів старше 60 років склала 88%, що свідчить про високу ймовірність виживання. При аналізі випадків пацієнтів, що вижили, про серйозні наслідки в основних органах, таких як серце, легені та нирки, не повідомлялося, за винятком функціональних порушень внаслідок ампутації кінцівок.
Доцільність проведення VA-ECMO для рефрактерного септичного шоку у дорослих є суперечливою; нещодавній систематичний огляд і метааналіз показали, що виживаність у лікарні становить 36,4%.] Патофізіологія септичного шоку зазвичай включає дистрибутивний шок без серйозних відхилень у функції серця. VA-ECMO не є ефективним для лікування цього захворювання, показник виживаності в лікарні становить 32,1%. Навпаки, у випадках септичного шоку з тяжким порушенням ФЛШ (фракція викиду < 20%), у яких очікується найвища ефективність, виживаність становила 62,0%.
Рівень смертності від септичного шоку становить приблизно 40%, а криві Каплана-Мейєра показують, що цей рівень досягається відносно повільно протягом 30 днів. Рівень смертності пацієнтів із СТШ також становить 40%, і більшість смертей відбувається протягом кількох днів після початку захворювання, а деякі пацієнти помирають після п’ятого дня. Іншими словами, прогноз СТШ може бути покращений, якщо вдасться уникнути смерті протягом 5 днів від початку. Використання VA-ECMO для шоку, який не реагує на традиційне лікування, або для СРЛ може бути ефективною стратегією порятунку життя. Насправді згідно з оглядом літератури, 90% пацієнтів можна було врятувати за допомогою VA-ECMO протягом перших 4-5 днів після початку. Дивно, але подібні показники виживання також були досягнуті у пацієнтів, які потребували СЛР. Нещодавній звіт показав, що навіть пацієнти з рефрактерним септичним шоком із дистрибутивним шоком можуть мати покращений прогноз, якщо забезпечити VA-ECMO (рівень виживаності в лікарні 70,6%). Покращена оксигенація тканин за допомогою VA-ECMO стабілізує гемодинаміку, особливо при дистрибутивному шоку з високим рівнем лактату, що свідчить про посилення анаеробного метаболізму. У порівнянні зі звичайним септичним шоком, СТШ може мати характеристики, які роблять ECMO більш ефективним.
Найважливіша роль VA-ECMO в СТШ може полягати в підтримці кровотоку в органах і доставки кисню на ранніх стадіях у пацієнтів з рефрактерним шоком або CPA і поліорганною недостатністю, включаючи ГРДС, і надання додаткового часу для лікування стрептококової інфекції.
В останні роки зросла частота СТШ, а також частота інвазивних інфекцій СГА та іншими групами бета-гемолітичних стрептококів. Порятунок життя пацієнтів із смертельним СТШ залишається головною проблемою для постачальників медичних послуг. VA-ECMO для пацієнтів із летальним СТШ може сприяти покращенню прогнозу шляхом покращення оксигенації тканин і надання додаткового часу для лікування інвазивної стрептококової інфекції.
ДЖЕРЕЛО: https://www.ncbi.nlm.nih.gov/
Також рекомендуємо ознайомитися:
- Запис семінару «Хвороба Лайма».
- Запис семінару «Помилки і нові методи лікування COVID-19».
- Запис семінару «Ентеровірусні інфекції: сучасний стан проблеми».
- Курс «Сепсис та септичний шок у дорослих та дітей».
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Нові клінічні рекомендації щодо порушення ...

Скринінг діабетичної периферичної нейропат ...

Новий підхід спрямований на розвиток соціа ...

Середземноморська дієта і хвороба Паркінсо ...

Новий інструмент прогнозування результатів ...
Ключові фосфоліпіди вказують на потенційне ...


