Рекомендації з менеджменту анафілаксії (JTFPP, 2023) Ч.2
Дата публікації: 15.03.2024
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: адреналін, критерії діагностики, анафілаксія, алерген, двофазна анафілаксія, рефрактерна анафілаксія

Перша частина: https://accemedin.com/material/7075
Продовження:
Таблиця 8. Клінічні критерії для діагностики стійкої, рефрактерної та двофазної анафілаксії
|
Стійка анафілаксія є високоймовірною, якщо виконується наступний критерій: Наявність симптомів та/або результатів обстеження, які відповідають критеріям анафілаксії, які зберігаються щонайменше 4 години. |
|
Рефрактерна анафілаксія є високоймовірною, якщо виконуються обидва з наступних 2 критеріїв:
|
|
Двофазна анафілаксія дуже схожа, коли виконуються всі 4 критерії:
|
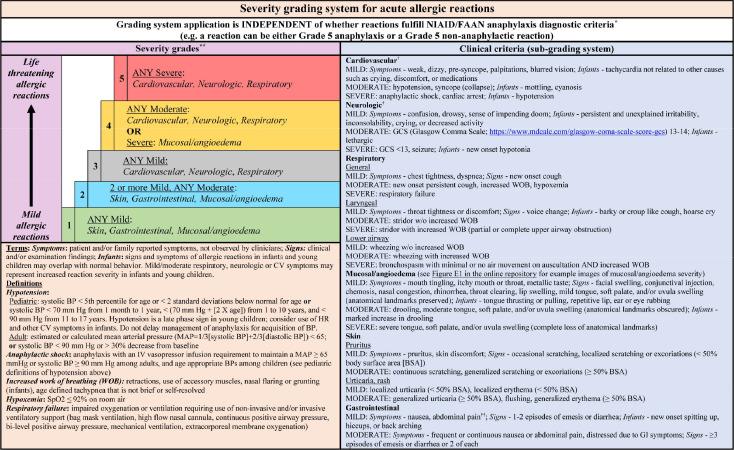
Тяжкість реакції є провідним фактором у подальшому перебігу анафілаксії, і, як повідомляється, анафілаксія, яка є настільки серйозною, що вимагає госпіталізації, становить до 22% у деяких серіях випадків.Важливо визнати, що тяжкість реакції є континуумом, який є результатом комбінації факторів ризику, включаючи ті, що пов’язані з алергеном (наприклад, доза алергену та шлях впливу) та пацієнтом (наприклад, імунна відповідь, поведінка, супутні ліки, та інші специфічні для пацієнта фактори та супутні захворювання). Пацієнти з тяжкою анафілаксією частіше мають артеріальну гіпотензію та гіпоксемію, а тяжка анафілаксія пов’язана зі старшим віком, наявними захворюваннями легенів і лікарською етіологією. З усім тим, анафілаксія є частиною спектра гострих алергічних реакцій, які варіюються від легких до летальних. Розуміння тяжкості анафілаксії та передача інформації про неї є важливими для пацієнтів та їхніх сімей, постачальників первинної медичної допомоги, лікарів невідкладної допомоги, лікарів лікарень, спеціалістів з алергії, шкільного персоналу, органів охорони здоров’я, постачальників харчових продуктів та дослідників. Будь-яке визначення тяжкості анафілаксії має чітко інформувати всіх зацікавлених сторін.
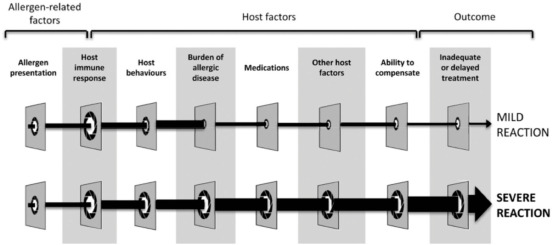
Фактори ризику важких алергічних реакцій. Багато факторів можуть змінювати легкі та важкі алергічні реакції.
Було розроблено кілька систем класифікації тяжкості, та термін «тяжкість» може мати різне значення для пацієнтів, клініцистів і дослідників. У 1977 р. Рінг і Мессмер запропонував систему класифікації з 4 категорій для опису тяжкості реакцій на замінники колоїдного об’єму, але ця система не була специфічною для анафілаксії. Згодом класифікація Рінга та Мессмера була модифікована таким чином, що ступінь I представляє ізольоване ураження шкіри слизових оболонок, ступінь II — легке та помірне ураження багатьох органів, ступінь III — загрозливі для життя симптоми в системі одного органу або більш серйозне ураження багатьох систем органів, і зупинка серця або дихання IV ступеня. Протягом багатьох років пропонувалися додаткові схеми оцінювання. Підхід, що включає 5 категорій, запропонований Семпсоном для класифікації анафілаксії, спричиненої їжею, був згодом прийнятий EAACI у 2007 році. У 2004 році Браун запропонував просту систему класифікації для ряду реакцій гіперчутливості, де легкі реакції обмежуються шкірними проявами; помірні реакції, що характеризуються ознаками, що вказують на ураження дихальної, серцево-судинної або шлунково-кишкової системи; і найважчі ступені, що характеризуються гіпоксією, гіпотензією та/або неврологічними порушеннями. Багато клініцистів продовжують використовувати систему класифікації системних алергічних реакцій підшкірної імунотерапії WAO 2010 року, часто застосовуючи модифікації на основі віку та тригера алергену. Нещодавно Шкалу оцінки системних алергічних реакцій Консорціуму з дослідження харчової алергії 2012 року, що характеризується 5 рівнями тяжкості, було оновлено завдяки співпраці експертів із представниками промисловості, щоб враховувати відповідь на терапію при призначенні ступеня тяжкості. Крім того, нещодавно було розроблено шкалу тяжкості харчової алергії з використанням амбулаторної клінічної когорти EuroPrevail із 8232 реакцій харчової алергії.
Таблиця 9. Система класифікації Брауна 2004 для реакцій гіперчутливості
|
Легкий: Ознаки та симптоми ізольовані на шкірі, такі як генералізована еритема, кропив’янка, періорбітальний набряк або ангіоневротичний набряк. |
|
Помірний: ознаки та симптоми, що вказують на ураження дихальної, серцево-судинної або шлунково-кишкової системи, такі як задишка, стридор, запаморочення (пресинкопе), потовиділення, стиснення в грудях або горлі або біль у животі |
|
Важкий: ознаки та симптоми, що вказують на гіпоксію, гіпотензію та/або неврологічні порушення, такі як ціаноз або насичення киснем ≤ 92%, гіпотензія (систолічний артеріальний тиск <90 мм рт.ст. у дорослих), сплутаність свідомості, колапс, зміна рівня свідомості або нетримання сечі. |
Існують обмеження щодо існуючих систем оцінки тяжкості анафілаксії. Наприклад, система класифікації Брауна за ступенем тяжкості, розроблена з використанням статистичного аналізу взаємозв’язку між особливостями індивідуальної реакції та подальшим лікуванням адреналіном і результатами пацієнта, використовує спостережувані ознаки та симптоми без використання фізіологічних вимірювань (наприклад, кров’яний тиск і насичення киснем). 1 ступінь не вважатиметься анафілаксією, тоді як 2 і 3 ступінь відповідатимуть визначенню анафілаксії та можуть бути прийняті як показання до негайного введення адреналіну як у громаді, так і в медичних установах. Однак така система класифікації може бути не ідеальною для прийняття рішень у режимі реального часу, оскільки суб’єкти, які постраждали, можуть швидко змінити ступінь тяжкості на більш важкий, що є аргументом для розгляду адреналіну при більш легких реакціях, якщо ризик прогресування викликає занепокоєння. Це може бути особливо актуальним у разі швидкої появи ознак або симптомів після контакту з підозрюваним алергеном. Під час аналізу 259 епізодів анафілаксії, спричиненої їжею, у 157 дітей, було виявлено розбіжності від 24,7% до 70,2% у різних системах оцінки тяжкості. Автори цього дослідження підкреслили, що наявність анафілаксії не є обов’язковою умовою для використання адреналіну під час алергічної реакції, і навпаки, використання адреналіну не вимагає встановлення діагнозу анафілаксії.
У 2021 році система класифікації тяжкості алергічних реакцій, запропонована Дрібіним та ін.отримано в результаті консенсусу експертів і синтезу багатьох попередніх шкал оцінювання з додатковою деталізацією, але також з додаванням певного ступеня складності. Перевагою системи класифікації 2021 є те, що вона дозволяє класифікувати алергічні реакції від легкої до важкої з або без визначення анафілаксії. Ця система клінічно інтуїтивно зрозуміла, але також має досить нюанси, тому, ймовірно, для її максимальної ефективності знадобиться використання інструментів підтримки прийняття рішень або засобів пам’яті. Хоча система оцінювання 2021 року розроблена на основі консенсусу експертів міждисциплінарної комісії з 21 члена, вона все ще потребує перевірки. Використовуючи вправу «Краще-гірше шкалювання», Стафорд та інші оцінили 10 систем класифікації тяжкості, дійшовши висновку, що географічне розташування постачальника медичних послуг може вплинути на оцінку тяжкості та що всі системи оцінки мають обмеження в розрізненні тяжкості анафілаксії.
Диференційна діагностика та діагностичне обстеження для пацієнтів із підозрюваною або передбачуваною анафілаксією є широкими. Діагностичне дослідження ґрунтується на ретельному клінічному анамнезі з увагою до віку пацієнта, статі, історії хвороби та атопії, одночасних ліків, можливих тригерів, характеру симптомів, часу початку, супутніх факторів (наприклад, фізичні вправи, вірусна інфекція, ліки, менструальний статус, стрес), тривалість симптомів, відповідь на лікування (епінефрин) і кількість епізодів, з дуже цілеспрямованим тестуванням для оцінки опосередкованих IgE тригерів (наприклад, шкірні та/або сироваткові проби). У рамках діагностичного обстеження обов’язково потрібно підтвердити, що події, про які йдеться, справді є анафілаксією, зазвичай шляхом виявлення об’єктивних ознак активації тучних клітин під час фізикального обстеження (наприклад, кропив’янка, хрипи при аускультації легенів або гіпотензія) або шляхом підвищення рівня триптази. рівня, щоб виключити імітацію анафілаксії. Необхідно розуміти, що при оцінці підвищеного гострого рівня триптази рівень триптази в сироватці крові вище встановленого в лабораторії нормального значення (наприклад, >11,4 нг/мл у багатьох лабораторних результатах) може виявити не всі епізоди анафілаксії. Швидше, зміна триптази вище bST пацієнта може запропонувати більш чутливу оцінку системної активації тучних клітин. Консенсус експертів припустив, що гострий рівень загальної триптази в сироватці принаймні на 20% плюс 2 нг/мл понад рівень BST пацієнта є доказом системної активації тучних клітин. Хоча це рівняння було запропоновано для допомоги в діагностиці MCAS, а не анафілаксії, воно було підтверджено в POA в 1 дослідженні, що свідчить про специфічність 91% і чутливість 78% (у цій когорті позитивні та негативні прогностичні значення становили 98%). і 44% відповідно).Залишаються питання щодо загальної корисності використання цього рівняння для анафілаксії загалом (наприклад, яка нормальна тимчасова внутрішньоособистісна дисперсія триптази та яке значення для анафілаксії, спричиненої їжею). Наприклад, Mateja et al виявлено, що може спостерігатися значна варіабельність рівнів bST і що серед осіб із підвищеним рівнем триптази через основне захворювання мастоцитів одна чверть осіб перевищила порогове значення 20% плюс 2 нг/мл при серійних безсимптомних вимірюваннях; вони виявили, що співвідношення гостра/вихідна триптаза 1,685 дозволило краще ідентифікувати анафілаксію (чутливість 94,4%, специфічність 94,4%). Було висловлено припущення, що навіть більш нюансовані граничні значення можуть бути адаптовані до індексу клінічної підозри, вказуючи на порогове співвідношення 1,868, коли клінічна підозра на анафілаксію низька, і співвідношення 1,374, коли клінічна підозра висока. Для полегшення використання цього конкретного підходу опубліковано онлайн-калькулятор на https://triptase-calculator.niaid.nih.gov.Таким чином, наразі ми не рекомендуємо використовувати лише рівняння 20% плюс 2 нг/мл для діагностики анафілаксії.
Таблиця 10. Диференційна діагностика анафілаксії
|
Анафілаксія
|
|
Синдроми мастоцитозу та активації тучних клітин, спадкова α-триптаземія |
|
Вазодепресивні реакції
|
|
Припливні синдроми
|
|
Ресторанні синдроми
|
|
Неорганічні причини
|
|
Різне
|
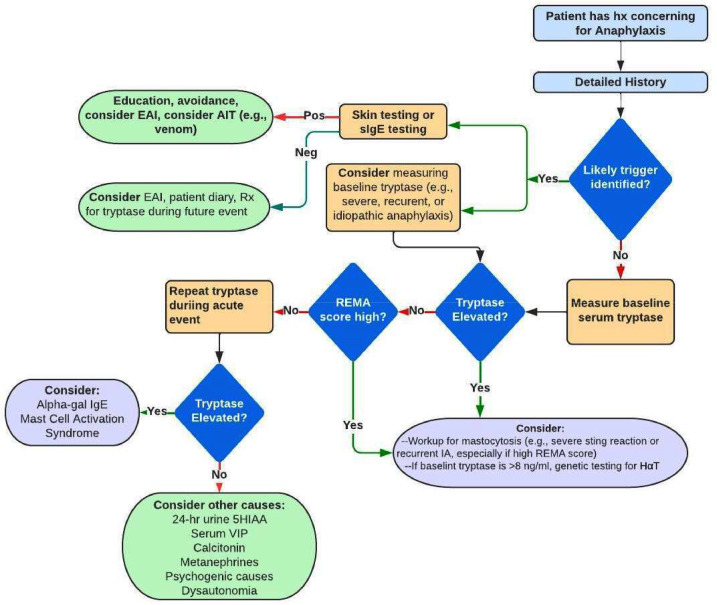
Діагностична оцінка пацієнта з анафілаксією в анамнезі
Після публікації параметра анафілаксії у 2015 році існує 2 оновлені міркування для оцінки пацієнтів із рецидивними симптомами, опосередкованими мастоцитами/рецидивним ІА. По-перше, це обстеження не лише на підвищений рівень bST (як маркер захворювання тучних клітин), але, якщо це необхідно, на HαT. HαT – це успадковане збільшення числа копій гена триптази α/β-1 (TPSAB1), що кодує α-триптазу, що призводить до підвищення рівня bST (зазвичай >8 нг/мл). Докази свідчать про те, що кількість копій гена TPSAB1, який кодує α-триптазу, значно впливає на рівні bST, і генотипування HαT можна розглядати в осіб з рівнем триптази вище 8 нг/мл. Включення номера копії може бути корисним для визначення того, чи може бути виправдана подальша оцінка оцінки клональних тучних клітин. HαT зустрічається у 5-7% людей у європейській та північноамериканській популяціях і хоча багато людей з HαT є безсимптомними, є дані, які свідчать про те, що він часто супроводжується широким спектром симптомів, що відповідають вивільненню медіатора тучних клітин. Однак у випадковій популяції біосховищ не було різниці в клінічній симптоматиці чи історії хвороби осіб з HαT порівняно з контрольною групою. Повідомлялося про HαT частіше у пацієнтів із тяжкими симптомами анафілаксії у пацієнтів з IgE-опосередкованою алергією (такою як алергія на отруту перетинчастокрилих), з мастоцитозом або без нього, тому її слід враховувати при оцінці пацієнтів із можливою анафілаксією. Наше розуміння HαT є неповним, і на цей час ступінь, до якого діагноз змінює лікування, невизначений. Однак, HαT слід враховувати при диференціальній діагностиці пацієнтів з підвищеним рівнем bST і рецидивною або важкою анафілаксією.
По-друге, були розроблені системи оцінки, щоб допомогти визначити, коли пацієнти з рецидивуючими симптомами, опосередкованими тучними клітинами, або рецидивуючим ІА виправдовують біопсію кісткового мозку для виявлення основного мастоцитозу або клонального розладу тучних клітин. Перший з них був опублікований Іспанською мережею мастоцитозів (називається оцінкою REMA) і описував пацієнтів із серйозними системними симптомами вивільнення медіатора тучних клітин, але без уражень шкіри, включаючи багатьох пацієнтів з анафілаксією отрути комах. У більш останньому дослідженні, проведеному в Сполучених Штатах, описується оцінка NICAS (NIH Idiopathic Clonal Anaphylaxis Score) у пацієнтів з ІА (жоден не мав отруйної анафілаксії). У цьому дослідженні у 14% пацієнтів з ІА було діагностовано захворювання клональних тучних клітин. Оцінка NICAS включає оцінку мутації KIT D816V. Хоча дані свідчать про те, що у багатьох пацієнтів із захворюванням клональних тучних клітин навіть найчутливіший тест на цю мутацію в периферичній крові може мати негативний результат, в межах оцінки NICAS прогностична цінність може покращитися. Оцінка REMA була перевірена та змінена в інших дослідженнях. Системи оцінки встановлюються лише для дорослих і повідомляють, що чоловіча стать, відсутність ангіоневротичного набряку/кропив’янки та наявність гіпотензії/синкопе під час епізодів свідчать про підвищену ймовірність клонального захворювання, а отже, про необхідність біопсії. Проте біопсія кісткового мозку може бути розглянута у пацієнтів з рецидивуючими або тяжкими епізодами анафілаксії поза цими системами оцінки.
Накопичуються дані, які свідчать про те, що алергія на альфа-гал може бути поширеною прихованою причиною повторної анафілаксії, яка раніше вважалася ідіопатичною залежно від географічного розташування. Як і при інших алергіях, виникає безсимптомна сенсибілізація на альфа-гал, яка не завжди прирівнюється до клінічної реактивності. Клінічний анамнез (анафілаксія, що виникла через кілька годин після споживання червоного м’яса), географічне розташування, контакт із кліщами та перебування на відкритому повітрі – усе це слід враховувати, приймаючи рішення про призначення та інтерпретацію рівня альфа-гал IgE. Наприклад, працівники лісу в США і Німеччина виявлено, що рівень сенсибілізації (>0,1 кОд/л) становить 39,1% і 35,0% відповідно. Однак у цих когортах 0% і 2% відповідно мали клінічні симптоми відстроченої анафілаксії від м'яса ссавців. У південноафриканській когорті пацієнтів із сповільненою реакцією на м’ясо аналіз альфа-гал IgE мав хороші дискримінаційні властивості порівняно з 26 здоровими особами контролю, з позитивною прогностичною цінністю та негативною прогностичною цінністю 92% і 83%, відповідно, за значенням більше ніж 1,0 кОд/л у цьому зразку (хоча ці прогностичні значення можуть не бути узагальненими в інших популяціях). Таким чином, призначаючи альфа-гал sIgE, клініцист повинен використовувати анамнез, щоб оцінити ймовірність алергії на альфа-гал перед тестом і спільне прийняття рішення з пацієнтом щодо пробного виключення (і подальшого зараження) м’ясом ссавців, якщо результат тесту позитивний.
Анафілаксія продовжує недостатньо розпізнаватися та недостатньо лікуватися епінефрином як у громаді, так і в медичних установах, однак дані свідчать про більш доцільне використання в місцях із системами, призначеними для розпізнавання та лікування. Хоча всі випадки анафілаксії є системною реакцією гіперчутливості, не всі системні реакції гіперчутливості відповідають діагностичним критеріям анафілаксії (наприклад, генералізована кропив’янка без додаткових симптомів після будь-якої форми АІТ). Потенціал прогресування від неанафілактичної системної реакції гіперчутливості до анафілаксії до анафілаксії, що загрожує життю, ще більше затьмарює цю відмінність. Таким чином, визначення включають ступінь тяжкості (наприклад, гіпотензія або респіраторний дистрес), щоб відрізнити анафілаксію від неанафілактичних системних реакцій гіперчутливості в будь-який момент часу.
Відокремлення анафілаксії від неанафілактичних системних реакцій гіперчутливості може мати епідеміологічне значення. Визначення анафілаксії часто плутають або переплітають або з критеріями діагностики анафілаксії, або зі ступенем тяжкості алергічної чи анафілактичної реакції. Діагностичні критерії та класифікація тяжкості мають найбільшу користь при встановленні ретроспективного діагнозу анафілаксії, особливо для використання в дослідженнях та епідеміологічних дослідженнях, а також при спробі передбачити ризик важкої реакції з майбутніми епізодами анафілаксії. Однак, оцінка тяжкості продовжує залишатися важливим, часто неявним, фактором лікування анафілаксії клініцистами. Хоча критерії NIAID/FAAN часто використовуються в клінічній практиці, їх діагностична точність є недосконалою.
Анафілаксія являє собою системну реакцію гіперчутливості високого ступеня. Для прийняття рішень про лікування в режимі реального часу відмова від адреналіну в умовах системних реакцій гіперчутливості, які ще не відповідають певному набору діагностичних критеріїв для анафілаксії, може призвести до прогресування системної реакції гіперчутливості. Таким чином, відповідність діагностичним критеріям анафілаксії не є обов’язковою перед застосуванням адреналіну для лікування системної реакції гіперчутливості. І навпаки, ані клінічне рішення про введення адреналіну, ані клінічна реакція на адреналін не повинні використовуватися як сурогатний маркер для встановлення діагнозу анафілаксії. Раннє лікування адреналіном системної реакції гіперчутливості може бути ефективнішим, ніж відстрочене лікування. Епінефрин для внутрішньом’язового введення є безпечним препаратом із незначною токсичністю в дозах, рекомендованих для лікування анафілаксії (0,01 мг/кг розчину 1:1000 [1 мг/мл] до максимуму 0,5 мг у дорослих і 0,3 мг у дітей препубертатного віку). Однак застосування адреналіну пацієнтам до появи будь-яких симптомів є малоцінною практикою (забезпечує невизначену користь із потенційною шкодою за значні витрати) і пов’язане з тягарем для якості життя. Примітно, що правильне використання адреналіну під час анафілаксії покращує якість життя та самоефективність. На додаток до адреналіну, інші підтримуючі методи лікування, такі як внутрішньовенні рідини та додатковий кисень, можуть відігравати важливу роль у лікуванні анафілаксії, навіть до розвитку гіпотензії. Слід зазначити, що використання адреналіну не вимагає повної активації швидкої медичної допомоги у пацієнта, який відчуває швидку, повну та тривалу відповідь на лікування, коли доступ до розширеної медичної допомоги є доступним у разі потреби. Обговорення готовності до анафілаксії, яке включає спільне прийняття рішень, може бути корисним, щоб допомогти пацієнтам зрозуміти порогові значення для подальшого лікування.
Нещодавно було опубліковано консенсус експертів щодо прогалин у знаннях щодо анафілаксії. Очікується, що подальші дослідницькі зусилля продовжуватимуть висвітлювати прогалини в знаннях у сфері діагностики анафілаксії. Вони підсумовані в таблиці 11.
Таблиця 11. Прогалини в знаннях щодо діагностики анафілаксії
|
Майбутня перевірка критеріїв WAO 2020 допоможе визначити їхню клінічну корисність. |
|
Подальший міждисциплінарний та міжнародний консенсус щодо клінічних діагностичних критеріїв буде важливим для вирішення питання про те, як клініцисти та дослідники: (1) класифікуватимуть ізольований гострий алергічний ангіоневротичний набряк ротоглотки або гортані, оскільки він відповідатиме критеріям діагностики анафілаксії WAO 2020 року, але не критеріям NIAID 2006 року; (2) визначити, що таке «важкі» шлунково-кишкові симптоми; (3) визначити, чи слід визнавати ураження шлунково-кишкового тракту системним проявом анафілаксії, якщо воно супроводжується вторинним ураженням слизової оболонки внаслідок харчових алергенів; та (4) досягти консенсусу щодо інших класифікаційних розбіжностей між критеріями NIAID 2006 року та WAO 2020 року. |
|
Подальша перевірка гострих рівнів і рівнів bST відповідно до варіації кількості копій TPSAB1. |
|
Краще зрозуміти роль третьої сторони, що покриває оцінку кількості копій TPSAB1, у впливі та інформуванні на оцінку пацієнтів із підозрою на захворювання тучних клітин. |
Скорочення: bST, вихідна сироваткова триптаза; NIAID, Національний інститут алергії та інфекційних захворювань; TPSAB1, триптаза α/β-1; WAO, Всесвітня алергологічна організація.
ДЖЕРЕЛО: https://www.annallergy.org

.jpg)
.jpg)