Біомаркери в патогенезі, діагностиці та лікуванні системної склеродермії
Дата публікації: 01.11.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: легені, нирки, лікування, біомаркери, прогноз, ураження, склеродермія
Біомаркери — це аналітичні індикатори наявності біологічного або хворобливого процесу та/або активності цього процесу в організмі людини, які можна точно та відтворювано виміряти. Таким чином, біомаркером може бути фізичний показник, такий як артеріальний тиск, цитокін, такий як IL-1, клітинний або клітинний прояв, такий як мембранний рецептор, метаболіт, такий як лактат, або інший відтворюваний індикатор біологічного чи медичного процесу. Біомаркери стають все більш важливим аспектом досліджень системної склеродермії (ССД) і клінічної допомоги. Поле біомаркерів при ССД є складним і розвивається, оскільки нещодавні дослідження показали, що принаймні 240 шляхів і численні нерегульовані білки беруть участь у патогенезі ССД.
ССД — це складне аутоімунне захворювання, що характеризується вираженим фіброзом шкіри, макро- та мікросудинним пошкодженням, вазонестабільністю та зниженням перфузії периферичної крові з ішемією, запаленням і рясним фіброзом внутрішніх органів, включаючи легені, нирки, кишечник, серце, і стравоходу. Наявність потовщення шкіри пальців, що проксимальніше п’ястно-фалангового суглоба, є достатнім для класифікації як ССД. Однак, якщо проксимального потовщення шкіри немає, зважене додавання таких знахідок: потовщення шкіри пальців, ураження кінчиків пальців (ішемічні виразки або ямкові рубці), телеангіоектазії, аномальні капіляри нігтьової складки, інтерстиціальне захворювання легень, легенева артеріальна гіпертензія, феномен Рейно та/або аутоантитіла, пов’язані з ССД все ще може дозволити поставити діагноз ССД. ССД наразі формально класифікується на дві основні форми:
1) обмежений шкірний ССД, що характеризується здебільшого дистальним потовщенням шкіри та наявністю антицентромерних антитіл;
2) дифузний шкірний ССЗ із поширеними дистальними та проксимальними шкірними змінами, як правило, з наявністю антитіл проти топоізомерази, антитіл до РНК-III полімерази або інших антинуклеарних антитіл проти ядерця.
Капіляроскопія нігтьової складки, яка зараз офіційно використовується для класифікації ССД, є неінвазивним і надійним методом виявлення діагностичного ураження мікросудин при ССД. Наявність ANA, рецидивуючого феномену Рейно та капіляроскопічних аномалій нігтьової складки вказують на прогресування до точної СС. 21 Антитіла до топоізомерази I також передбачають розвиток дифузного ураження шкіри з ССД та виразками пальців у перші 3 роки захворювання, а також важке інтерстиціальне захворювання легень (ІЗЛ)
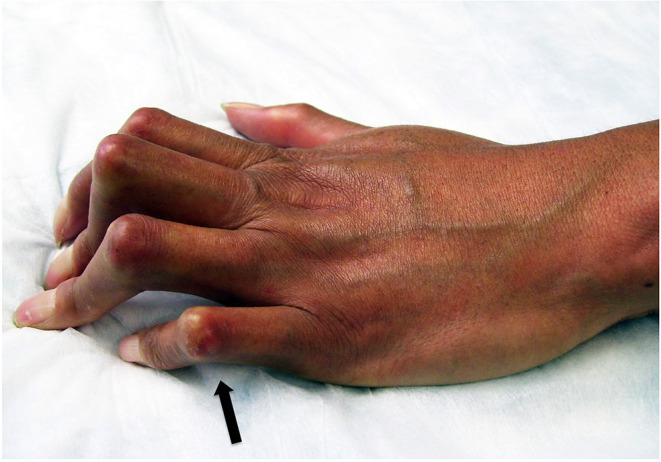
Смертність при ССД значно підвищується і зазвичай пов’язана з небезпечними для життя проявами ССД, включаючи інтерстиціальне захворювання легенів, склеродермічний нирковий криз, легеневу артеріальну гіпертензію, ураження серця, вторинну злоякісність та інфекції внаслідок некрозу тканин, аспіраційної пневмонії та імуносупресії.
Аутоантитіла як біомаркери при ССД
Аутоантитіла є найбільш часто використовуваними біомаркерами при ССД і особливо корисні для діагностики, класифікації та прогнозу ССД; біомаркери можуть бути потенційними терапевтичними мішенями. Антинуклеарні антитіла (ANA) присутні у понад 90% пацієнтів з ССД, причому антитіла проти центромер, анти-Th/To та антитопоізомераза I вважаються класичними біомаркерами, що зустрічаються у 60% випадків ССД. і визначення пацієнтів за чітко описаною клінічною класифікацією. Інші аутоантитіла присутні у більшості пацієнтів із ССД і, окрім ANA, включають аутоантитіла, спрямовані проти ендотеліальних або фібробластних антитіл, рецептора ангіотензину II типу 1, рецептора ендотеліну-1 типу A, рецептора фактора росту тромбоцитів (анти-PDGFR) і білки позаклітинного матриксу (ECM). Також описано більш складні системи аутоантитіл у ССД проти G-білкових рецепторів, факторів росту та відповідних рецепторів. Десять відсотків пацієнтів з ССД є ANA-негативними, але нові антитіла, включаючи анти-elF2B, комплекс анти-RuvBL1/2, анти-U11/U12 RNP, анти-U3RNP, анти-BICD2, анти-Ku та анти-PM/ Scl можна побачити як у позитивних, так і в негативних пацієнтів з ANA. Одночасна присутність двох різних ССД-специфічних аутоантитіл, таких як анти-центромерні антитіла та антитіла до РНК-полімерази III, є настільки незвичною, що з практичних цілей вони вважаються взаємовиключними, хоча завжди є випадки, які можуть порушити правило. Наприклад, нещодавнє дослідження Clark та ін. продемонструвало, що лише 5% пацієнтів із СС мали ≥2 будь-які аутоантитіла, і лише 2,3% мали ≥2 ССД-специфічні антитіла, причому найпоширенішою комбінацією були анти-U1RNP і анти- антитіла до топоізомерази I.
ANA може бути не просто біомаркером захворювання при ССД, але може відігравати патогенну роль через механізми, опосередковані імунними комплексами, і молекулярну мімікрію. ANA (зокрема, антитіла до топоізомерази-I та антитіла до РНК-полімерази III), очевидно, транспортуються в клітину шляхом прямої взаємодії з міжклітинними компонентами та рецепторами, націлюючись на внутрішньоклітинну топоізомеразу та РНК-полімеразу за допомогою відповідних антитіл. Анти-РНК-полімераза III є біомаркером, що передбачає швидке прогресування товщини шкіри, антральну васкулярну ектазію шлунка, рак, пов’язаний із ССД, нирковий криз при склеродермії та, можливо, аутоімунні синдроми, пов’язані з силіконовими грудними імплантатами. Ще одним підтвердженням цієї концепції патогенних аутоантитіл при ССД є реакція певних пацієнтів з ССД на вибір анти-В-клітинної терапії та роль активованих В-клітин в успішній алогенній трансплантації кісткового мозку для лікування СС.
Імуногенетичні маркери та антигени HLA як біомаркери в ССД
Раніше повідомлялося, що ССД слабко асоціюється з обмеженою кількістю антигенів класу II у головному комплексі гістосумісності (MHC), особливо HLA-DR1, DR2, DR3, DR5 та DR52. Однак ці особливості HLA-DR, які слабо пов’язані з ССД, перебувають у нерівноважному зв’язку з алелями HLA-DQ, які сильно пов’язані зі специфічними аутоантитілами, характерними для ССД. Таким чином, антицентромерні антитіла найчастіше виникають у присутності HLA-DQB1*0501 (DQ5), DQB1*0301 (DQ7) і подібних алелів DQB1, які характеризуються залишком тирозину або гліцину в крайньому домені, зокрема в положенні 26. Антитопоізомераза Антитіла I були пов’язані з наявністю HLA-DQB1*0301 (DQ7), DQB1*0302 (DQ8), DQB1*0601 та інших алелів DQB1, які виявляють у положенні 30 залишок тирозину. Антитіла до РНК-полімерази III були пов’язані з HLA-DQB1*02:01, DRB1*04:05, DRB4*01 і DQB1*04:01. Нещодавно антигени HLA класу 1 також були пов’язані з ССД, зокрема, гаплотип HLA-B*44:03-HLA-C*16:01, який взаємодіє з локусом KIR, що свідчить про те, що генетична модуляція активації лімфоцитів також сприяє виникненню СС. Схоже, що специфічні фенотипи KIR2 також сприяють зараженню та реактивації вірусу герпесу людини-6 (HHV-6), а реактивація HHV-6 була пов’язана з фіброзом і розвитком і тяжкістю ССД. Подібним чином імунодомінантні пептиди топоізомерази 1, фібриларину та центромерного білка А є гомологічними послідовностям вірусних білків із сімейств Mimiviridae та Phycodnaviridae, що свідчить про взаємодію між вірусом і імунним рецептором, яка може спровокувати вироблення специфічних аутоантитіл і подальший розвиток ССД.
Подібним чином поліморфізм із більшим числом копій гена C4 комплементу забезпечує менший ризик розвитку ССД, а нижча кількість копій C4A та C4B забезпечує підвищений ризик розвитку ССД, при цьому рівні білка C4 в сироватці крові відповідають кількості копій гена та знижуються або знижуються. підвищений ризик розвитку ССД. Таким чином, генетика C4 є ще одним імуногенетичним фактором, який незалежно знижує та підвищує ризик ССД разом з амінокислотними варіантами HLA-DRB1 та HLA-DQB1.
Інші біомаркери в ССД
Оскільки імунна система та механізми загоєння людського організму зазвичай активуються в ССД, численні молекули збільшуються або зменшуються при ССД в залежності від наявності, активності та терапії захворювання. Toll-подібні рецептори (TLR) розпізнають патогени та внутрішні сигнали активації, що призводить до активації багатьох шляхів, які зрештою призводять до запалення та змін у вродженому імунітеті, які виникають при ССД. Внутрішні сигнали активації включають пов’язані з пошкодженням молекулярні структури (DAMP), які є внутрішньоклітинними молекулами, що вивільняються під час значного пошкодження тканини або клітинного стресу та зв’язуються як ендогенні ліганди з TLR.
Трансформуючий фактор росту b (TGF-β) є центральним у процесі фіброзу, а також у дисрегуляції імунної системи щодо запалення. Пошкоджені або піддані стресу клітини виробляють TGF-β, який рекрутує та стимулює макрофаги, які секретують більше TGF-β, який потім посилює регуляцію генів, відповідальних за виробництво ECM і прогресуючий фіброз. Сироватковий цитокератин 17 (CK17), білок B1 маргінальної зони (MZB1) і багатий лейцином α2-глікопротеїн-1 (LRG1) є потенційними біомаркерами для ССД, причому CK17 негативно асоціюється з тяжкістю захворювання ССД, при цьому вищі значення CK17 є захисними. Рівень ендостатину пов’язаний із судинними проявами при ССД і особливо підвищується при прогресуючому ССД, його розглядають як маркер тяжкості ССД і потенційно як терапевтичну мішень. Періостін секретується фібробластами та епітеліальними клітинами і пов’язаний з клітинною адгезією, фіброзом, ангіогенезом, виживанням і ремоделюванням матриксу. Рівні циркулюючого періостину підвищені при ССД і пов’язані з тривалістю захворювання, фіброзом шкіри та кардіоміопатією. CCД хемокін 2 (CCL2) причетний до розвитку фіброзу при ССД.
МікроРНК (міРНК) — це короткі нуклеотидні послідовності, що беруть участь у клітинній регуляції. МікроРНК miR-138 і miR-27a пригнічують основні шляхи, що беруть участь у переході епітеліальних клітин до мезенхімальних і подальшому фіброзі, а відносна експресія miR-138 і miR-27a значно нижча у пацієнтів із ССД порівняно з контрольною групою, тоді як лише miR- 138 додатково пригнічується при дифузному шкірному ССД, отже потенційно обидва можуть бути використані як діагностичний біомаркер з miR-138 спеціально для прогнозування тяжкості. Пригнічення рецептора пухлиногенності 2 (ST2) зв’язує IL-33, а сироватково-розчинний ST2 (sST2) пригнічує передачу сигналів IL-33. Підвищені сироваткові рівні sST2 у сироватці крові асоціюються з вищою активністю захворювання суглобів і більшою дисфункцією кисті при ССД, що вказує на те, що sST2 може бути біомаркером для прогнозування ураження суглобів ССД.
Ангіопоетини (Ang-1 і Ang-2) взаємодіють зі специфічним рецептором тирозинкінази Tie2 для модуляції активації ендотеліальних клітин, моделювання судин і ангіогенезу. Ang-1 знижується, а Ang-2 підвищується у пацієнтів з ССД порівняно з контрольною групою, і цей дисбаланс може сприяти як абляції судин, так і утворенню аномальних нових кровоносних судин.
Підвищена активація та експресія інтерферонів типу 1 є типовими для ССД і виглядають подібними до аномалій інтерферону, які спостерігаються при системному червоному вовчаку, і можуть аналогічно становити потенційну терапевтичну мішень. Збільшення IFN-I пов’язане з антитілами до U1-RNP, антитілами до топоізомерази та більш агресивним ураженням легенів, шкіри та скелетних м’язів.
Препарати, які перешкоджають передачі сигналів INF-1 і, таким чином, подальшій активації тирозинкіназ, запаленню та фіброзним процесам, мають значний потенціал для терапії ССД. Аніфролумаб — це моноклональне антитіло, спрямоване проти субодиниці 1 рецептора IFN-I, яке виявилося ефективним при системному червоному вовчаку. Під час ранніх клінічних випробувань також було показано, що аніфолумаб клінічно зменшує фіброз при ССД і пов’язаний із посиленням маркерів деградації колагену типу III і зниженням рівня білків, асоційованих з Т-клітинами, що свідчить про зниження фіброзного стану.
ССД проявляє значне пошкодження ендотелію, активацію молекули міжклітинної адгезії 1 (ICAM-1), молекули адгезії судинних клітин 1 (VCAM-1), E-селектину, фактора фон Віллебранда (vWF), тканинного фактора (TF) і тканинного тромбіну що призводить до місцевої гіперкоагуляції. Посилена експресія тромбіну стимулює ендотеліальні клітини та фібробласти, що призводить до посиленого виробництва колагену, зниження матриксних металопротеїназ і розширення ECM, що сприяє фіброзу при ССД. ССД характеризується підвищеним потенціалом ендогенного тромбіну, експресією тромбіну та біомаркерами пошкодження ендотелію, а також нижчими рівнями тромбомодуліну, фібринолізу та тромбоцитів, пов’язаними з васкулопатією та виразками пальців. Ці висновки свідчать про те, що інгібітори тромбіну можуть бути корисними для лікування ССД, а ранні дослідження на людях із застосуванням інгібітора тромбіну дабігатрану попередньо продемонстрували прийнятну безпеку та зменшення товщини шкіри, що свідчить про те, що інгібітори тромбіну є життєздатною терапевтичною можливістю.
Лізофосфатидна кислота (LPA) є ліпідним медіатором, який утворюється ферментом лізофосфоліпазою (аутоксаїном) у місцях пошкодження клітини або запалення, а LPA зв’язується з рецепторами LPA, пов’язаними з G-білком (LPAR). LPAR 1 після активації опосередковує фізіологічні ефекти LPA, включаючи міграцію, виживання та інфільтрацію макрофагів, активацію запалення, вивільнення прозапальних медіаторів, включаючи IL-1 та IL-18, сприяння диференціації мезенхімальних клітин до міофібробластів та виведення колагену. Циркулюючий LPA збільшується у пацієнтів з ССД порівняно з контрольною групою і, отже, є природним біомаркером і мішенню для лікування ССД. Лікування пацієнтів із СС інгібітором LPAR 1 призвело до зниження балів шкіри та зменшення LPA-пов’язаних генів активації, що вказує на потенційно корисне втручання.
Цитокіни, інтерлейкіни та хемокіни часто підвищені при СС. Повідомлялося, що IL-1, IL-4, IL-6, IL-10 IL-13, IL-16, IL-18, IL-22, IL-32 та IL-35 є підвищеними при ССД. 103–105 IL-17A специфічно не підвищується, тоді як IL-17B, IL-17E та IL-17F мають вищий ССД.
Інтерстиціальне захворювання легенів (ІЗЛ) при ССЗ (ІЗЛЗ)
ССД часто ускладнюється інтерстиціальним захворюванням легенів (ІЗЛ) як основною причиною смертності та інвалідності. Приблизно у 65–85% пацієнтів із ССД розвивається ІЗЛ різного ступеня тяжкості, а у 25–30% розвивається агресивне захворювання, яке пов’язане зі значною смертністю у 40% протягом 10-річного періоду. Ураження легенів призводить до приблизно 35% усіх смертей, пов’язаних із ССД. Фактори ризику ССД-ІЗЛ включають чоловічу стать, дифузний шкірний ССД, афроамериканську спадковість та наявність анти-Scl-70 (антитопоізомерази I) антитіл.
Пошкодження ендотелію легень займає центральне місце в патогенезі ІЗЛ. Типовою гістологічною картиною ССД-ІЗЛ є неспецифічна інтерстиціальна пневмонія на відміну від ідіопатичного легеневого фіброзу, який зазвичай є звичайною інтерстиціальною пневмонією. ССД-ІЗЛ характеризується запаленням на ранніх стадіях захворювання, широкою ендотеліальною дисфункцією та підвищеним відкладенням ECM, особливо колагену, що виробляється активованими міофібробластами в резидентних тканинах. Збільшення ECM збільшує жорсткість легеневих тканин, що призводить до рестриктивного захворювання легень зі зниженням податливості легенів, зменшенням об’ємів легенів і зниженням дифузійної здатності, що призводить до порушення толерантності до фізичних навантажень, задишки, втоми, гіпоксії, підвищення тиску в легеневій артерії, роботи інвалідність та скорочення тривалості життя. Вважається, що патологічний процес ініціюється повторюваним пошкодженням епітеліальних і ендотеліальних клітин з активацією імунної системи, залученням фібробластів і фенотиповою трансформацією фібробласта в міофібробласт, який потім секретує надмірну кількість ECM, що призводить до фіброзу. Початкові пошкодження ендотелію та епітелію, ймовірно, будуть аутоімунними та запальними за своєю природою, але також можуть бути спричинені патогенами та факторами навколишнього середовища. Апоптоз відбувається в певних епітеліальних клітинах, що оголюють альвеоли, і одночасно інші епітеліальні клітини переходять у міофібробласти зі зниженим апоптозом, втратою полярності, посиленням міграції та збільшенням виробництва ECM, включаючи колаген. Знижений апоптоз міофібробластів може спричинити аномальну персистенцію цих активних клітин, сприяючи прогресуючому фіброзу.
ССД-ІЗЛ виявляється після діагностики за допомогою КТ високої роздільної здатності (HR-CT) і прогресування як за допомогою HR-CT, так і тестів легеневої функції (ТЛФ). КТ також використовували для виявлення раннього ССД-ІЗЛ та диференціювання його від інтерстиціальної пневмонії та для більш точного спостереження за прогресуванням ССД-ІЗЛ. Нещодавно міжреберне ультразвукове дослідження також використовувалося для скринінгу ССД-ІЗЛ для виявлення характерних В-ліній і субплеврального захворювання. Значна або прогресуюча ССД-ІЗЛ зазвичай спонукає до терапії. Слід усвідомлювати, однак, що ефективна терапія ССД-ІЗЛ забезпечує стабілізацію фіброзу легенів або зниження швидкості зниження функції легень, а не повне відновлення функції легень. Таким чином, наголошується на ранній діагностиці та швидкому лікуванні ССД-ІЗЛ до значного незворотного пошкодження легень.
Загальні рекомендації щодо лікування ССД-ІЗЛ нещодавно були переглянуті та переглянуті. Препарати, які використовуються для лікування ССД-ІЗЛ, включають неспецифічні імунодепресанти (циклофосфамід, мікофенолат), специфічні імунодепресанти, включаючи анти-IL-6 агенти (тоцилізумаб), анти-В-клітинні препарати (ритуксимаб) і антифіброзні агенти. Неспецифічні імуносупресори, мікофенолат, інгібітор синтезу гуанозинових нуклеотидів, і циклофосфамід, алкілуючий агент, зменшують проліферацію фібробластів, Т-хелперів і В-клітин і, таким чином, мають значну антифіброзні ефекти. Дійсно, мікофенолат наразі вважається стандартною та основною терапією ССД-ІЗЛ. Тоцилізумаб все частіше використовується для ССД-ІЗЛ. Інгібування рецептора IL-6 за допомогою тоцилізумабу знижує активацію міофібробластів і поляризацію макрофагів M2, що важливо для антифіброзного ефекту тоцилізумабу. Вичерпання В-клітин пригнічує профіброзну диференціацію макрофагів і, таким чином, пригнічує фіброз, надаючи додаткове обґрунтування для несхвалених, але часто використовуваних анти-В-клітинних засобів, таких як ритуксимаб у ССД-ІЗЛ. Антифіброзний препарат нінтеданіб, інгібітор тирозинкінази, пригнічує рецептори PDGF, FGF і фактора росту ендотелію судин (VEGF), зменшуючи фіброз. Однак антифіброзний пірфенідон, мабуть, має менш сприятливий ефект при ССД і наразі не схвалений для лікування цього захворювання.
Трансформуючий фактор росту b (TGF-β) виробляється стресовими або пошкодженими клітинами легенів, які стимулюють і рекрутують тканинні макрофаги, які посилюють виробництво TGF-β, який потім посилює регуляцію генів, відповідальних за виробництво ECM і прогресуючий фіброз. Інші біомаркери, які зазвичай беруть участь у ССД-ІЗЛ, включають STAT4, CD226, регуляторний фактор інтерферону 5 (IRF5), кіназа-1, пов’язана з рецептором інтерлейкіну-1 (IRAK1), фактор росту сполучної тканини (CTGF), піриновий домен, що містить 1 (NLRP1), зета-ланцюг глікопротеїну поверхні Т-клітин (CD3ζ) або CD247, сімейство NLR, SP-D (поверхнево-активний білок), KL-6 (Krebs von den Lungen-6), IL-8, LRG1 і CCL19, а також генетичні фактори, включаючи алелі DRB1. Біомаркерами, найбільш пов’язаними з активним захворюванням легенів і прогресуванням, зокрема при ССД-ІЗЛ, є KL-6, SP-D (поверхнево-активний білок), C-реактивний білок і CCL19, хоча інші неспецифічні біомаркери також можуть бути підвищені.
IL-6 важливий у прогресуванні ССД-ІЗЛ і секретується міофібробластами, макрофагами M1 і B-клітинами. IL-6 посилює експресію рецепторів IL-4 та IL-13, збільшуючи поляризацію макрофагів М2 і посилюючи фіброз. Ця центральна роль додатково підтверджується інгібуванням тоцилізумабом рецептора IL-6, що знижує активацію міофібробластів і зменшує поляризацію макрофагів M2, що призводить до частково продемонстрованих антифіброзних ефектів тоцилізумабу в умовах ССД-ІЗЛ. Активація B-клітин також поширена при ССД, і B-клітини збільшують кількість ангіогенних факторів. Деплеція В-клітин пригнічує диференціацію профіброзних макрофагів і, таким чином, пригнічує фіброз, що є обґрунтуванням для анти-В-клітинних засобів, таких як ритуксимаб, у ССД-ІЗЛ.
З перерахованих вище біомаркерів аутоантитіла та С-реактивний білок є єдиними біомаркерами, які зазвичай використовуються в сучасній рутинній клінічній практиці. У цій лінії, якщо антитіла проти топоізомерази-I присутні, а антитіла до антицентромери відсутні, спостерігається підвищена частота прогресуючої ССД ІЗЛ. Однак для клінічного використання досліджуються різні інші біомаркери, включаючи KL-6, CCL18, MMP7, MMP12, IL- 6, CXCL4, CXCL3 і хітиназо-3-подібний білок 1. Використання панелей біомаркерів, комплексних вимірювань біомаркерів, машинного навчання та штучного інтелекту є зростаючою тенденцією в цій галузі.
Пошкодження судин при ССД, включаючи легеневу артеріальну гіпертензію (ЛАГ)
Найбільш очевидним клінічним проявом судинного захворювання при ССД є феномен Рейно (ФР) та ішемія пальців. ФР супроводжується телеангіоектазами, ішемічними виразками пальців, рубцями з ямками, навколонігтьовими мікросудинними аномаліями, легеневою артеріальною гіпертензією (ЛАГ), а також захворюваннями серця, що впливають на функцію та толерантність до фізичних навантажень.
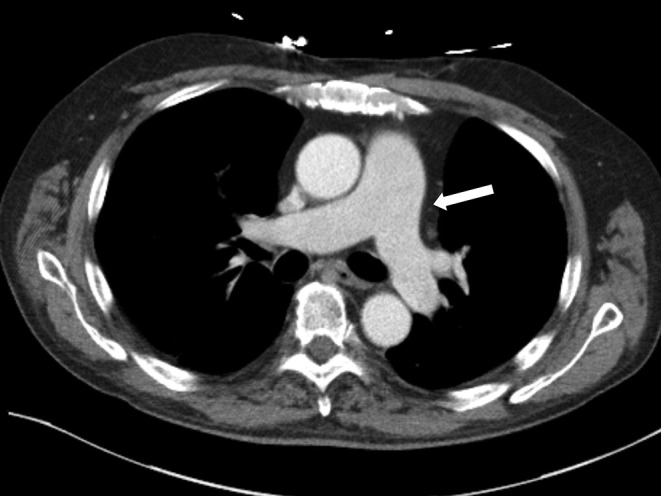
ЛАГ зустрічається у 7–19 % пацієнтів із СС залежно від популяції та тривалості захворювання. Фактори ризику ЛАГ включають тяжкий феномен Рейно, важку ішемію пальців, шкірну телеангіоектазію, хронічне захворювання, пізній початок захворювання, літній вік, стан у постменопаузі, знижену дифузійну здатність (DLCO < 50%), DLCO/альвеолярний об’єм менше ніж 70%, форсована життєва місткість крові/DLCO менше ніж 1,6 і підвищення систолічного тиску в правому шлуночку понад 2 мм рт.ст./рік. Скринінг повинен включати специфічні аутоантитіла (антитопоізомераза I (SCL-70), антицентромерні та анти-РНК-полімерази III та антифосфоліпідні антитіла), тести легеневої функції, ехокардіографію, сироватковий N-кінцевий промозковий натрійуретичний пептид (NT-proBNP) ), капіляроскопія нігтьової складки та початкова КТ високої роздільної здатності для виключення ІЗЛ, а якщо є питання про ЛАГ, катетеризація правих відділів серця для визначення тиску в ПА. Лікування ЛАГ у СС нещодавно було переглянуто за допомогою рекомендацій і включає поетапний підхід із застосуванням окремих препаратів або комбінованої терапії інгібіторами фосфодіестерази типу 5 (ФДЕ-5) (включаючи силденафіл і тадалафіл), стимуляторами розчинної гуанілатциклази (рГЦ) (включаючи ріоцигуат), антагоністи рецепторів ендотеліну (включаючи бозентан, амбрізентан і мацітентан), аналоги простацикліну (епопростенол, трепростиніл та ілопрост) або селективні агоністи рецепторів IP простацикліну (селексипаг), які підтримуються антикоагулянтами, діуретиками, дигоксином і блокаторами кальцієвих каналів, де це доречно.
Феномен Рейно (ФР) може виникнути без системного захворювання (первинний ФР), але ФР є майже універсальним явищем, пов’язаним із ССД, із характерною 3-фазною зміною кольору, пов’язаною із симптомами болю, печіння, ішемії та в деяких випадках ішемії. виразки та/або некроз пальців. Bernero et al. продемонстрували, що велика частина початково первинного ФР прогресує до вторинного ФР, тобто з часом у них розвивається певне аутоімунне захворювання, таке як СС або інше аутоімунне захворювання. Патофізіологія РП подібна до інших механізмів судинного ураження при ССД, які детально обговорюються в цьому розділі. Нові методи кількісної оцінки RP за межами капіляроскопії нігтьової складки включають лазерну допплерівську візуалізацію, лазерний спекл-контрастний аналіз, тепловізор, а також кольорову та спектральну доплерівську візуалізацію. Нещодавно було переглянуто фармакологічну терапію РЗ, яка зазвичай починається з блокаторів кальцієвих каналів, а якщо вона неефективна, потім застосовують інгібітори ФДЕ-5 або флуоксетин з блокаторами рецепторів ендотеліну-1 та внутрішньовенні простаноїди, призначені для найбільш резистентних випадків.
Пошкодження судин і подальший фіброз можуть виникнути внаслідок активації та апоптозу ендотеліальних клітин, специфічних аутоантитіл, інфекційних агентів, ендогенної гіперкоагуляції, активних форм кисню, а також інших причин, що забезпечують багато потенційних біомаркерів. Після активації ендотеліальні клітини секретують ендотелін-1 (ET-1), фактор фон Віллебранда (vWF), оксид азоту та ендотеліальну синтазу оксиду азоту, що призводить до нестабільності судинного тонусу з меншою вазодилатацією та більшою вазоконстрикцією, що викликає ішемію тканин і гіпоксія. Ендотелін-1 стимулює фібробласти перетворюватися на активовані міофібробласти з підвищеною секрецією ECM, гіперплазією інтими, звуженням просвіту, зменшенням капілярного кровотоку, облітерацією судин та ішемією. Місцева секреція фактора фон Віллебранда викликає агрегацію тромбоцитів, гіперкоагуляцію та відкладення фібрину, що призводить до термінального пошкодження судин. Міофібробласти також утворюються шляхом переходу ендотелію в мезенхіму. Активований ендотелій також експресує посилені молекули адгезії та специфічні хемокіни, рекрутуючи імунні клітини та периваскулярні інфільтрати, що призводить до подальшого запалення та фіброзу. Слід зазначити, що ангіогенез також знижується через незбалансовані цитокіни, включаючи ендотеліальний фактор росту (VEGF), матриксну металопротеїназу (MMP)-9, ендоглін, ET-1) та ангіостатичні засоби (пентраксин 3 (PTX3), MMP-12, ендостатин, фактори ангіостатину, семафорину3E (Sema3E) і Slit2), а також дисфункції та порушення рекрутування ендотеліальних клітин-попередників (EPC).
Підвищений ендогенний потенціал генерації тромбіну та вищий пік тромбіну присутні при ССД, що супроводжується підвищенням маркерів запалення, підвищенням активності фактора VIII, еозинофілією крові, тромбоцитопенією, зниженням VCAM-1 та зниженням тромбомодуліну, що вказує на важливу роль тромбінової системи в пошкодженні судин ССД. Дабігатран, прямий інгібітор тромбіну, добре переноситься пацієнтами з ССД з ІЗЛ і, здається, демонструє деякі покращення, але довготривалі клінічні випробування ще потребують проведення.
Рецептор гамма, активований проліфератором пероксисом (PPAR) є важливим регулятором росту фібробластів, утворення ECM і ремоделювання сполучної тканини. 87–92 PPAR перешкоджає шляху TGFβ, пригнічуючи здатність TGFβ спонукати фібробласти диференціюватися в міофібробласти та інгібувати вироблення колагену через систему коактиватора транскрипції. Активність PPAP та експресія адипонектину, чутливого та специфічного показника активності PPAR, знижуються при ССД і пов’язані з більш прогресуючим фіброзом шкіри. Циркулюючі рівні PPAR підвищуються при ССД, особливо при дифузному шкірному ССЗ із посиленням фіброзу шкіри, що свідчить про дефект експресії PPAR при ССД, який перешкоджає активації мембранозв’язаного ППАР, що посилює фіброз. Агоністи PPAR ефективні для зменшення фіброзу на тваринних моделях ССД; таким чином, активація PPAR і рівні адипонектину мають потенціал як біомаркери фіброзної активності при ССД.
Селектини — це молекули, які забезпечують переміщення клітин і їх самонаведення. L-селектин (CD62L) експресується на лейкоцитах, P-селектин експресується на тромбоцитах, а E-селектин присутній на ендотеліальних клітинах і мегакаріоцитах, але були суперечливі результати щодо імуноглобуліноподібних молекул клітинної адгезії, включаючи міжклітинні молекули адгезії (ICAM), молекули адгезії судинних клітин (VCAM) і молекули з’єднання (JAM). Циркулюючі рівні ICAM-1 і VCAM-1 вищі у пацієнтів з ССД з виразками пальців, ніж без них, але це не може бути прогностичною ознакою появи нових ДУ при ССД. Аналогічно VCAM-1 може бути підвищений у ССД як з, так і без ЛАГ. JAMs — це молекули адгезії на ендотеліальних клітинах, фібробластах, епітеліальних клітинах і клітинах крові, а циркулюючі рівні асоціюються з мікросудинними захворюваннями та виразками пальців.
Сімейство васкулярного ендотеліального фактора росту (VEGF) включає VEGF-A, -B, -C і -D, а також плацентарний фактор росту, і їх рівень у крові та шкірі підвищується при ССД. Рівні VEGF також корелюють з ЛАГ, але вони нижчі у пацієнтів з виразками пальців. TGF-β залишається важливим для всіх проявів ССД, включаючи ЛАГ. Ендоглін (CD105) є допоміжним рецептором для TGF-β та ендогліну вищої циркулюючої крові, який корелює з виразками пальців, що свідчить про те, що це був біомаркер судинного ураження при СС.
Ендотелін-1 (ЕТ-1) секретується ендотеліальними клітинами та активованими гладком’язовими клітинами, фібробластами, епітеліальними клітинами та клітинами запалення. 202 Підвищений ET-1 присутній у ССД-PAH порівняно з пацієнтами ССД без PAH та здоровими контрольними особами. Лікування бозентаном знижувало ET-1 у пацієнтів СС з ЛАГ до рівнів, наявних у СС без ЛАГ, що вказує на те, що цей біомаркер міг визначити тяжкість судинного ураження та відповідь на терапію бозентаном.
Пентраксин 3 є рецептором, що виробляється активованими ендотеліальними клітинами, макрофагами, гладком’язовими клітинами, дендритними клітинами та фібробластами. Однак рівні пентраксину 3 мають лише різні асоціації з васкулопатією в ССД. Ендостатин є ангіостатичним пептидом, який блокує активність VEGF і був пов’язаний із ЛАГ, склеродермічним нирковим кризом та серцевим ураженням. Рівень VEGF і підвищується у пацієнтів із більш прогресуючим захворюванням судин у ССД. Матричні металопротеїнази руйнують ECM, а рівні MMP-9 знижуються у ССД-PAH і підвищуються під час терапії босентаном, тоді як MMP-12 підвищується у пацієнтів із виразками пальців та аномалії капілярів нігтьової складки.
Тромбомодулін (TM), CD163 і NT-proBNP підвищені при ССД-PAH. Підвищені рівні марезину 1 пов’язані з розвитком виразок пальців при СС. Підвищений рівень асиметричного диметиларгініну (ADMA) є ендогенним інгібітором оксиду азоту (NO), який впливає на функцію ендотелію та підвищується при мікросудинних захворюваннях при СС. Гіпохромні еритроцити тісно пов’язані з прогнозом ССД-PAH. Гемоглобін і феритин значно нижчі у пацієнтів з легеневою гіпертензією (ЛГ) при СС порівняно з пацієнтами з легеневою гіпертензією, тоді як сечова кислота та NT-proBNP значно вищі. Циркулюючий CCL21 у ССД є біомаркером, пов’язаним з ЛАГ і розвитком ЛАГ.
Шкіра при ССД
Потовщення шкіри є універсальним при ССД і, як правило, необхідним для встановлення точного діагнозу за певними винятками. Існує багато кандидатів на біомаркери захворювань шкіри при ССД. Як правило, антитіла проти топоізомерази-I та анти-РНК-полімерази III пов’язані з більш обширним і серйозним ураженням шкіри, тоді як антитіла проти центромери пов’язані з обмеженим ураженням шкіри. У біоптатах шкіри рівні експресії TGF-β1, TGF-βR1 і TGF-βR2 вищі у пацієнтів із ССД, ніж у контрольній групі. Шляхи, пов’язані з IL-6 і JAK, також беруть участь у потовщенні шкіри як безпосередньо, так і через відповідь на специфічні інгібітори, які блокують ці шляхи. Експресія шкірних генів асоційованих з макрофагами біомаркерів (CD14, IL13RA1) і TGF-β-асоційованих біомаркерів (OSMR SERPINE1, CTGF) пов’язана з прогресуванням шкірних захворювань при ССД. Білок B1 маргінальної зони (MZB1), здається, є хорошим біомаркером фіброзу шкіри. Рівні циркулюючого періостину підвищені при ССД із великим фіброзом шкіри. Сиртуїни є НАД-залежними білковими деацетилазами, які регулюють ангіогенез; SIRT1 і SIRT3 корелювали зі ступенем фіброзу шкіри при ССД. Адипонектин знижується в ураженій шкірі ССД. Нещодавно фібрилярна молекула колагену COL4A1, матрицелюлярний білок COMP, ген, що кодує спондин SPON1, TNC та інший білок ECM, були активовані в шкірі ССД і повністю відрізняли ССД від нормальної шкіри.
Товщина шкіри при ССЗ часто зменшується спонтанно з часом, що збиває з пантелику багато інтервенційних досліджень, про які нещодавно повідомлялося з белімумабом і нінтеданібом. Однак сучасні рекомендації щодо лікування відзначають, що мікофенолат, циклофосфамід і метотрексат, як було продемонстровано, покращують модифіковану оцінку шкіри за Роднаном і зменшують товщину шкіри при ССД. Метотрексат може бути проблематичним при ССД, оскільки іноді він може викликати запалення легенів, яке можна сплутати з ССЗ-ІЗЛ. Нещодавно було показано, що інгібітор JAK тофацитиніб, хоча і не схвалений для ССД, є більш ефективним, ніж метотрексат, у зменшенні модифікованої оцінки шкіри за Роднаном, товщини шкіри за ультразвуковим дослідженням, опорно-рухових симптомів і зменшення регульованих інтерфероном генів біомаркерів при ССД. Зиритаксестат є маломолекулярним селективним інгібітором аутотаксину та знижує модифіковану оцінку шкіри за Роднаном при ССД, і, таким чином, є перспективним новим препаратом, який зараз проходить клінічні випробування. Існують деякі докази того, що ритуксимаб і тоцилізумаб також покращують показники шкіри при ССД.
Виразка шкіри при ССД класифікується як пов’язана з кальцинозом, травматична або ішемічна. Лікування виразки шкіри при ССД включає уникнення вазоконстрикторів (наприклад, кофеїну, амфетамінів, кокаїну, нікотину), низьких температур і травм, припинення вживання тютюнових виробів і відповідний догляд за ранами. Виразки, викликані кальцинозом шкіри при ССД, розвиваються внаслідок відкладення кристалів гідроксиапатиту в підшкірних тканинах і можуть лікуватися хірургічним видаленням або санацією, місцевими антибіотиками, низькими дозами тетрациклінів (міноцикліну або доксицикліну) або місцевим або внутрішньовенним введенням тіосульфату натрію. Судинорозширювальні засоби для лікування та профілактики виразки шкіри подібні до тих, що застосовуються при феномені Рейно, і включають блокатори кальцієвих каналів (особливо амлодипін і ніфедипін), місцеву нітрогліцеринову мазь та інгібітори фосфодіестерази (цилостазол, силденафіл).
Травна система при ССД
Ураження шлунково-кишкової системи при ССД є глибоким і включає порушення моторики кишечника та стравоходу та фіброз, ішемію кишечника, первинний склерозуючий холангіт, первинний біліарний цироз, надмірний ріст бактерій, збільшення кількості злоякісних пухлин кишечника та запалення кишечника серед інших ускладнень. Результати зазвичай є анатомічно специфічними; проте нещодавно було використано GIT 2.0 консорціуму клінічних випробувань Scleroderma Clinical Trial Consortium. Лікування шлунково-кишкових ускладнень зазвичай зосереджено на окремих проблемах гастроезофагеального рефлюксу (інгібітори протонної помпи, H2-блокатори, сукральфат), стриктури (розширення), порушення моторики та надмірного бактеріального росту (еритроміцин, азитроміцин, метоклопрамід, домперидон, цизаприд). У ряду біомаркерів анти-U11/12 антитіла були пов’язані з серйозними порушеннями моторики шлунково-кишкового тракту. У фекаліях спостерігається підвищений рівень запального біомаркера кальпротектину при ССД, що свідчить про те, що фекальний кальпротектин може бути ефективним біомаркером захворювання кишечника, як і при інших запальних захворюваннях кишечника.
Біомаркери захворювань нирок при ССД
У ниркових проявах ССД переважає склеродермічний нирковий криз (SRC), тоді як справжній імуноопосередкований гломерулонефрит та інтерстиціальний нефрит, які виникають при ССД, зазвичай пов’язані з перекриттям захворювання ССД з васкулітом та/або системним червоним вовчаком або реакціями на ліки, а не з чистим ССД. SRC характеризується злоякісною гіпертензією, мікроангіопатичним гемолізом, мікротромбозом, тромбоцитопенією, вазоспазмом і прогресуючою нирковою недостатністю, які можуть бути спровоковані кортикостероїдами, кокаїном, циклоспорином і такролімусом. Патологічно SRC характеризується досить м’якими або ледь помітними ознаками, але може демонструвати типову гістопатологію «цибульки», гіперплазію юкстагломерулярного апарату, мембранопроліферацію, реноваскулярне ендотеліальне пошкодження, проліферацію інтими, тромботичну ангіопатію, фібринові мікротромби, гемоліз, мезангіоліз, звуження ниркових артеріол, вазоспазм, оклюзія судин, ішемія, некроз, ремоделювання судин і можливий фіброз, пов’язаний з гіперренінемією та прискореною гіпертензією.
Діагностичні критерії СРК наступні:
- систолічний артеріальний тиск (САТ) >140 мм рт.ст.;
- діастолічний артеріальний тиск (ДАТ) >90 мм рт.ст.;
- підвищення вихідного САТ ≥ 30 мм рт.ст.;
- підвищення ДАТ ≥ 20 мм рт.ст.;
- підвищення рівня креатиніну сироватки на ≥50% порівняно з початковим рівнем або креатинін сироватки >120% від верхньої межі норми для місцевої лабораторії;
- протеїнурія ≥2+ за тест-смужкою та підтверджена точковим співвідношенням білок:креатинін у сечі ≥ верхня межа норми;
- гематурія ≥2+ на тест-смузі або ≥10 еритроцитів/поле високої потужності;
- кількість тромбоцитів <100 000/мм3;
- гемоліз (підтверджується шистоцитами, фрагментами еритроцитів у мазку периферичної крові та підвищеною кількістю ретикулоцитів);
- гіпертонічна енцефалопатія.
Профілактика СРК базується на уникненні використання високих доз кортикостероїдів і вазоконстрикторів при ССД. Терапія SRC була нещодавно переглянута та зосереджена на ранній діагностиці SRC, негайному застосуванні інгібіторів ангіотензинперетворювального ферменту, діалізі, плазмообміні та інших підтримуючих заходах, включаючи екулізумаб або блокування ендотеліну-1 у повністю резистентних випадках, в очікуванні того, що функція нирок відновиться.
Біомаркери SRC включають гіпертензію, підвищений рівень сечової кислоти, знижену функцію нирок, тромбоцитопенію, гемолітичну анемію та підвищений рівень сироватково-розчинних CD147 і CD163, реніну, лектину, що зв’язує манозу (MBL), ендотеліну-1, розчинних молекул судинної адгезії, E-селектину, ліпокаліну -2, ангіогенін, апелін, хемерин, компоненти комплементу та рівні NT-proBNP. Було показано, що розчинний у сироватці крові CD147 (sCD147), інгібітор металопротеїнази ECM, і CD163 (sCD163), багатий цистеїном рецептор-акцептор, були підвищені у пацієнтів із SRC. Подібним чином, підвищені рівні ендотеліну-1 і носійство рецепторів ендотеліну асоціюються з SRC. Подібним чином, розчинні молекули судинної адгезії (VCAM-1) і розчинний E-селектин були пов’язані з SRC. NT-proBNP є корисним біомаркером для SRC і прогнозує потребу в діалізі та нирковий результат.
Антитіла проти фібриларину, антитіла проти РНК-полімерази III та спекл-паттерн ANA найбільш тісно пов’язані з розвитком SRC; однак у деяких популяціях антитіла до топоізомерази також асоціювалися з високою частотою SRC. Антифосфоліпідні антитіла, зокрема антифосфоліпідні антитіла IgG, є суттєвим фактором ризику захворювання нирок у СС у порівнянні з пацієнтами з негативними антитілами. Аутоантитіла до метіонінсульфоксидредуктази А, важливого ферменту в антиоксидантних шляхах, пов’язані з розвитком ниркових і серцевих захворювань при ССД.
Незважаючи на те, що ренін підвищений у SRC і має центральне значення для патології та лікування SRC, він не є прогностичним фактором SRC, оскільки він часто підвищений у пацієнтів з ССД без SRC. Підвищений рівень сечової кислоти в сироватці крові, пуринового метаболіту, може бути пов’язаний із запаленням, ендотеліальною дисфункцією та дисфункцією нирок. Gigante та інші продемонстрували при ССД, що сечова кислота суттєво пов’язана з сироватковим креатиніном, резистентністю ниркової артерії та зниженням швидкості гломерулофільтрації (GFR), а також багатосудинним пошкодженням у ССД. Подібним чином, невпорядковані рівні проангіогенних молекул та інгібіторів ангіогенезу були пов’язані з прогресуванням мікросудинного пошкодження нирок, дефектним відновленням судин і фіброзом у ССД. Зокрема, було виявлено, що рівні ендостатину, інгібітора ангіогенезу, підвищені при захворюваннях нирок при ССД, і це пов’язано зі зниженням ШКФ, підвищеним резистентністю ниркової артерії та прогресуванням периферичного мікросудинного захворювання. Високі рівні як ангіогеніну, так і ліпокаліну-2 пов’язані зі зниженою ШКФ і можуть бути залучені до патогенезу SRC. Апелін і хемерин є адипокінами, які зв’язуються з рецепторами на ендотеліальних клітинах і підвищуються в SRC. Схоже, що система комплементу також бере участь у SRC, з вищими рівнями C4d і нижчими рівнями C3bBbP і розчинного кінцевого комплексу комплементу (sTCC) у пацієнтів з ССД із SRC порівняно з без SRC.
Висновок
Сфера біомаркерів у ССД продовжує розширюватися за обсягом і складністю. Величезна кількість молекул, шляхів і рецепторів, залучених до патології ССД, відображає багато складностей і нюансів захворювання. Тирозинкіназа, передача сигналів інтерферону-1, передача сигналів IL-6, ендогенний тромбін, рецептори, що активуються проліфератором пероксисом (PPAR), лізофосфатидна кислота та рецептори, а також метаболіти амінокислот — усе це забезпечило нові біомаркери та потенціал для нових терапевтичних засобів. Оскільки в ССД-ІЗЛ активовано кілька гілок імунної системи та механізмів загоєння, і існує багато кандидатів на біомаркери та потенційні терапевтичні цілі, тенденцією є використання панелей біомаркерів із комбінованим комплексним багатофакторним аналізом, машинним навчанням і штучним інтелектом для визначити активність захворювання та відповідь на терапію. Ймовірно, біомаркери будуть набувати все більшого значення для досліджень, а також для діагностики та терапевтичних підходів до ССД та пов’язаних з ним проявів захворювання.
ДЖЕРЕЛО: https://www.ncbi.nlm.nih.gov/
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Підтримуйте свою практику ефективною: ось ...

Першого пацієнта вилікували від серповидно ...

Споживання оливкової олії пов'язане зі зни ...

Пневмонія: класифікація, епідеміологія, фа ...

Клінічне завдання. Двоїння в очах. Діагнос ...
Ультразвук м’язів: новий інструмент для ра ...


