Штучний інтелект у діагностиці патології
Дата публікації: 12.10.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: діагностика, гістологія, штучний інтелект, ШІ, візуалізація

Віхи та знакові випробування в обчислювальній патології
1950: Алан Тюрінг задумав використовувати комп’ютери для імітації розумної поведінки та критичного мислення.
1956: Джон Маккарті ввів термін штучний інтелект (AI).
1959: Артур Самуель ввів термін машинне навчання (ML) як «здатність навчатися без явного програмування».
1960 : Превітт і Мендельсон сканували зображення з мазка крові та повідомили про метод перетворення оптичних даних у значення оптичної щільності.
1965: Комп’ютеризований аналіз мікроскопічних зображень клітин і хромосом Джудіт Превітт і Мортімер Мендельсон.
1986: Термін глибоке навчання (DL), створений Ріною Дехтер.
1988: Згорточна нейронна мережа (CNN), винайдена Янном Лекуном.
1990: представлені сканери повних слайдів.
1998 : Tripath стає першою компанією з автоматизованим продуктом для скринінгу мазка ПАП, який отримав схвалення FDA.
2003 : Cytyc отримав схвалення FDA для своєї системи обробки зображень ThinPrep.
2013: Розробка техніки фотоакустичної мікроскопії.
2014: Ян Гудфеллоу представив генеративну змагальну мережу.
2016: Техніка мікроскопії MUSE винайдена для отримання зображень з високою роздільною здатністю без використання тканин.
2017: Philips отримує схвалення на рішення для цифрового сканування патологічних слайдів (IntelliSite).
2018: FDA дозволило перший медичний пристрій, що використовує ШІ для виявлення діабетичної ретинопатії у дорослих (IDx DR).
2021: FDA дозволило перше програмне забезпечення на основі штучного інтелекту для виявлення раку простати (Paige Prostate).
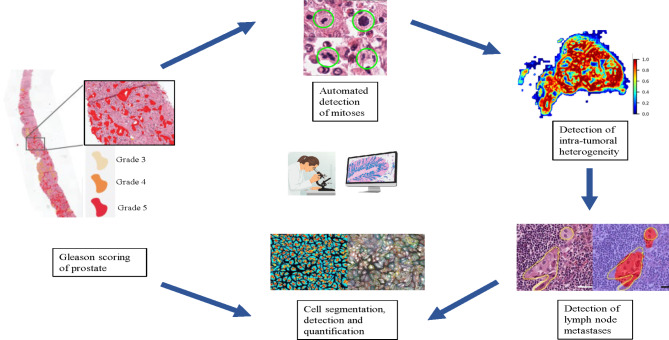
Впровадження інструментів ШІ в практику клінічної патології
Застосування ШІ в діагностиці
Нещодавно багатообіцяючі успіхи в ШІ відкрили нові можливості для суттєвої зміни способу діагностики та класифікації раку. Було досягнуто кількох успіхів у впровадженні інструментів штучного інтелекту в діагностичний робочий процес у патологічній практиці. Підходи штучного інтелекту використовувалися в різноманітних завданнях, таких як розпізнавання об’єктів, виявлення та сегментація. WSI можна використовувати для виділення кількох ознак за допомогою алгоритмів комп’ютерного зору, що дозволяє робити діагностичні прогнози. Декілька інструментів штучного інтелекту все частіше використовуються для надання інформації, яку патологоанатому важко ідентифікувати. Приклади включають точну об’єктивну оцінку імуногістохімічних біомаркерів, таких як Ki67, PD-L1, кількісне визначення клітин, оцінку просторового розташування клітин, експресії, щільності та характеру розподілу. AI також можна використовувати для виявлення ізольованих пухлинних клітин у лімфатичних вузлах, підозрілих на метастатичну карциному, підвищуючи чутливість виявлення в економний час. Крім того, інструменти штучного інтелекту можуть допомогти стандартизувати критерії оцінки для кількох пухлин, наприклад оцінку за Глісоном для раку передміхурової залози або класифікацію раку молочної залози, де морфологічні ознаки представлені в спектрі безперервного біологічного процесу. Іншим вражаючим застосуванням інструментів пошуку штучного інтелекту є пошук зображень на основі вмісту (CBIR), який дозволяє патологам шукати зображення, схожі на відповідне зображення, у сховищі великої бази даних гістопатології. Це особливо важливо для того, щоб допомогти патологоанатомам діагностувати рідкісні та складні випадки, з якими вони час від часу можуть стикатися у своїй клінічній практиці. Зображення, отримані з бази даних, відображають схожість пов’язаних гістопатологічних особливостей, а не просто подібність зображень.
Діагностичні алгоритми можуть бути включені в робочий процес цифрової патології як незалежні алгоритми звітності, як інструменти для діагностики та як автоматизовані кількісні показники конкретних ознак. Незалежні алгоритми звітності можуть забезпечувати діагностику та автоматизовані звіти без будь-яких втручань з боку патологоанатомів. Алгоритми скринінгу можуть ідентифікувати нормальні тканини, такі як товста кишка, шлунок, молочна залоза тощо з біопсії. Однак важливо враховувати широкий спектр нормальних тканин під час розробки алгоритму, щоб уникнути пропуску рідкісних мікроуражень (таких як доброякісні імітації раку) або вогнищевих уражень, які є рідкісними варіантами раку. Допоміжні інструменти діагностики включають алгоритми, які оцінюють одну з різних гістологічних особливостей, таких як ступінь пухлини, тип і ступінь. Точні патологічні діагнози передбачають оцінку та поєднання багатьох ознак навченим людським оком. Корисність цих алгоритмів штучного інтелекту визначається простотою їх включення в діагностичний робочий процес і доданою цінністю, яку вони приносять у діагнози патологів. Це можна оцінити на основі оцінених характеристик і часу, необхідного для отримання результатів, а також на його точності. Наприклад, алгоритми класифікації раку молочної залози мають потенційну перевагу об’єктивності, надійності між читачами та прогностичної ясності порівняно з варіабельністю між спостерігачами, яка спостерігається в клінічній практиці. Отже, у цьому випадку додаткова цінність такого алгоритму ШІ буде кращою відтворюваністю, а не ефективністю. Корисність цих алгоритмів штучного інтелекту визначається простотою їх включення в діагностичний робочий процес і доданою цінністю, яку вони приносять у діагнози патологів. Це можна оцінити на основі оцінених характеристик і часу, необхідного для отримання результатів, а також на його точності. Наприклад, алгоритми класифікації раку молочної залози мають потенційну перевагу об’єктивності, надійності між читачами та прогностичної ясності порівняно з варіабельністю між спостерігачами, яка спостерігається в клінічній практиці. Отже, у цьому випадку додаткова цінність такого алгоритму ШІ буде кращою відтворюваністю, а не ефективністю [ Корисність цих алгоритмів штучного інтелекту визначається простотою їх включення в діагностичний робочий процес і доданою цінністю, яку вони приносять у діагнози патологів. Це можна оцінити на основі оцінених характеристик і часу, необхідного для отримання результатів, а також на його точності. Наприклад, алгоритми класифікації раку молочної залози мають потенційну перевагу об’єктивності, надійності між читачами та прогностичної ясності порівняно з варіабельністю між спостерігачами, яка спостерігається в клінічній практиці. Отже, у цьому випадку додаткова цінність такого алгоритму ШІ буде кращою відтворюваністю, а не ефективністю. Алгоритми класифікації раку молочної залози мають потенційну перевагу об’єктивності, надійності між читачами та прогностичної ясності порівняно з варіабельністю між спостерігачами, яка спостерігається в клінічній практиці. Отже, у цьому випадку додаткова цінність такого алгоритму ШІ буде кращою відтворюваністю, а не ефективністю. Тому важливо не просто використовувати алгоритми ШІ, а використовувати його розумно. Наприклад, для виявлення метастазів у лімфатичних вузлах штучний інтелект може мати чудову ефективність, слугуючи допоміжним інструментом для патолога, підкреслюючи важливість контексту передбачуваного клінічного використання. Автоматизоване кількісне визначення імуногістохімічних маркерів викликало значний інтерес, оскільки докладається все більше зусиль, щоб не тільки забезпечити об’єктивну оцінку цих маркерів, але й дати оцінку їх прогнозної та прогностичної цінності. Хоча ручна оцінка рецепторів раку молочної залози може зайняти лише кілька хвилин досвідченим патологом, її можна зробити більш ефективною та відтворюваною за допомогою автоматизованого методу.

Багато платформ аналізу цифрових зображень (DIA) були прийняті для допомоги патологоанатомам в оцінках, особливо для кількісних оцінок біомаркерів. Серед перших відкритих інструментів для аналізу зображень був ImageJ, розроблений у 1997 році Національним інститутом здоров’я (Бетесда, Меріленд, США). У 2006 році було опубліковано програмне забезпечення CellProfiler, яке забезпечувало керовану класифікацію на основі машинного навчання для діагностики на основі зображень. Іншою доступною платформою, яка все частіше використовується для аналізу зображень, є QuPath, вперше опублікована у 2017 році. Програмне забезпечення функціонує для забезпечення неконтрольованого машинного навчання виявлення клітин і контрольованої класифікації цілих зображень слайдів, ідентифікації пухлин і кількісної оцінки біомаркерів. Програмне забезпечення Ventana Companion Algorithm для аналізу зображень отримало схвалення від CE та US IVD для аналізів Roche IHC при раку молочної залози для оцінки біомаркерів молочної залози (ER, PR, HER2, Ki67 та p53). Програмне забезпечення Tissue Phenomics було створено AstraZeneca у 2014 і застосовано до клінічних програм в імунній онкології для ідентифікації біомаркерів. HALO (Indica laboratories) розробила модулі для кількісного імунофлуоресцентного аналізу переважно для дослідницьких цілей. Оцінка Ki67, ER, PR, CD3/4/8/15/20 і TIL стала можливою за допомогою платформи Cognition Master Professional Suite, розробленої VMscope. QuantCenter, структура для програм аналізу зображень 3DHISTECH, надає модулі для класифікації тканин, кількісного визначення IHC і молекулярної патології. Швидка поява цифрових рішень для аналізу зображень та інтегрованих платформ призвела до необхідності перевірки та стандартизації цих інструментів, перш ніж їх можна буде затвердити в діагностичних налаштуваннях.
Знаковим дослідженням у галузі комп’ютерної патології є виклик CAMYLEON16, перший великий виклик комп’ютерної діагностики в гістопатології з використанням повних зображень слайдів. H&E зображення сторожових лімфатичних вузлів пацієнтів з раком молочної залози використовували з метою ідентифікації метастазів. Без обмежень у часі алгоритми DL продемонстрували порівняну ефективність із патологоанатомом у виявленні мікрометастазів. Для симуляції клінічної практики було встановлено часове обмеження, яке продемонструвало перевищення ефективності алгоритму над оцінкою вручну 11 патологами. Диференціація між доброякісними та злоякісними пухлинами стала можливою за допомогою контрольованої моделі МЛ, навченої на повних зображеннях слайдів, отриманих за допомогою тонкоголкової біопсії. Вета та ін. підкреслили прогностичну цінність таких ознак, як форма або текстура ядра пухлин молочної залози у чоловіків за допомогою тканинного мікрочіпа (TMA). У своєму дослідженні Лі та ін. використовували WSI від раку передміхурової залози, щоб описати особливість кутастості залози (GAF), яка була пов’язана зі ступенем безладу залозистої архітектури. GAF продемонстрував високий зв’язок із прогресуючими стадіями раку простати. Ядерний плеоморфізм, орієнтація та архітектура були використані для розробки ручних функцій у пухлині та мікрооточенні доброякісної пухлини. Ці характеристики, використані в тандемі з моделлю ML, були розроблені для прогнозування ймовірності рецидиву протягом 5 років післяопераційного періоду. Подібним чином, варіації форми та текстури ядра використовувалися в плоскоклітинних карциномах порожнини рота, щоб розділити пацієнтів на категорії ризику для прогнозування виживання без захворювання (DFS). Крім того, було з’ясовано, що пацієнти з раком молочної залози з позитивним рецептором естрогену (ER) з короткостроковим виживанням (< 10 років) можуть відрязнятися від пацієнтів з довгостроковим виживанням (> 10 років) на основі комбінації форми та орієнтації ядра. особливості.
Ще однією важливою частиною в галузі DP/AI став виклик PANDA, найбільший на сьогодні конкурс гістопатології. Майже 1290 розробників взялися за руки та використали 10 616 оцифрованих біопсій простати для розробки алгоритмів штучного інтелекту для оцінки за Глісоном. Надані алгоритми були обрані на основі досягнутого рівня точності в порівнянні з патологоанатомом у незалежних міжконтинентальних когортах. У американських і європейських наборах зовнішньої валідації алгоритми досягли узгодженості 0,862 (квадратично зважений κ, 95% довірчий інтервал (ДІ), 0,840–0,884) та 0,868 (95% ДІ, 0,835–0,900) з експертами-уропатологами. Однак для клінічного застосування цих алгоритмів у різних популяціях пацієнтів, лабораторіях і еталонних стандартах необхідні проспективні клінічні випробування, що оцінюють оцінку Глісона на основі ШІ.
На сьогодні найбільш широко використовуваними алгоритмами DL в патологічних додатках є згорткові нейронні мережі (CNN). Визначена як тип глибокої прямої мережі, CNN складається з кількох послідовних шарів (згорткових аркушів), які можуть обчислювати вихід із вхідних даних (наприклад, зображення), шляхом ієрархічного деконструювання зображення на сигнали низького рівня. Агрегація цих ознак низького рівня, таких як грані, криві або форми, призводить до побудови структури високого порядку для ідентифікації цікавих особливостей. Раухо та ін. використовували CNN для класифікації WSI раку молочної залози на доброякісний, злоякісний, in situ або інвазивний. Також було показано, що CNN має результативність, порівнянну з дерматопатологами, у відрізненні доброякісних уражень, таких як себорейний кератоз від кератиноцитарної карциноми та доброякісних невусів від злоякісної меланоми. Tschandl та ін. продемонстрували, що CNN має таку ж діагностичну точність, як і люди, у правильній класифікації пігментованих уражень шкіри за допомогою цифрових дерматоскопічних зображень. Ці висновки, серед іншого, встановили роль методів на основі ШІ в діагностичній практиці.
Передбачливі та прогностичні застосування ШІ
ШІ можна використовувати для прогнозування прогнозу та терапевтичних відповідей на основі гістологічних особливостей. Безпосередній зв’язок зображень із декількома особливостями пухлини, навколишнім мікрооточенням і генетичними профілями з результатами виживання та відповіддю на лікування для ад’ювантної/неад’ювантної терапії може надати важливу інформацію в стислій формі. Інтеграція безлічі морфологічних особливостей, таких як гістологічні моделі пухлини та моделі мікрооточення пухлини, в єдиний прогностичний індекс може бути складним для людей. Однак інструменти штучного інтелекту на основі зображень можуть надати нову систему класифікації, що відображає клінічний результат, ймовірність рецидиву або метастазів і терапевтичну відповідь шляхом кореляції важливих гістологічних особливостей, таких як морфологія пухлини, архітектура строми, текстура ядра та лімфо-судинна інвазія тощо. Прогнозування Клінічні результати з використанням графічних підходів для оцінки архітектурної організації та просторової конфігурації різних типів тканин викликали значний інтерес. Wang та ін. вивчав модель ML, використовуючи орієнтацію ядра, форму ядра, текстуру та архітектуру пухлини, щоб передбачити рецидив ранньої стадії недрібноклітинного раку легенів (НДРЛ).
Прогностичні наслідки інструментів на основі штучного інтелекту також були висвітлені у 2018 році Saltz та ін. які використовували згорткову нейронну мережу (CNN) для посилення зворотного зв’язку патологоанатома для автоматичного виявлення просторової організації лімфоцитів, що інфільтрують пухлину (TIL) на зображеннях з Атласу геному раку. Їх результати показали, що ця особливість є прогностичною для результатів у 13 підтипах раку. Подібне дослідження, проведене Yuan et al. описав модель для аналізу просторового розподілу лімфоцитів відносно пухлинних клітин на тричі негативних WSI раку молочної залози. Вони не лише ідентифікували три різні категорії лімфоцитів, а й виявили прямий зв’язок між пізнім рецидивом та просторовим розподілом імунних клітин в ER-позитивних раках молочної залози. CNN також застосував TMA раку молочної залози для гістологічної та молекулярної характеристики. Автоматизоване виявлення мітотичних фігур у WSI раку молочної залози за допомогою CNN виявило значну різницю між високим і низьким ризиком рецидиву захворювання, визначеним онкотипом DX. Подібне прогностичне дослідження колоректального раку з використанням підходів на основі CNN було виконано Geessink та ін. Використовуючи визначені патологом «гарячі точки строми», CNN увімкнула кількісне визначення «від пухлини до строми» як незалежно прогностичне для виживання без захворювання.
Фундаментальне мультиінституційне дослідження, опубліковане Beck et al використовувало приголомшливу кількість морфологічних і просторових характеристик (6642) для навчання прогностичної моделі раку молочної залози та продемонструвало, що ці особливості пов’язані із загальним виживанням (ЗВ). Подібне дослідження раку ротоглотки, позитивного на вірус папіломи людини, показало, що поєднання ядерних особливостей стромального та епітеліального відділів дозволяє передбачити ймовірність прогресування цих видів раку. Пов’язане дослідження раку передміхурової залози вказало на потребу в популяційно-специфічних особливостях при розробці моделей, оскільки значні відмінності в ядерних особливостях стромального відділу були відзначені між європеоїдними та африканськими когортами. Важливість таких популяційно-специфічних моделей також була підкреслена більшою точністю під час розрахунку рецидивів у верифікаційній когорті афроамериканського населення за допомогою алгоритму, вивченого в когорті подібної расової демографії, порівняно з тим, що вивчений у змішаному населенні.
ШІ як предиктор молекулярного та геномного профілю
Останні досягнення передбачають використання зображень H&E для прогнозування генетичних змін за допомогою алгоритмів глибокого навчання. Інструменти штучного інтелекту можна використовувати для отримання інформації про генетику/геномні профілі пухлини з морфології та, таким чином, допомагають зрозуміти біологію раку. Молекулярне тестування для прогностичних цілей, яке включає інформацію з багатьох параметрів, вже доступне, наприклад, тест онкотипу на основі мРНК. Шаумберг та ін. розробили модель для прогнозування мутаційного статусу білка POZ спекл-типу (SPOP) при раку передміхурової залози, яка показала площу під кривою AUC 0,74 й AUC 0,86 у двох незалежних когортах. Подібні спроби були зроблені для прогнозування генів, що зазвичай мутують, в інших види пухлин. Coudray та ін. вдалося створити модель CNN, яка могла б передбачати мутації в KRAS, EGFR, TP53, FAT1, STK11 і SETBP1 з високою точністю (AUC між 0,733 і 0,856). Подібні підходи були використані для отримання інформації щодо нестабільності мікросупутників із зображень H&E при колоректальному раку та раку шлунка. В одному такому дослідженні Кетер і його колеги використовували підхід глибокого вивчення для з’ясування мікросупутникової нестабільності в загальній кількості 1616 зображень H&E як заморожених, так і фіксованих у формаліні зразків з високою точністю (AUC від 0,69 до 0,84 у п’яти когортах).
Хоча ідентифікація зв’язку між морфологічними моделями та генетикою пухлини здається простою, інтеграція великих обсягів геномних даних, таких як секвенування наступного покоління (NGS), може бути складною. Дослідження, що підкреслюють вплив поєднання даних NGS з іншими функціями, виправдані перед впровадженням таких алгоритмів у клінічну діагностичну практику. Що ще більше ускладнює картину, так це відсутність глибоких знань про взаємодію між зображеннями та геномними особливостями. Хоча інтеграція візуалізації та молекулярних характеристик може забезпечити повне уявлення про окремі пухлини, однак розробка, навчання та валідація моделей, здатних працювати з такими складними багатовимірними даними, залишається проблемою.
Користь штучного інтелекту в дослідженнях, навчанні та освіті
Інструменти штучного інтелекту надають важливі інструменти для покращення навчання патологів, надають корисні анотації та інші інтерактивні функції для створення динамічного навчального середовища для слухачів. Це може допомогти об’єднати глибокі знання морфології з використанням нових підходів і передових технологій, щоб забезпечити практику високоякісної персоналізованої та точної медицини. Зображення повного слайда вже використовується для навчання на конференціях, віртуальних семінарах, презентаціях і дошках пухлин. Медичний центр Векснера Університету штату Огайо включив використання «цифрової кабіни» для повністю цифрового входу. Мешканці регулярно переглядають цифрові слайди за допомогою інтегрованої системи керування Philips (IMS). Інструменти анотацій дозволяють переглядати, панорамувати та масштабувати розширені цифрові слайди, оточуючи цікаві регіони, включно з окремою коміркою, що розглядається, таким чином створюючи більш інтерактивний інтерфейс навчання. Клінічні та дослідницькі реєстри, бази даних на основі органів, наша унікальна лабораторна інформаційна система (LIS), а також шаблони синоптичних звітів є чудовими прикладами інструментів, керованих біоінформатикою, які використовуються в повсякденній практиці патології. Університет також використовує кілька своїх додаткових компонентів для інтеграції WSI в LIS. Використання інструментів Visopharm AI дозволяє швидко виявити ізольовані метастази пухлинних клітин у лімфовузлах у складних випадках. Інтеграція таких інструментів штучного інтелекту в щоденний робочий процес виходу може доповнити ключову інформацію для слухачів, щоб створити список диференціальної діагностики та потенційних допоміжних тестів, які згодом можна замовити, таким чином відточуючи свої діагностичні навички. Він також надає відповідні освітні ресурси, які потенційно можуть покращити навчання резидентів. Такі освітні моделі можуть доповнювати звичайні освітні процеси, що пропонуються патологоанатомами, і можуть бути прийняті іншими установами. Це не тільки покращило внутрішнє навчання та міжспеціальностні консультації.
Роль ШІ у відкритті та розробці ліків
За останні кілька років інгібітори імунних контрольних точок (ICI) призвели до зміни парадигми лікування різних видів раку. Однак багато пацієнтів, які отримують ICI, не реагують на цю терапію, і це призвело до потенційної необхідності поєднання ШІ з цифровою патологією для стратифікації пацієнтів на основі ймовірної терапевтичної користі. Дослідження стратифікації ризику рецидиву ранніх стадій недрібноклітинного раку легенів (НМРЛ) на основі ядерних і перинуклеарних особливостей (форми, орієнтації та просторового розташування) було проведено Вангом та його колегами. Пацієнти високого ризику були потенційними кандидатами на ад’ювантну хімієтерапію. Інструменти штучного інтелекту, такі як підходи ML, створені вручну, також можна використовувати для прогнозування терапевтичної відповіді на цільові агенти, ICI та хімієтерапевтичні препарати. Одне з таких досліджень Wang et al. описали прогнозування відповіді на антитіло до рівнялумабу проти програмованої клітинної смерті 1 (PD-1) у пізніх стадіях НМРЛ з використанням просторової орієнтації ядер і TIL.
Перевірка алгоритмів і переобладнання
Алгоритми штучного інтелекту потребують суворої перевірки між установами, перш ніж їх можна буде впровадити в клінічну практику. Це зазвичай вимагає застосування алгоритмічного підходу/моделі на наборі виявлення навчання/навчання з подальшим підтвердженням результатів на наборі перевірки. Поточні алгоритми штучного інтелекту в основному створені на невеликих даних і зображеннях з одного центру, доповнених випадковим обертанням і перевертанням, коливанням кольорів і розмиттям за Гаусом. Навчальний набір має бути добре збалансованим з точки зору рівномірного представництва всіх категорій інтересів. Після того, як алгоритм навчено після кількох ітерацій на наборі даних виявлення, подальша оптимізація виконується на наборі даних перевірки. Цей процес може бути досить трудомістким і складним, а отримання відповідних наборів даних/когорт може бути громіздким. У дослідженні, проведеному Zech et al. було показано, що алгоритм CNN для виявлення пневмонії працював значно гірше, коли його навчали з використанням даних однієї установи та перевіряли незалежно з використанням даних двох інших установ, ніж коли його навчали з використанням даних усіх трьох установ, тим самим підкреслюючи потребу в надійній перевірці алгоритмів штучного інтелекту з використанням даних багатьох установ перед клінічним впровадженням. «Переобладнання» — це коли алгоритми ШІ, навчені на одному наборі даних, мають обмежену застосовність до інших наборів даних. Може бути важко знайти добре підібрані точні довідникові набори даних WSI для підтипів раку з анотованими раковими областями для стандартизації алгоритмів. Крім того, під час застосування цих інструментів штучного інтелекту слід враховувати відмінності в преаналітичних і аналітичних факторах, таких як методи підготовки слайдів, моделі сканерів і процеси оцифровки, між різними центрами. Щоб забезпечити узагальненість і надійність алгоритмів штучного інтелекту, необхідно регулярно перевіряти якість і стандартизувати. Це вимагає розробки великих баз даних і репозиторіїв анотованих WSI, перевірених, виправлених і оновлених командою експертів-патологів.
Інтерпретованість і проблема «чорного ящика».
Проблема «чорного ящика» полягає в нездатності алгоритмів глибокого навчання продемонструвати, як вони приходять до своїх висновків. Незважаючи на очевидні переваги точності та ефективності, глибокі нейронні мережі стикаються з гострою критикою через відсутність інтерпретації, що створює величезну перешкоду для клінічного впровадження. Кілька досліджень, спрямованих на подолання цього скепсису, використовували post hoc методи для комплексного аналізу результатів алгоритмів ШІ. Проте ретельний аналіз методів глибокого навчання здається зайвим, оскільки додаткові моделі не повинні вимагати, щоб пояснити, як працює модель ШІ. Завдяки їх розробці спільно з експертами в галузі, створені вручну підходи штучного інтелекту пропонують перевагу кращої інтерпретації. Щоб підвищити можливість інтерпретації, дослідники інтегрували алгоритми DL і розроблені вручну підходи ML, щоб створити підходи «злиття». Хай там що, розробка обох цих методів є складною та трудомісткою, а також вимагає участі як онкологів, так і патологів. Один із таких методів «злиття» для прогнозування рецидиву захворювання був описаний Wang та ін. які використовували підхід DL для ядерної сегментації на H&E зображеннях НДКРЛ із подальшим застосуванням ручного методу на основі форми та текстури ядра. Майбутні стратегії виправдані для підвищення інтерпретації алгоритмів штучного інтелекту, перш ніж їх можна буде впевнено використовувати в клінічних умовах.
Якість даних
Для оптимальної ефективності підходів на основі ШІ дуже важливо, щоб вхідні дані були оптимальної якості та кількості. Найвища точність прогнозування досягається, коли навчальні дані мають оптимальне співвідношення сигнал/шум, добре підібрані та повні. Важливість високоякісних даних підкреслюється в роботі Doyle et al. який використовував інструмент штучного інтелекту для автоматичного виявлення раку передміхурової залози в WSI. Збільшення призвело до зниження загальної продуктивності моделі через втрату деталізації при збільшенні роздільної здатності. Більшість існуючих слайд-сканерів мають максимальну здатність сканувати ×40. У той час як зображення з вищою роздільною здатністю (> × 20) можна зменшити для використання алгоритмом, навченим на роздільній здатності × 20, можлива значна втрата точності даних із використанням підходу AI, розробленого на × 40, коли максимальна роздільна здатність сканування в наявності ×20. Таким чином, забезпечення точності даних є надзвичайно важливим для стандартизації оцінки продуктивності алгоритмів ШІ.
Обчислювальна система, зберігання даних і співвідношення витрат і вигод
Важливо мати потужне апаратне забезпечення з високими специфікаціями для обробки та аналізу зображень, а також достатнє масштабоване сховище даних для зберігання цих файлів великого розміру (приблизно в 1000 разів більше, ніж рентгенівський знімок). Придбання хмарних платформ зберігання може бути дорогим, а також матиме проблеми з величезною пропускною здатністю, необхідною для передачі зображень WSI розміром гігапікселя в хмари даних. Крім того, хмарне сховище вимагає безперебійного швидкого зв’язку Wi-Fi між кінцевими користувачами та хмарою. Загальне впровадження 5G підвищить швидкість і вирішить деякі з цих труднощів у майбутньому. Вартість придбання, впровадження та експлуатаційні витрати ШІ можуть бути обмежуючим фактором, особливо для невеликих лабораторій. Висока початкова вартість сканерів та додаткові приховані витрати на навчання персоналу та патологоанатомів, технічну підтримку, системи зберігання цифрових слайдів, а також понесені нормативні або ліцензійні витрати можуть бути непомірними для впровадження ШІ в клінічній практиці. Іншим аспектом вартості є надійна ІТ-підтримка телепатології. Дослідження показало, що аналіз витрат і вигод у великому академічному центрі зі слайдами понад 1,5 мільйона прогнозує економію 1,3 мільйона доларів США за 5-річний період. Перш ніж можна буде зробити будь-які значущі висновки, необхідно провести дослідження ефективності в умовах обмежених ресурсів і невеликих патологічних лабораторій. На відміну від радіології, де цифрові системи усувають потребу у створенні плівок, WSI в патології не зменшує навантаження на лабораторію, оскільки предметні скла все ще потрібно підготувати до сканування, що викликає занепокоєння щодо виправданості цього додаткового кроку.
Технологічні питання
Сканування всього предметного скла є трудомістким і трудомістким процесом із змінним часом сканування від 1 до 5 хвилин для невеликої біопсії, 5–20 хвилин для хірургічного зразка та 3–5 хвилин для рідкого цитологічного мазка. Крім того, більшість сучасних сканерів вимагають великої місткості для зберігання даних із 1 мм 2 при збільшенні × 40, що призводить до розміру файлу 48 мегабайтів! Щоб подолати це, більшість платформ WSI вдаються до алгоритмів стиснення зображень (JPEG, JPEG 2000, LZW), щоб значно зменшити розмір. Недоліком цього стиснення є введення артефактів зображення, які можуть погіршити загальну якість пікселів.
Регулювання, відшкодування та клінічне прийняття
Перш ніж алгоритм штучного інтелекту можна буде використовувати в клінічних умовах, важливо отримати дозвіл від регуляторних органів. Щоб отримати схвалення, необхідно надати чіткий опис того, як працює програмне забезпечення, особливо для алгоритмічних підходів на основі DL, які сприймаються як «чорна скринька», якій бракує інтерпретації. Залежно від країни Управління з контролю за харчовими продуктами та ліками (FDA), Європейське агентство з лікарських засобів (EMA) та інші регуляторні органи встановлюють суворі вказівки та рамки для забезпечення наукової точності звітних показників. Схвалення FDA щодо медичних пристроїв базується на системі трьох класів: пристрої класу I мають найменший ризик, а пристрої класу III вважаються найвищими. Моделі на основі штучного інтелекту належать до класу II або III, а клас III вимагає суворого попереднього схвалення. Шлях схвалення 510(k) і шлях De Novo є іншими способами отримати схвалення алгоритмів ШІ. Хай там як, процес дуже суворий і комплексний. У 2017 році компанія Phillips отримала схвалення De Novo для впровадження рішення для патології IntelliSite. За цим послідувало схвалення PAIGE.AI FDA як передового пристрою в 2019 році. Цікаво, що для OncotypeDX для лікування раку молочної залози не було запитувано схвалення FDA, оскільки це був сертифікований центральний тест-аналіз Clinical Laboratory Improvement Amendments (CLIA). Розроблені в лабораторії тести (LDT) зазвичай складні, і через проблему «чорної скриньки» Колегія американських патологів (CAP) вимагала більш суворих правил FDA щодо таких прогностичних і прогнозних тестів з високим ризиком. Наразі не існує спеціальних кодів процедур для використання підходів штучного інтелекту в цифровій патології з діагностичними чи прогностичними цілями. Після того, як інструменти штучного інтелекту отримають схвалення FDA, необхідно буде встановити нові коди процедур для виставлення рахунків пацієнтам. CAP, співпрацюючи з редакційною комісією CPT Американської медичної асоціації (AMA), успішно виступила за включення 13 нових цифрових додаткових кодів патології, які набули чинності 1 січня 2023 року. Нові коди були прийняті для Cat III – Digital Pathology : 0751T до 0763T. Ці нові цифрові патологічні коди CPT будуть використовуватися для звітування про додаткову роботу клінічного персоналу та вимоги до обслуговування, пов’язані з оцифруванням предметних стекол мікроскопа для первинної діагностики.
Дилема патологів – використовувати чи не використовувати
Основною перешкодою для впровадження ШІ в клінічну практику є побоювання щодо зміни робочого процесу. Частково це пов’язано з відсутністю інтерпретації, а частково через дещо незрозуміле питання про порогові значення продуктивності алгоритмів ШІ. Хоча є докази зниження частоти помилок і покращення продуктивності за допомогою комбінації прогнозів на основі DL-моделі з діагнозами патологоанатомів, повна заміна людської оцінки машинною оцінкою сприймається значним цинізмом. Дослідження, опубліковане Вангом, показало, що комбінований підхід може зменшити людські помилки на 85% для виявлення метастазів раку молочної залози в дозорних вузлах. Інше важливе питання, яке необхідно вирішити, полягає в тому, чи є фактичне зменшення загального часу Зменшення здатності безпосередньо контролювати діагностичний робочий процес і відсутність ясності щодо обсягу відповідальності, покладеної на патологоанатомів під час звітування за допомогою штучного інтелекту, є деякими практичними проблемами, які необхідно вирішити, перш ніж значуща співпраця людини й машини може відбутися в клінічних умовах.
Майбутні напрямки та можливості
За останні кілька років відбулося збільшення розробок інструментів ШІ для виявлення раку різними компаніями, такими як Visiopharm, Halo, Proscia, DeepLens, Inspirata та PAIGE.AI. З них Inspirata та PAIGE.AI беруть активну участь у створенні великих репозиторіїв WSI для навчання DL-алгоритмів. Схвалення FDA сканера повного слайда Philips у 2017 році стало переломним моментом на шляху до оцифровки клінічного робочого процесу. Виклики, пов’язані з пандемією COVID-19, змусили до впровадження цифрового робочого процесу в повсякденну клінічну практику в деяких установах, у тому числі в нашому Медичному центрі Університету штату Огайо Векснера. Незважаючи на безліч проблем і перешкод у прийнятті цифрового робочого процесу, насиченого інструментами ШІ, відбулася зміна парадигми в ландшафті цифрової патології. Поява світлової мікроскопії з відкритим верхом, яка генерує неруйнівні тривимірні (3D) зображення тканин без слайдів, може забезпечити значно більший рівень просторової та архітектурної інформації, необхідної для застосування підходів ШІ. Подібним чином мікроскопія MUSE може уникнути необхідності обробки та фарбування тканин, забезпечуючи зображення тканин із високою роздільною здатністю за допомогою ультрафіолетових променів. У той час як поточні додатки штучного інтелекту можуть розпізнавати бали та градації пухлин, у майбутньому більшість із них, ймовірно, залишатимуться у вузькому домені штучного інтелекту, зосереджуючись лише на одному завданні.
Висновки
За останні кілька років спостерігається величезне зростання розвитку нових підходів штучного інтелекту в патології. При розумному використанні ці інструменти можуть покращити діагностичні робочі процеси, усунути людські помилки, підвищити відтворюваність між спостерігачами та робити прогностичні прогнози. Незважаючи на зростання розвитку інструментів штучного інтелекту, інтеграція в клінічну практику дещо відстає через кілька проблем, пов’язаних з інтерпретацією, валідацією, регулюванням, узагальненістю та вартістю. Оскільки потреба в персоналізованому лікуванні онкологічних захворювань зростає, додатки штучного інтелекту можуть бути впроваджені та використані належним чином у поєднанні з патологоанатомами після стандартизованих рекомендацій щодо використання та гармонізації з поточними інформаційними системами. Мультимодальний підхід із використанням протеоміки, геноміки та кількісного визначення мультиплексних біомаркерів на основі ШІ.
ДЖЕРЕЛО: https://www.ncbi.nlm.nih.gov/
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Використання наномедицини для боротьби з ф ...

Штучний інтелект виявляє зміни в рухах до ...

Як дешевий препарат із 100-річною історією ...
Інфекції сечовивідних шляхів і ризик інфар ...

Клінічний випадок: чорні плями на голові

Вплив тривалості грудного вигодовування на ...





