Равлик людини: анатомічні характеристики та їх значення для кохлеарної імплантації
Дата публікації: 02.10.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: слух, вухо, равлик, кохлеарні імпланти, кохлеарна хірургія
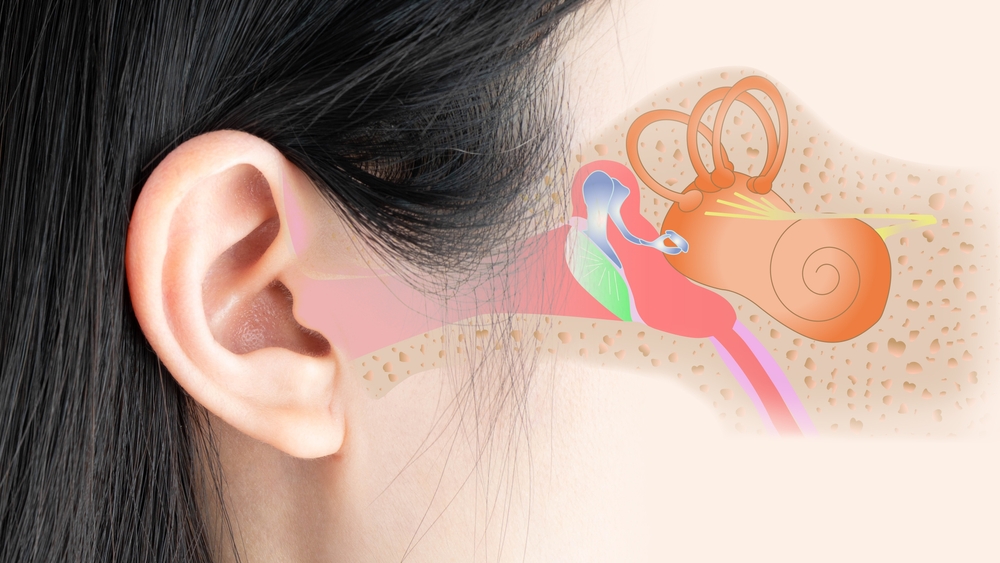
Равлик людини був вперше описаний Євстахієм у 1564 році та вперше опублікований Альбіні в Лейдені в 1744 році. Пізніше неаполітанський анатом Котуньо (1761) описав внутрішнє вухо людини та анатомію равлика за допомогою корозійних зліпків у De aqueductibus Auris Humana Interna. Через дев’яносто років Корті (1851) відкрив рецепторний орган, названий на його честь. У своїй монументальній праці Ретціус (1884) удосконалив гістологічні методи та представив ретельний опис клітинної анатомії вушної раковини людини, включаючи препарування поверхні.
Пропонуємо переглянути записи семінарів в межах «Ukrainian Otolaryngology Week».
Особливо важливою клінічною проблемою є повільна ретроградна дегенерація слухових нейронів людини після втрати волосяних клітин. Це має величезне значення та робить техніку кохлеарної імплантації (КІ) доступною з часом. Досвід показує, що функціональні нейрони можуть залишитися, що є дуже сприятливим фактором для пацієнта з КІ. Причина цього може критися у факторах захисту нейронів, таких як нейронна архітектура, взаємодія нейронів, секретовані захисні речовини або просто вроджена біологічна зміна або тривалість життя. Однак ці фактори важливо вивчити. Ми ще не знаємо, чи може електрична стимуляція справляти нейротрофічний вплив на слухові нейрони людини або впливати на їхнє виживання. Дослідження скроневої кістки 11 скроневих кісток пацієнтів із кохлеарним імплантатом не показало жодних доказів підвищення виживаності нейронів у імплантованому вусі порівняно з неімплантованим вухом.
Равлик людини: морфологія
Дві равлики людини — це дзеркальні, наповнені рідиною, згорнуті, досить симетричні кісткові трубки (3,2–4,2 см завдовжки), розташовані в кам’янистих пірамідах скроневих кісток. Перилимфа, рідина всередині переддвірної та барабанної лусочок сполучається зі спинномозковою рідиною через кохлеарний водопровід. Цей шлях обміну рідиною може сприяти поширенню інфекції між цими відділами рідини. Равлик людини складається з ~2 і 3/4 витків, але була описана незвичайна анатомія з 3 витками равлика. Він оточений компактною кістковою структурою — вушною капсулою. Це найтвердіша кістка в тілі з тришаровим розташуванням з острівцями модифікованого хряща та високим вмістом мінеральних речовин, що збільшує жорсткість кісткового лабіринту. Це бажано, щоб коливання рідини в вушній раковині відбивалися, а не поглиналися скроневою кісткою. Під час розтину вушна капсула контрастує жовтим кольором із навколишньою кортикальною кісткою.

Зараз велика увага приділяється кохлеарній анатомії завдяки хірургічним підходам до електричної стимуляції слухового нерва. Дослідження пластикових корозійних зліпків, виготовлених із невибраних скроневих кісток, зібраних під час розтину, показують значні анатомічні варіації розмірів та форм. Крім того, результати гістологічної реконструкції вимірювання довжини кортієвого органу демонструють ці варіації — виявлено, що довжина кортієвого органу може коливатися до 10 мм. Цікавим є високий ступінь двосторонньої симетрії, що характеризує парні органи в тілі. Хірургічно великий інтерес представляє базальний кінець вушної раковини. Він вигинається в трьох вимірах, нагадуючи «рибальський гачок». Тут виконується кохлеостома, і це місце круглого вікна (КВ). Анатомія гачка змінюється, що ускладнює хірургу оптимальне розміщення кохлеостоми та досягнення тимпані (ДТ) без руйнування будь-яких структур внутрішнього вуха.

Може виникнути звуження та помітне згортання вушної раковини, що впливає на вставлення масиву електродів навіть у звичайних вушних раковинах, особливо при використанні довших електродів. Середня довжина зовнішньої кохлеарної стінки становить 42,0 мм, тоді як перший виток становить 22,6 мм (діапазон 20,3–24,3 мм), що становить 53% від загальної довжини. Оскільки апікальний поворот невеликий, повне введення масиву електродів навряд чи можливо, принаймні, не за допомогою сучасних методів. Таке глибоке введення навряд чи потрібне (і може бути невигідним), тому що людський спіральний ганглій простягається лише на 1 і 3/4 обертів (тобто 630°). Місце ініціації ДТ точно не визначено, але це може бути сома гангліозних клітин у модіолюсі, а також вузли Ранв’є в периферичних або центральних аксонах, залежно головним чином від положення електрода.
Нові методи візуалізації, такі як КТ із 3D-реконструйованими об’ємними реконструкціями, можуть дати точну оцінку візерунка згортання; розмір і орієнтація вушної раковини відносно основи черепа. Це важливо перед операцією КІ, особливо у пацієнтів з вадами розвитку. Нова техніка під назвою «конусно-променева КТ» ще більше покращує роздільну здатність зображення та дає детальну інформацію про незначні деталі скроневої кістки, яка є корисною для КІ.
Клінічні наслідки анатомічних варіацій
Великі варіації кохлеарних довжин, кутів між витками та положення в основі черепа можуть вплинути на простоту введення електрода КІ, особливо після першого витка. Найчастіше пошкоджуються спіральна зв’язка в місці з’єднання першої і другої половини першого витка, базилярна мембрана (БМ) і кісткова спіральна пластинка. Недорозвинені вушні раковини можуть демонструвати більшу різницю в куті між першим і другим витками та меншу довжину основи вушної раковини. Різкий вигин кохлеарної спіралі в цій області може перешкоджати введенню електрода в цьому місці. Це підвищує ризик перфорації мембран равлика, коли кінчик електрода переміщається з першого повороту на другий. Цікаво, що вушна раковина може змінювати свою орієнтацію протягом перших років життя, що може вимагати модифікації отвору лицьового заглиблення.
Кругле вікно: анатомія
Сьогодні існує більше інтересу до збереження залишкового слуху при виконанні операції КІ, і корисність кохлеостомії зараз ставиться під сумнів кількома авторами. Тому багато хірургів знову використовують техніку введення КВ. Це можливо завдяки розробці нових атравматичних масивів електродів. Мембрана круглого вікна (КВM) розташована на кінці ДТ, де гачок згинається задньо-медіально. Ззовні він розташований під кістковим виступом (тегменом), утвореним виступом стінки вушної раковини. Його майже не видно хірургу через наявність ніші та складки слизової оболонки. Спочатку техніка, яка використовувалася для встановлення кохлеарного імплантату, була через КВ. Пізніше від цього відмовилися, оскільки свердлили кохлеостому для входу в ДТ. Через модіолюс, який перешкоджає при використанні підходу КВ, було визнано кращим зробити кохлеостому на кілька міліметрів перед КВM для позиціонування електрода вздовж зовнішнього боку стінки.
КВM була описана Скарпою (1747–1832) у 1772 році. Він віддав належне Габріеле Фаллопіусу (1523–1562) за відкриття КВM та Фабріцію де Аквопенденте (1538–1619) за перше графічне окреслення. У пізнішому перекладі, відредагованому Селлерсом і Енсоном, доступ до детального опису молодого Скарпи можна отримати та оцінити. Вони вже тоді розійшлися в справжньому вигляді КВM. Скарпа стверджує, що ця мембрана не плоска, як вважали анатоми, а конічна. Скарпа запропонував термін вторинна барабанна перетинка і вважав, що вона відіграє ще більшу роль у передачі звуку у внутрішнє вухо.
Розміри мембрани КВ людини
Сама мембрана має середній розмір 2,3 мм × 1,87 мм; мінімальний діаметр становить 1,08, а максимальний – 2,28 мм. Багато авторів, здається, не розглядали овоїдну форму мембрани КВ. Це може бути пов’язано з гістологічними дослідженнями, коли важко усвідомити його тривимірну структуру. КВ у людини не кругле, а овальне з довгим і коротким діаметром. Дорослі розміри досягаються рано під час внутрішньоутробного розвитку. Незважаючи на те, що індивідуальні значення значно відрізняються, розміщення стандартного масиву КІ з максимальним діаметром 1,0 мм через КВM має бути можливим у більшості випадків. Кілька електродів сьогодні мають розміри, менші за цей розмір 1 мм. КВM формується як сідло або «pringle-chips». У задній частині мембрана лежить дуже близько до lamina spiralis ossea на відстані приблизно 0,1 мм. У центрі ця відстань становить близько 1 мм. Товщина мембрани коливається від 50 до 100 мкм і відокремлює рідину внутрішнього вуха від заповненого газом простору середнього вуха. Найтоншою частиною КВM є центр, який може розірватися, якщо гідростатичний тиск перилімфи ДТ підвищується відносно тиску в середньому вусі. Слизова оболонка середнього вуха, яка вкриває зовнішню поверхню КВМ, містить кровоносні судини та нервові волокна.

Мембрана КВ підвішена в вушній кістці через фіброзне кільце. Епітелій, звернений до середнього вуха, має низький стовпчастий або плоский тип і складається з клітин, які утримуються разом за допомогою щільних з’єднань і базальної пластинки. Є тонка власна пластинка, яка містить сполучну тканину, нервові волокна і кровоносні судини. Вторинна мембрана (псевдомембрана) або складка зазвичай звужується до ніші КВ, але не завжди. Тому слід бути обережним і не видаляти цю мембрану безпосередньо під час операції, оскільки вона може порвати КВM. Невеликий нерв, що іннервує КВM з області спірального ганглія, проникає в фіброзний шар. Теоретично, а також через наявність морфологічної подібності з іншими механорецепторами в організмі, він може відчувати та контролювати коливання тиску перилімфи. Цікаво, що ці анатомічні структури не були знайдені у чотириногих, що свідчить про те, що вертикальне положення людини може вимагати додаткових регуляторних механізмів для гомеостазу рідини.
Вхід до КВM утворює невеликий простір під назвою fossula fenestrae rotunda. Його максимальний діаметр становить 2,98 ± 0,23 мм, а форма дуже різниться, і його зовнішній вигляд може спантеличити хірурга та змусити його повірити, що КВM помилково неправильно розміщено з частково окостенілим входом, який помилково прийнято за саму мембрану.
Анатомія лицьового поглиблення та хірургія КВM
Простір між латеральною стороною третьої частини лицевого нерва та chorda tympani називається лицьовим поглибленням і є найпоширенішим шляхом до середнього вуха для розміщення КІ . Його розмір і форма можуть сильно відрізнятися. Іноді лицевий нерв може випинатися, що унеможливлює візуалізацію КВM без видалення деякої частини задньої кісткової стінки проходу.

Електронна мікроскопія равлика людини: актуальність для КІ
Організація вушної раковини людини
У кортієвому органі містяться механосенсорні клітини, розташовані в один ряд внутрішніх волоскових клітин (ВВК) і від т3 до 4 (іноді до 5) рядів зовнішніх волоскових клітин (ЗВК). З апікальних полюсів сенсорних рецепторних клітин виходять пучки чутливих волосків (стереоцилій). Волоскові клітини оточені декількома типами опорних клітин, і ці опорні клітини контактують з КВМ. Оскільки стереоцилії волоскових клітин з’єднані з позаклітинною текторіальною мембраною, коливання КВМ викликають відхилення пучків волосся вперед-назад. Цей рух не є рівномірним уздовж кохлеарної спіралі, оскільки КВМ є вузьким і досить жорстким у своїй основі, але ширшим і більш податливим біля вершини кохлеарної протоки. Високі частоти відображаються біля основи, тоді як низькі частоти викликають максимальні вібрації ближче до вершини. Це призводить до тонотопічної організації сенсорних клітин, де розташування збуджених волоскових клітин уздовж BM визначає частоти, що сприймаються. Базальна мембрана (БМ) і тонка мембрана Рейснера (МР) поділяють спіральний канал на три його відділи. Канал равлика заповнений ендолімфою, яку можна відрізнити за її іонним складом, який дуже схожий на внутрішньоклітинний характер щодо вмісту калію.
Мембрана Рейснера
Мембрана Рейснера людини (МР) складається з епітеліально-клітинного шару, зверненого до ендолімфатичного відділу SM, і мезотеліального шару, зверненого до перилімфатичного відділу scala vestibuli. Ці клітинні шари розділені базальною мембраною та утворюють важливий бар’єр між цими двома рідинами, які мають абсолютно різні іонні склади. RM бере участь у гомеостазі та транспорті рідини. Цілісність цієї мембрани є важливою для слуху, щоб підтримувати ендокохлеарний потенціал (EP; +80 мВ) у кохлеарній протоці. У людини мембрана помітно відрізняється від мембрани у гризунів і мавп тим, що епітеліальні клітини мають неправильну форму, а їхні межі утворюють мозаїку зі скупченнями виступаючих клітин. Немовлята та діти мають однакову рівномірно полігональну поверхневу структуру епітеліального шару. Функція розривного шару мезотеліальних клітин і меланоцитів, розташованих майже виключно на перилімфатичній стороні, залишається неясною.

БМ і тимпанічний покривний шар
Спеціалізована базальна мембрана чутливого епітелію являє собою батутоподібний масив еластичних волокон, підвішених між модіолусом і бічною стінкою. Він складається переважно з радіально розташованих фібрил характерної прямокутної форми, вбудованих у матрицю. Ці волокна містять кілька різних видів колагену. Крім того, протеоглікани та фібронектини були ідентифіковані всередині матриці.
Механічні властивості вздовж її спірального шляху значно варіюють і забезпечують тонотопічну організацію базилярної мембрани (БМ). В основі ця мембрана вузька і товста (0,1 мм), а до верхівки вона тоншає і розширюється (0,5 мм). Таким чином, ризик перфорації BM з масивом електродів зростає з глибиною введення. Частина BM між Кортієвим тунелем і кістковою спіральною пластинкою утворює безперервну мембрану з невеликими отворами для проходження нервових волокон до Кортієвого органу, тобто «habenulae perforatae», тоді як паралельні нитки, периферійні де ця область може вільно вібрувати. Уздовж ДТ до товстого матриксу БM прилягає клітинний шар клітин, що покривають барабанну трубку, які мають фагоцитарні властивості. Можливо, ці клітини реагують з електродом, викликаючи реакцію стороннього тіла, що призводить до утворення фібробластної оболонки, що охоплює електрод КІ. Інтенсивне розповсюдження цих фібробластів, що охоплюють оболонку, може призвести до збільшення імпедансів електродів, що може призвести до зниження продуктивності.
Спіральна зв’язка
Позначення як зв’язка є незручним позначенням для цієї дуже метаболічно активної та важливої тканини. Спіральна зв’язка закріплює БM на латеральній стороні вушної капсули. Це прикріплення до кортієвого органу характеризується наявністю фібробластів напруги, які містять актин, міозин і тропоміозин. Це може створити певну активну напругу, яку можна модулювати. Окрім механічної функції, спіральна зв’язка відіграє важливу роль у постачанні та відтоку перилімфи. Губчастий вигляд, пронизаний розгалуженою капілярною мережею, свідчить про інтенсивний високий рівень зв’язку між ДТ і переддвірною лускою. Таким чином, спіральну зв’язку можна віднести до області перилімфатичного відділу.
Судинна смужка людини складається з трьох різних типів клітин у послідовних шарах: крайових клітин, проміжних клітин і базальних клітин. Ця тканина з високим метаболізмом обслуговується розгалуженою сіткою капілярів і формує латеральний аспект БМ між МР і спіральним виступом. Крайові клітини походять від епітеліальних клітин, звернені до просвіту ендолімфи і посилають довгі переривчасті відростки аж до базальних клітин. Поверхня, звернена до просвіту ендолімфи, утворена виключно маргінальними клітинами та обмежена щільними з’єднаннями, численними десмосомами та різною щільністю та розміром мікроворсинок, які межують з ендолімфатичним відділом БМ. Проміжні клітини мезодерми подібні до меланоцитів і походять від нервового гребеня. Істотною відмінністю від інших епітеліїв є часткова відсутність базальної мембрани під крайовими клітинами. Це може сприяти тісному контакту з ендотеліальними клітинами стріальних капілярів і суміжних проміжних клітин.
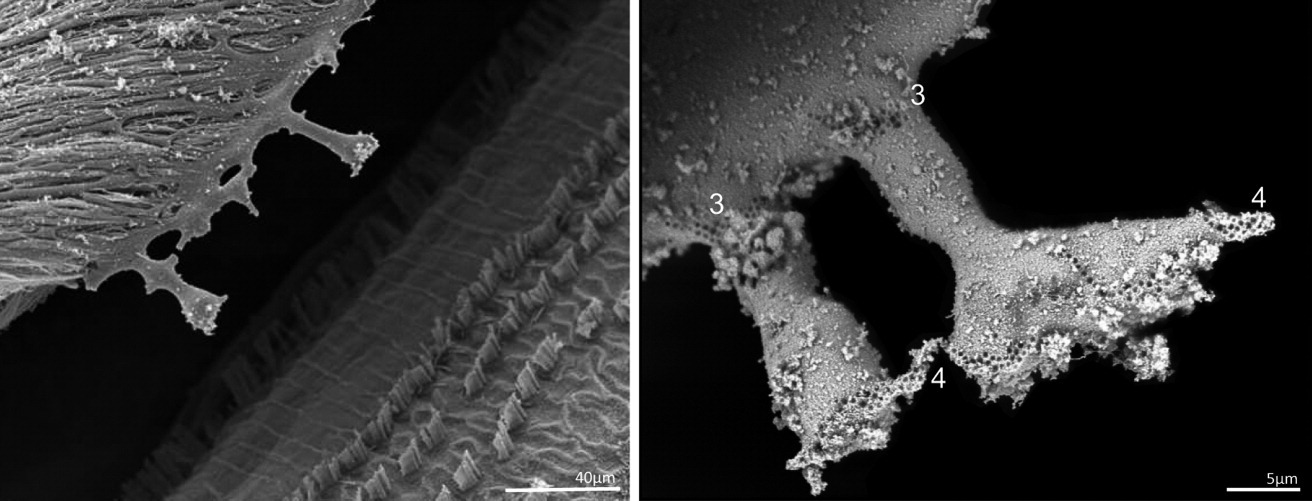
Текторіальна мембрана
Текторіальна мембрана (ТМ) — це позаклітинний матрикс, який викликає зсувний рух пучків стереоцилій, коли вібрація потрапляє в перегородку равлика. Ця допоміжна маса потрібна для забезпечення руху «легких» і, отже, досить нечутливих до вібрації волоскових клітин. ТМ складається з радіально розташованих нерозгалужених фібрил колагену типу II і типу IX (тип A) і сильно розгалужених волокон колагену типу V (тип B), в які вбудовані товсті волокна. Желеподібна матриця складається з різних глікопротеїнів, наприклад, текторинів і отогеліну. Мутації в α-текторині людини лежать в основі двох домінантно успадкованих несиндромних глухот, тобто DFNA8 і DFNA12. Відбитки стереоцилій з найвищих кінчиків стереоцилій OHC вказують на досить тісний зв’язок цих структур із TM, тоді як цей тісний зв’язок між кінчиками стереоцилій IHC та TM залишається неясним.
Опорні клітини
Підтримуючі клітини забезпечують щільне та стійке до викривлення з’єднання волоскових клітин з BM. Найміцнішими з цих опорних клітин є внутрішні та зовнішні стовпові клітини, які містять масивний масив спеціалізованих трубчастих ниток (тонофібрил), які утворюють тунель Корті. Клітини Дейтера підтримують основи ЗВК, утворюючи «місце» для базальних частин цих сенсорних клітин і посилаючи фаланговий відросток до ретикулярної пластинки, завершуючи їх структурну підтримку. Клітини Гензена, Клавдіуса і Бетчера формують латеральний сегмент кортієва органу. Хвилясті латеральні клітинні мембрани клітин Генсена та Клавдіуса забезпечують збільшення поверхні. Опорні клітини виконують не тільки механічну функцію. Транспортери іонів і добре виражена система щілинних з’єднань служать для підтримки гомеостазу та дозволяють опорним клітинам діяти узгоджено. Коннексини відіграють важливу роль у з’єднанні цієї організованої системи опорних клітин.
Волоскові клітини та іннервація
У кортієвому органі присутні два типи механотрансдукторних сенсорних клітин, які зазвичай розташовані в один ряд внутрішніх (ВВК) і 3-4 (іноді навіть 5 рядів неправильно розташованих ВВК в апікальній області) ряди ЗВК. Була виявлена велика варіабельність довжини кохлеарної протоки в діапазоні від 28,0 до 40,1 мм. Середня щільність внутрішніх і зовнішніх волоскових клітин зменшувалася зі збільшенням довжини равлика, при цьому довгі равлики мають більшу кількість волоскових клітин у певній частотній області. Ці поляризовані нейроепітеліальні клітини виявляють спеціалізовані мікроворсинки на своєму апікальному полюсі, які називаються стереоциліями. Ці дубиноподібні жорсткі ( грецьке: стерео) клітинні виступи містять велику кількість паралельно-смугастого актину і тому не можуть рухатися, як «справжні вії». Ця жорсткість стереоцилій зменшується від основи до вершини і може бути пов’язана зі зниженням резонансних частот. Мутації в гені, що кодує нетрадиційний міозин VIIa, який експресується лише в стереоциліях, викликають глухоту у людей. Стереоцилії закріплені в апікальному полюсі волоскових клітин з електронно-щільними актиновими корінцями в кутикулярній пластинці. Ця органела, тобто кутикулярна пластинка, являє собою товсту кінцеву мережу з високим вмістом актину та пов’язаних з ним білків, за винятком області базального тіла, яка називається кутикулярною порою. Стереоцилії з’єднані між собою бічними зв’язками, що дозволяє їм узгоджено відхилятися в одному напрямку. На їх апікальному кінці ланки з тонкими кінчиками з’єднують стереоцилії сусідніх рядів, які, як вважають, є частиною каналу рецептора механотрансдукції. Окрім цієї спільної організації рецепторного полюса, існують значні відмінності між двома типами слухових волоскових клітин.

Внутрішні волоскові клітини
Одна внутрішня волоскова клітина (ВВК) має приблизно 50-70 стереоцилій на базальному кінці та 100 на верхівці равликової перегородки. ВВК є основними аферентними сенсорними клітинами слуху. Кожна ВВК іннервується декількома аферентами, які, як передбачається, походять виключно від великих (тип I) нейронів у спіральному ганглії. Понад 90% нервових волокон у кістковій спіральній пластинці належить до великих спіральних гангліозних клітин (SGC), що відображає важливість ВВК для аферентної нейротрансмісії до центрального слухового шляху. Загальна щільність аферентної іннервації становить максимум 1400 волокон/міліметр, і це дуже мало порівняно з 3000 волокон/міліметр у кішки. Кожна кінцева частина має кілька синаптичних контактів з одним IHC. Як було продемонстровано на тваринах, у людини ці термінали дуже чутливі до аноксії. Вони можуть реагувати величезним набряком, як це спостерігається в посмертному матеріалі. Значні варіації розмірів аферентних терміналів також були виявлені у людини (Nadol, 1990a).). Великі нервові закінчення часто утворюють численні ділянки синаптичної спеціалізації, розгалужені та синапсовані з трьома суміжними IHC. Електронно-щільні спеціалізації на пресинаптичній стороні, які називаються синаптичними стержнями, тілами або стрічками, є загальною рисою зразків вушної раковини людини. Еферентні нервові закінчення утворюють лише синаптичні контакти з аферентними дендритами, як і у всіх ссавців. Дуже мало еферентних терміналів досягають тіла клітини IHC.
Зовнішні волоскові клітини
Дуже мало аферентних нервових волокон або базилярних нервових волокон проходить біля основи тунелю до зовнішніх волоскових клітин (ЗВК). Нижче ЗВК вони утворюють зовнішні спіральні волокна. Вони утворюють величезні пучки спірально орієнтованих нервових волокон групою з кількох сотень між клітинами Дейтера. Вони містять нейроканаликули товщиною 0,1 мкм. Кілька еферентних нервових волокон проходять через ці пучки, і їх можна легко розрізнити завдяки їх більшому розміру, нейрофіламентам і синапсу «прохідний» із зовнішніми спіральними нервовими волокнами.
Кількість зовнішніх спіральних нервових волокон збільшується у верхньому витку приблизно до 200 і 400 у другому витку, знову зменшується до 300 у верхівковому витку. В основі ОГК розташовані великі та малі відвідні нервові закінчення. Можливо, розгалужена система зовнішніх спіральних волокон може з’єднувати або синхронізувати групи ЗВК, посилюючи реакцію кортієвого органу на слухові стимули. Іншою відмінністю від вушної раковини тварин є менша кількість внутрішніх спіральних еферентних нервових волокон і еферентних нервових закінчень біля основи ОГК.
Імуногістохімічні дослідження внутрішнього вуха людини проводилися в останнє десятиліття з використанням антитіл проти кількох різних нейромедіаторних білків. Було продемонстровано, що ГАМК і ацетилхолін є еферентними нейромедіаторами внутрішнього вуха людини.
Сенсорна трансдукція та кохлеарна ампліфікація
Волоскові клітини є вторинними сенсорними клітинами і тому не здатні генерувати потенціал дії. Вони передають свої відповіді центральній нервовій системі через свої аферентні нервові контакти до SGC типу I у вушній раковині, які здатні генерувати імпульсні потенціали. Ці SGC розташовані в модіолюсі, більшість із них у Розенталевому каналі (базальний поворот), і направляють свої периферичні відростки через кісткову спіральну пластинку до волоскових клітин у Кортієвому органі. Незважаючи на меншу кількість, ВВК є основними сенсорними клітинами, що забезпечують синаптичний вхід до 90–95% аферентних нервових волокон основних великих SGC типу I. Малі гангліозні клітини типу II також є аферентними, але складають лише 5–10% усіх спіральних гангліозних нейронів і, як вважають, іннервують лише ЗВК. Моторний білок престин дозволяє ЗВК швидко змінювати як довжину, так і жорсткість свого клітинного тіла як їхню основну реакцію на звук. Ця рухлива реакція може посилювати рух кортієвого органу, підвищуючи чутливість і тим самим сприяючи частотному аналізу та бінауральній акустичній локалізації. Нещодавно було повідомлено про імуногістохімічну демонстрацію та локалізацію престину в ЗВК людини.
Спиральний ганглій людини: анатомія
Равлик людини з нормальним слухом містить приблизно 35 000 аферентних нейронів, які є біполярними з сомою (SGC), розташованими в спіральному каналі Розенталя (КР) у модіолусі вздовж 1¾ повороту равлика. Спіральний ганглій закінчується опуклістю, що містить клітинні тіла нейронів, що іннервують волоскові клітини третьої черги. Периферичні відростки (називаються аксонами або дендритами) проходять у бімелярному кістковому просторі кісткової спіральної пластинки до перфорованої головки, щоб вийти з цього кісткового каналу та іннервувати волоскові клітини. Можна виділити принаймні два типи SGC. 90% можна віднести до великих нейронів (або типу I; ~20–30 мкм у діаметрі). Вони характеризуються помітними ядерцями з пухким хроматином і цитоплазмою, багатою мітохондріями, і добре розвиненим ендоплазматичним ретикулумом. 5-10% SGCs є меншими нейронами (або клітинами типу II; ~10-15 мкм в діаметрі) з ядром, яке має менш виражений гетерохроматин, а цитоплазма містить менше мітохондрій і нейрофіламентів. Було продемонстровано морфологічні докази навіть трьох типів SGC у людини. Вважається, що малі нейрональні клітини іннервують ЗВК, тоді як великі нейрональні клітини іннервують ВВК. Постачання еферентного нерва здійснюється від медіальної та латеральної оливокохлеарної системи за допомогою волокон, що проходять спірально всередині КР у вигляді так званого інтрагангліонарного спірального пучка. Він містить менші мієлінізовані та немієлінізовані еферентні нервові волокна і тісно пов’язані з меншими (тип II) нейрональними клітинами в периферичній частині КР. Існують також адренергічні волокна, що проходять уздовж кровоносних судин, і деякі незалежні від кровоносних судин, тісно пов’язані з аферентними нервовими волокнами. Менші нейрони спірального ганглія експресують білок периферин.
Характерною особливістю сомат SGC людини є відсутність у них компактного мієлінового шару навколо перикарію. Деяку мієлінізацію можна спостерігати частіше у зразках вушної раковини літніх людей, ніж у зразках, отриманих від новонароджених. Однак більшість населення були немієлінізовані (94%). Кожна ВВК отримує синаптичні контакти від 10 до 14 нейронів. Ці групи нейронів можуть діяти узгоджено в обробці електричних сигналів від відповідних волоскових клітин, утворюючи «функціональні одиниці». Гангліозні клітини нерідко оточені звичайними та неповними сателітними клітинами, які можуть уможливити електричне перехресне збудження. Також було виявлено нервові взаємодії між нервовими волокнами та великими клітинами, а також аксосоматичні зв’язки між еферентними та малими гангліозними клітинами. Хоча фізіологічне значення цих синапсів невідоме, вони можуть опосередковувати пресинаптичну нервову модуляцію слухових нейронів типу II на рівні спірального ганглія.
Спиральний ганглій людини і КІ
Електрична стимуляція від кохлеарних імплантатів викликає AP у решті волокон слухового нерва. Анатомічно невідомо, де ці шипи починаються. Нервові сомати або початкові аксональні вузли Ранв’є здаються ймовірними, оскільки збережені дендрити можуть не впливати на показники, оцінені гістологічно у пацієнтів, які отримували КІ. Подібним чином кількість необхідних нейронів все ще обговорюється, але дивовижно мало нейронів (~10%), здається, потрібно для створення мовної продуктивності, що відображає надмірність, присутню в акустичній системі. Таким чином, здається, необхідні технічні досягнення, щоб повною мірою скористатися потенціалом залишкових нейронних популяцій пацієнтів. Це має включати нові принципи стимуляції, додаткові функціональні канали для покращеної частотної роздільної здатності, тонкої структури та сприйняття музики. Проблемою є анатомічне/тонотопічне стиснення та невідповідність нейронів спірального ганглія. Лише в базальному повороті гангліозні клітини розподілені таким чином, що частотно-специфічна стимуляція виглядає можливою за допомогою сучасних методів. Більш апікально гангліозні клітини досягають лише трьох чвертей оберту, тоді як область волоскової клітини простягається на 1 і 3/4 обертів на досить короткій відстані. Ці нейрони, навіть незважаючи на тонотопічне розташування, не можуть бути вибірково стимульовані за допомогою поточної техніки КІ. Таким чином, стимуляція КІ або введення електрода за межами 360° та 450° на цей момент не здаються необхідними. Крім того, у сучасній техніці використовується монополярна стимуляція, яка обмежує селективну активацію нейронів, що ще більше ставить під сумнів необхідність глибшого введення масиву електродів КІ. Оскільки доступно мало даних щодо поточного поширення у високоанізотропному внутрішньому вусі, прогнози щодо спрямованої стимуляції апікальних SGN з КІ є складними.
Ці питання актуальні для обговорення у зв’язку з новими методами збереження слуху, спрямованими на забезпечення електричної стимуляції та слуху в області середніх і високих частот. Техніка електроакустичної стимуляції використовує як низькочастотний акустичний слух через слухові волоскові клітини, так і електричну стимуляцію збережених нейронів у тому самому вусі. Деякі пацієнти можуть втратити залишковий слух і стати повністю залежними від свого імплантату для електричної стимуляції на всіх частотах. Глибоке введення матриці КІ збільшує ризик втрати залишкового слуху, але теоретично може покращити ефективність у випадку, коли залишковий слух пацієнта зрештою втрачено. Однак, бракує інформації щодо оптимальної глибини введення в більшості випадків з метою збереження залишкового слуху пацієнта чи без нього.
Втрата сенсорних клітин у тварин призводить до ретроградної валлерівської дегенерації зі зниженням щільності популяції слухових нейронів спірального ганглія. Вважається, що це спричинено порушенням секреції нейротрофіну з кортієвого органу, який може діяти як фактор виживання пов’язаних слухових нейронів. У пацієнтів із вродженою глухотою та SNHL у дорослому віці нейрони, здається, зберігаються навіть після багатьох років глухоти. Це спостереження свідчить про те, що руйнування SGC у людей відбувається повільніше.
Архітектура вушної раковини людини та дизайн електродів — сьогодення та майбутнє
Важливим питанням є дизайн різних масивів електродів і те, як вони адаптуються до анатомічних особливостей вушної раковини людини. Деякі масиви електродів розташовані близько до стінки модіоляра — так звані перимодіолярні електроди, а інші лежать вільно в ДТ, переважно біля бічної стінки. Хоча перимодіолярна форма може призвести до більш тісного зв’язку між електродами та сомою SGC, вона також може потенційно спричинити травму тонкої кісткової стінки модіолюса. З іншого боку, латерально розташована матриця електродів може спричинити напругу бічної стінки та BM. Під час ревізійної хірургії може знадобитися більше зусиль, щоб витягти КІ, яка обіймається навколо модіолуса. Це може бути недоліком для дітей, які, як очікується, пройдуть ревізійну операцію кілька разів протягом життя. У майбутньому розробники електродів повинні формувати електроди таким чином, щоб вони мінімізували травму під час введення. Це важливо, оскільки травма медіальної стінки ДТ може пошкодити спіральний ганглій, який є основною мішенню електричної стимуляції електродами імплантату. Будуть потрібні менші та більш гнучкі масиви, щоб адаптуватись до індивідуальних структурних варіацій у конструкції вушної раковини людини та для збереження залишкового слуху окремих пацієнтів.
ДЖЕРЕЛО: https://anatomypubs.onlinelibrary.wiley.com/
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу
Стрес як чинник загострень хронічної обс ...
Ренопротекція

Перше 3D генетичне картування серця виявля ...
Електроконвульсивна терапія ефективніша пр ...
Новий метод, здатний передбачити, коли роз ...

Діагностика і лікування ФП та ТП: Тріпотін ...