Внесок і терапевтичне значення мітофагії при церебральній ішемії-реперфузії після зупинки серцz
Дата публікації: 09.10.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: ішемія, зупинка серця, виживання, мітохондрія, реперфузія
Зупинка серця (ЗС) стала серйозною проблемою охорони здоров’я в усьому світі через її гострий початок, вузьке терапевтичне вікно та високий рівень смертності та інвалідності. Глобальна захворюваність на ЗС становить приблизно 418 випадків на кожні 100 000 осіб, з приблизно 1,05 мільйонами позалікарняних випадків ЗС (ПЛСН) на рік у Китаї та захворюваністю на госпітальну ЗС (ГЗС) 1,75% [4]. Незважаючи на постійні інновації та розвиток методів серцево-легеневої реанімації та різноманітних передових технологій життєзабезпечення в останні роки, загальна виживаність пацієнтів після ЗС становить приблизно 10%. У 2014 році показники виживаності та виписки з ПЛСН та ГЗС у Китаї становили лише 1,15% та 9,1% відповідно. Ці показники значно нижчі, ніж у західних країнах, де показники виживаності та виписки з ПЛСН та ГЗС становлять 8–9,0% та 15–34% відповідно. Використовуючи модель Утштейна, дослідження, яке включало 101 982 пацієнти з ГЗС, показало, що частка тих, хто вижив, із хорошими неврологічними результатами становила лише 6,4%. Клінічно CA в основному проявляється як синдром зупинки після ЗС (СЗЗС), що характеризується церебральним ішемічно-реперфузійним пошкодженням після ЗС (ІРПЗС), дисфункцією міокарда після ЗС (ДМЗС), системним ішемічним реперфузійним пошкодженням і стійкою патологією, що провокує розвиток. ІРПЗС після ЗС тісно пов’язане з поганим прогнозом для пацієнтів із ЗС та може призвести до серйозної дисфункції моторних відчуттів і розумового пізнання, що серйозно впливає на якість життя пацієнтів, які вижили, і накладає важкий тягар на пацієнтів, сім’ї та суспільство.
Реєструйтесь на семінари в межах майбутнього заходу: Ukrainian Cardiology Week. Школа кардіології.
Модель подвійного удару для ІРПЗС включає різноманітні патологічні фактори та процеси, такі як мітохондріальна дисфункція, порушення енергетичного обміну, перевантаження внутрішньоклітинного кальцію, надмірне виробництво вільних радикалів, збудлива амінокислотна токсичність та запальний каскад. Мітохондрії є органелами з подвійною мембраною та динамічними центрами у всіх еукаріотичних клітинах, крім зрілих еритроцитів у ссавців, і відіграють життєво важливу роль у багатьох ключових стадіях ІРПЗС. Мітофагія, ендогенний механізм, спрямований на видалення пошкоджених мітохондрій, нещодавно став центром досліджень захисту мозку після ЗС.
Суттєва роль мітохондріальної дисфункції в ІРПЗС
Після ЗС клітини мозку відчувають транзиторну ішемію та гіпоксію. Ефективність дихального ланцюга мітохондріального транспорту електронів значно знижується, що призводить до зниження доставки кисню та глюкози та зниження виробництва аденозинтрифосфату (АТФ), що сприяє енергетичним розладам. Нездатність досягти відновлення спонтанного кровообігу протягом 4–6 хвилин може призвести до незворотного пошкодження мозку. Дисбаланс доставки та споживання кисню перешкоджає окисному фосфорилюванню в мітохондріях, посилює анаеробний метаболізм і внутрішньоклітинне накопичення лактату, що ще більше посилює пошкодження нервових клітин.
Виснаження АТФ призводить до дисфункції енергозалежних іонних каналів клітинної мембрани, великого витоку калію, деполяризації клітинної мембрани та активації відкриття залежного від напруги Ca 2+ каналу. Деякі збуджуючі амінокислоти, такі як глутамат, вивільняються в синаптичній щілині, поєднуються з рецепторами N-метил-D-аспартату та збільшують внутрішньоклітинний Ca 2+.
Прегляньте записи семінарів, що пройшли в межах Ukrainian Neurology Week. Менеджмент болю.
Якщо рівні Ca 2+ перевищують буферну здатність ендоплазматичної сітки мітохондрій, це викликає перевантаження кальцієм, що, своєю чергою, пригнічує мітохондріальний ланцюг транспортування електронів і посилює енергетичні розлади. Ca 2+, як вторинний месенджер, посилює активність неспецифічних мітохондріальних перехідних пор проникності (mPTP) в умовах стресу, дозволяючи молекулам < 1,5 кДа вільно проходити через внутрішню мітохондріальну мембрану. Це призводить до мітохондріального набряку, при якому об’ємна місткість мітохондріальних крист і зовнішньої мембрани перевищується, тим самим сприяючи виробленню проапоптичних факторів. Крім того, руйнування структурної цілісності мітохондрій і функціональності мембрани може посилити інгібування виробництва АТФ.
Реперфузійне пошкодження після відновлення спонтанного кровообігу призводить до «вторинного удару» після первинного ішемічного пошкодження. Електрони, що витікають із дихального ланцюга електронів у пошкоджених мітохондріях, зв’язують кисень, отриманий шляхом реперфузії, утворюючи велику кількість активних форм кисню (АФК). Ці АФК можуть безпосередньо зв’язуватися з субстратами (тобто Zn 2+), порушувати цілісність мітохондріальної структури та активувати мітоген-активовану протеїнкіназу (АМФПК) і ядерний фактор Kappa B (NF-κB) сигнальні шляхи. Це сприяє вивільненню прозапальних факторів, що ще більше посилює пошкодження від окисного стресу. Пошкоджені мітохондрії вивільняють цитохром с (CytC), який відіграє ключову роль в апоптозі нервових клітин шляхом передачі mPTP у цитозоль і активації каспази-9 і каскаду каспази, що йде вниз за допомогою багатьох сигнальних шляхів. Мітохондрії беруть участь у кількох важливих стадіях ІРПЗС, включаючи енергетичні розлади, перевантаження кальцієм, надмірне виробництво вільних радикалів і апоптоз. Як механізм, що лежить в основі ендогенного видалення пошкоджених мітохондрій, помірна мітофагія може бути критичною мішенню для розробки нової терапевтичної моделі для ІРПЗС після CA.
Мітохондріальна динаміка та мітофагія регулюють підтримку мітохондріального гомеостазу
Нормальний фізіологічний стан мітохондрій передбачає відносно стабільні динамічні зміни шляхом постійного злиття та поділу, регуляції аутофагії, кальцієвого гомеостазу, імунної сигналізації та апоптозу. Це гарантує, що клітини можуть виконувати різні фізіологічні дії, гальмувати прогресування захворювання та підтримувати клітинний гомеостаз. Злиття мітохондрій відбувається в три послідовні стадії: транстетеринг мітохондрій, злиття зовнішньої мітохондріальної мембрани та злиття внутрішньої мембрани. У ссавців мітофузин-1 (Mfn1) і мітофузин-2 (Mfn2) взаємодіють на зовнішній мітохондріальній мембрані, утворюючи димери Mfn1/Mfn2, які опосередковують трансприв'язування зовнішньої мембрани і згодом викликають плавлення зовнішньої мембрани шляхом гідролізу ГТФ. Білок оптичної атрофії 1 (OPA1) на будь-якій внутрішній мембрані та пов’язані з нею молекули ліпідів можуть опосередковувати злиття зовнішньої мембрани для повного злиття мітохондрій. Мітохондріальний поділ включає дію факторів мітохондріального поділу. Динамін-споріднений білок 1(Drp1) у цитозолі може бути рекрутований до мітохондріальної мембрани за допомогою білка ділення 1 (Fis1), і разом вони утворюють кільцеву структуру. ГТФ в мітохондріальній мембрані розщеплюється шляхом гідролізу ферменту ГТФ і завершується поділ мітохондрій. Потім Drp1 може бути перероблений назад у цитозоль.
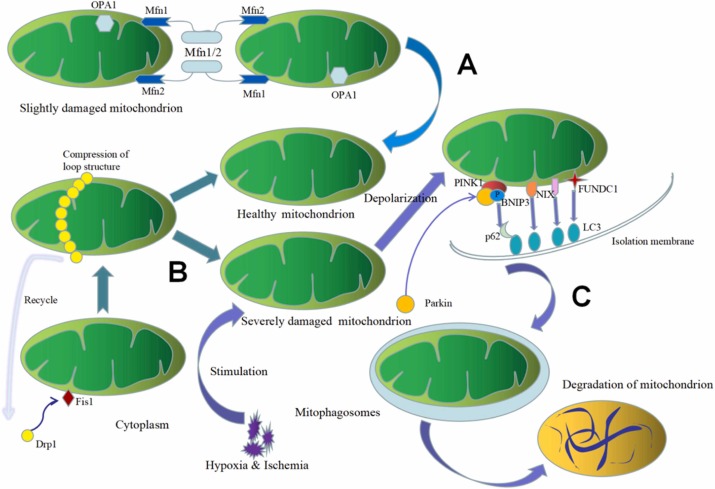
Сигнальні шляхи мітофагії та терапевтичні цілі, пов’язані з ІРПЗС та іншими ішемічно-реперфузійними ушкодженнями
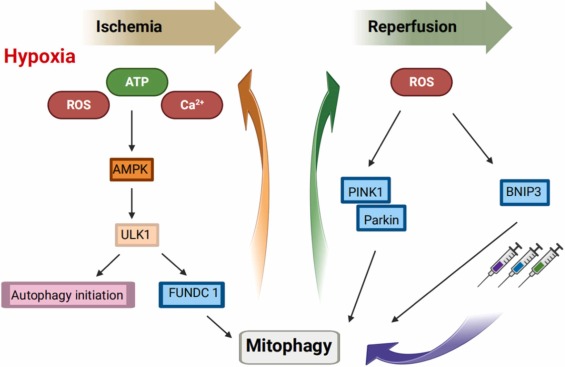
У фазі ішемії швидке зниження АТФ активує шляхи протеїнкінази, що активується аденозин 5 '-монофосфатом (АМФПК), що призводить до аутофагії в клітинах мозку. АМФПК активує фосфорилювання ULK1 для активації шляху FUNDC1 і сприяння мітофагії. У фазі реперфузії збільшення АФК може активувати BNIP3 і PINK1/Parkin-опосередковану мітофагію, яка захищає від ІРПЗС. Дослідження також надали докази того, що мітофагія може послабити ІРПЗС під час фази реперфузії. Втручання та контроль ключових ланок у цих мережах є частиною життєво важливого підходу до покращення прогнозу ІРПЗС шляхом посередництва мітофагічного шляху.
Ефекти та терапевтичний потенціал мітофагії при дисфункції міокарда після зупинки серця (ДМЗС)
Рівень захворюваності на ДМЗС становить приблизно 34–75%, а тяжкість тісно пов’язана з рівнем ранньої смертності пацієнтів із CA, хоча в більшості випадків ДМЗС є оборотною. Пік спостерігається через 8 годин після ЗС і слабшає між 48 і 72 годинами. Клінічні прояви зазвичай включають зниження серцевого індексу (СІ), недостатню систолічну/діастолічну функцію лівого шлуночка (ЛШ) або дисфункцію правого шлуночка.
Важка ДМЗС може спричинити некроз міокарда, що характеризується набряком і тріщинами мітохондрій, пошкодженням внутрішнього середовища та крововиливом із прискоренням протягом періоду реперфузії. Основні механізми цієї відповіді включають механічне пошкодження, пошкодження міокарда, викликане катехоламіноподібними препаратами, і цитокін-опосередковані запальні реакції. Дослідження показали, що мітофагія також відіграє важливу роль у лікуванні ДМЗС.
Рівні ДМЗС або некрозу міокарда можуть суттєво визначати короткотерміновий результат (тобто ROSC) у пацієнтів з ЗС. Некроз міокарда опосередковано впливає на віддалені результати (тобто рівні КФК), пов’язані з ІРПЗС. Численні дослідження підтвердили важливість мітофагії в лікуванні некрозу міокарда, головним чином шляхом регулювання дискретного рівня експресії мітофагії під час прогресування ДМЗС.
Ефекти та терапевтичний потенціал мітофагії при ішемічно-реперфузійному ураженні інших органів
Ішемічно-реперфузійне пошкодження, спричинене зупинкою серця, може пошкодити декілька органів, включаючи нирки, печінку, легені та кишечник. Більш ніж у половини пацієнтів після ЗС буде гостре ураження нирок (ГУН), тоді як у 21% розвивається гіпоксичне ураження печінки. Дексмедетомідин може полегшити пошкодження гіпокампа та когнітивну дисфункцію, спричинену ішемічно-реперфузійним пошкодженням печінки (HIRI), шляхом активації опосередкованої SIRT3 мітофагії та інгібування запалення NLRP3. Гіпербілірубінемія може загострити респіраторне ішемічно-реперфузійне пошкодження (RIRI) шляхом активації опосередкованої PINK1/Parkin мітофагії. Дексмедетомідин також послаблює кишкову ішемічно-реперфузійну травму (IIRI) через активацію мітофагії.
Зв'язки між мітофагією та некроптозом в ІР та їх загальними сигнальними молекулами
Смерть клітини можна розділити на запрограмовану смерть клітин (ЗСК) (наприклад, апоптоз, аутофагія, некроптоз, піроптоз і фероптоз) і непрограмовану смерть (наприклад, некроз, онкоз і мітотична катастрофа). Традиційно некроз вважається пасивним типом загибелі клітин, який є неконтрольованим і не потребує передачі енергії або сигналу під час патологічного пошкодження, що свідчить про те, що його можна опустити при розгляді апоптозу та аутофагії. Однак останні дослідження показали, що некроз може відбуватися через запрограмований клітинний процес. Дегтерєв та ін. виявили, що мала молекула некростатин-1 (Nec-1) спеціально блокує некроз, пов’язаний із системами рецептор-ліганд смерті, але не запобігає апоптозу. Цей тип ЗСК називається «некроптозом» і має морфологічні ознаки, спільні з некрозом і механізмом регуляції, подібним до апоптозу.
Шлях некроптозу включає комбінацію та фосфорилювання RIPK1/3 для рекрутування доменоподібного білка кінази змішаної лінії (MLKL) і утворення RIPK1-RIPK3-MLKL, який називають некросомою. Дослідження ішемічно-реперфузійного пошкодження міокарда (ІРПМ) показало, що RIPK3 також може опосередковувати Ca 2+ -кальмодулін-залежну протеїнкіназу II (CaMK II), сприяючи відкриттю mPTP і некроптозу. Таким чином, активність каспази і взаємодія між RIPK1 і RIPK3 визначають активацію апоптозу або некроптозу.
Шлях PINK1-Parkin є важливим шляхом для ініціації мітофагії та відіграє важливу роль у некроптозі. Коли мітохондрії піддаються впливу несприятливих зовнішніх подразників, PINK1 може фосфорилювати убіквітин і паркін, тим самим активуючи петлю позитивного зворотного зв’язку для мітофагії. За відсутності такої активації сильно пошкоджені мітохондрії генеруватимуть надмірну кількість АФК, тим самим пригнічуючи АТФ і призводячи до некроптозу. АМФПК може фосфорилювати Parkin для інгібування утворення некросом через убіквітований RIPK3.
Хоча мітофагія, як правило, відбувається до розвитку некроптозу, ці процеси мають певні спільні регуляторні елементи у витоків процесу та перекриваючі ключові молекули. Надмірна активація мітофагії може посилити некроптоз через такі процеси, як безперервне відкриття mPTP, надлишок АФК і недостатній синтез АТФ. Дослідження лікування, націленого на ці молекули, може сприяти покращенню прогнозу пацієнтів з ІРПЗС.
Помірна мітофагія має максимальну ефективність у нейропротекції ІРПЗС
Хоча теорія про те, що мітофагія полегшує пошкодження ІРПЗС після CA, є загальновизнаною, надмірна мітофагія також може зменшити виробництво АТФ та енергію і посилення загибелі клітин. Ремапікрозид і нарингін можуть захищати від ІРПЗС, впливаючи на звичайний ONOO-опосередкований шлях у мітофагії, а декспраміпексол і MiR-302a-3p, як було показано, мають терапевтичний ефект при ІРПМ шляхом пригнічення надмірної мітофагії. Врахування етіології, супутніх захворювань, тяжкості захворювання та очікуваного результату для людей, а також уточнення типу моделі захворювання тварин є важливими при виборі планів втручання для мітофагії. Динамічний моніторинг прогностичних показників необхідний для вчасного регулювання планів втручання щодо мітофагії. Крім того, вивчення специфічного молекулярного механізму мітофагії адапторів і взаємозв’язку між різними шляхами є важливим для радикального досягнення помірної мітофагії.
Висновок і перспективи
Високі показники смертності та інвалідності, пов'язані з CA, тісно пов'язані з ІРПЗС. Мітохондріальна дисфункція відіграє вирішальну роль у механізмі та лікуванні ІРПЗС після CA, і мітофагія привертає все більше уваги як ключова ланка між двома станами. Мітофагія зазвичай відбувається перед некроптозом, і необхідно отримати глибше розуміння балансу між цими двома важливими клітинними метаболічними процесами. Тяжкість ДМЗС тісно пов’язана з ранньою смертністю пацієнтів з ЗС, і, отже, регулювання експресії мітофагії може покращити надання медичної допомоги та виживання пацієнтів.
ДЖЕРЕЛО: www.sciencedirect.com
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Клінічний випадок: Пацієнт з болем у яєчка ...

Поширення коронавірусної інфекції COVID-19 ...

Американський Центр з контролю захворювань ...

Літня небезпека лептоспірозу

Досягнення цільового рівня уратів у сирова ...

Рівень біологічних маркерів запалення (IL+ ...


