Клінічна настанова: Бронхіальна астма: оновлення GINA 2025 (частина 2) Принципи ведення
Дата публікації: 27.05.2025
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: лікування, бронхіальна астма, статті Аксемедін, GINA, Бронхіальна астма

Принципи ведення бронхіальної астми в дорослих, підлітків і дітей віком 6–11 років
Співпраця між пацієнтом і медичним працівником
Ефективне ведення бронхіальної астми потребує партнерських взаємин між особою з астмою (або батьками/опікунами дитини) та медичними працівниками. Навчання медиків навичкам ефективної комунікації може сприяти підвищенню задоволеності пацієнтів, поліпшенню результатів лікування та зменшенню навантаження на систему охорони здоров’я.
При веденні пацієнта варто враховувати рівень його обізнаності щодо власного здоров’я — здатність отримувати, сприймати та розуміти базову медичну інформацію для прийняття зважених рішень щодо лікування (медична грамотність).
Також рекомендуємо прочитати першу частину: Клінічна настанова: Бронхіальна астма: оновлення GINA 2025 (частина 1)
Мета ведення бронхіальної астми
Основна мета — досягнення найкращих довгострокових результатів у кожного пацієнта. Це включає стабільний контроль симптомів (відсутність або мінімальні прояви, спокійний сон, можливість звичної фізичної активності) та мінімізацію ризиків — загострень, ускладнень, обмеження бронхіальної прохідності або побічних ефектів лікування. Важливо також враховувати особисті цілі пацієнта.
Ремісія бронхіальної астми
У частини дітей і дорослих можлива ремісія — як клінічна, так і повна, із застосуванням лікування або без нього. Поняття клінічної ремісії на фоні терапії узгоджується з довгостроковою метою ведення астми — досягнення оптимального контролю стану.
Дослідження пацієнтів, які досягли або не досягли ремісії, дають змогу краще зрозуміти механізми захворювання і шукати нові підходи до профілактики та терапії. Для цього важливе використання уніфікованих критеріїв оцінки.
Слід бути обережним із використанням терміну «ремісія» під час спілкування з пацієнтами або батьками/опікунами, оскільки він може асоціюватися з одужанням або з онкологічними захворюваннями. Потрібно чітко пояснити, що навіть при тривалій відсутності симптомів вони можуть знову з’явитися.
Прийняття рішень щодо лікування астми
Терапія коригується циклічно: оцінка — лікування — аналіз відповіді. Оцінюються як контроль симптомів, так і ризики в майбутньому (загострення, побічні ефекти). Також важливі індивідуальні вподобання пацієнта.
На рівні системи охорони здоров’я (наприклад, національні настанови чи страхові компанії) рекомендовані схеми лікування на Кроках 1–4 є найкращими для більшості пацієнтів, ґрунтуючись на результатах клінічних досліджень та аналізів ефективності. Для Кроків 1–5 існують різні рекомендації залежно від віку (дорослі/підлітки, діти 6–11 років, діти до 5 років). На Кроці 5 враховується також запальний фенотип.
Для конкретного пацієнта важливо приймати рішення разом — з урахуванням індивідуальних особливостей (наприклад, фенотипу астми), чинників довкілля, які можуть впливати на ризик загострень або ефективність лікування, а також побажань, техніки інгаляції, прихильності до лікування, доступності препаратів і вартості.
Оптимізація ведення астми
Слід прагнути до оптимального контролю захворювання за допомогою інгаляційної терапії та нефармакологічних заходів, аби зменшити потребу в системних глюкокортикостероїдах (ГКС) і пов’язані з ними побічні ефекти.
Перегляньте записи:
Партнерство між пацієнтом і медичним працівнико
Ефективне ведення бронхіальної астми неможливе без формування партнерських взаємин між пацієнтом (або батьками/опікунами у разі дітей) та медичними працівниками. Така співпраця має допомогти пацієнтові набути знань, впевненості та навичок для активної участі в контролі над своєю хворобою. Освітні програми з самостійного ведення астми достовірно знижують рівень ускладнень як у дорослих, так і в дітей.
Участь пацієнта у прийнятті рішень щодо лікування покращує результати терапії. Пацієнтам і опікунам слід надавати можливість висловлювати свої очікування, занепокоєння та брати активну участь у виборі лікувальної тактики. Таке партнерство має бути індивідуалізованим, оскільки здатність і готовність до самостійного контролю над хворобою залежать від багатьох чинників: етнічного походження, рівня освіти, медичної грамотності, сприйняття хвороби, ставлення до ліків, прагнення до автономії та особливостей системи охорони здоров'я.
Якусна комунікація
Добра комунікація з боку медичних працівників — основа позитивних клінічних результатів. Навчання лікарів ефективним стратегіям спілкування сприяє зростанню задоволеності пацієнтів, кращому контролю хвороби та зменшенню звернень до медичних закладів, не подовжуючи час консультації. Також покращується дотримання пацієнтами призначеного лікування.
Не менш важливо навчати самих пацієнтів — як правильно доносити інформацію про свій стан, ставити запитання та перевіряти розуміння отриманих порад. Це теж допомагає посилити прихильність до лікування.
Ключові стратегії ефективної комунікації:
- Дружній, відкритий стиль спілкування з використанням гумору та уважністю до потреб пацієнта.
- Надання можливості пацієнту розповісти про свої цілі, переконання та тривоги.
- Вияв емпатії, швидке реагування на занепокоєння пацієнта.
- Підтримка та підбадьорення.
- Надання персоналізованої, доступної інформації.
- Регулярний зворотний зв’язок і перегляд тактики лікування.
Як мінімізувати наслідки низької медичної грамотності:
- Викладайте інформацію у порядку важливості — від найважливішого до другорядного.
- Говоріть повільно та простою мовою, уникайте медичних термінів.
- Спрощуйте числову інформацію — замість відсотків використовуйте конкретні числа.
- Ілюструйте пояснення прикладами, малюнками, схемами або таблицями.
- Перевіряйте розуміння через метод «повторіть, будь ласка»: попросіть пацієнта повторити рекомендації своїми словами.
- Залучайте другого співрозмовника — медсестру або родича, щоб він теж почув основні поради.
- Звертайте увагу на невербальні сигнали — пацієнт може не озвучити нерозуміння.
- Заохочуйте до запитань, створюйте безпечну атмосферу.
Ремісія бронхіальної астми
Ремісію бронхіальної астми досліджують вже тривалий час, переважно у контексті дитячої астми без лікування. Визначення та критерії ремісії відрізняються, однак зазвичай мова йде про:
- клінічну ремісію — відсутність симптомів астми або загострень протягом певного періоду;
- повну (патофізіологічну) ремісію — додатково включає нормальні показники функції легень, відсутність гіперреактивності дихальних шляхів та запальних змін.
Зростає інтерес до ремісії як без лікування, так і на тлі терапії, зокрема із застосуванням біологічних препаратів при тяжкій астмі. Поняття клінічної ремісії на фоні лікування узгоджується з довгостроковою метою контролю астми — досягнення найкращих результатів для пацієнта. Під час обговорення очікуваних результатів слід враховувати:
- індивідуальні цілі пацієнта;
- фенотип астми;
- клінічні особливості та супутні захворювання;
- чинники ризику, включно з вираженістю обмеження повітряного потоку;
- доступність і вартість препаратів;
- потенційні побічні ефекти лікування.
Дослідження ремісії — як клінічної, так і повної — за наявності або відсутності лікування відкриває можливості для розуміння різноманітних механізмів розвитку астми та створення нових підходів до профілактики й терапії. Використання стандартизованих критеріїв і методів сприятиме прогресу в цій сфері.
Перегляньте запис:

Ремісія дитячої астми
Рівень ремісії у дітей без лікування варіює залежно від методики дослідження та тривалості спостереження. Наприклад, у деяких дослідженнях понад половини дітей дошкільного віку з епізодами хрипів не мали симптомів до 6 років, тоді як у старшому віці лише незначна частина зберігає повну відсутність хрипів.
Клінічна ремісія зустрічається частіше, ніж повна патофізіологічна, у всіх вікових групах.
Фактори, що сприяють ремісії у шкільному віці:
- рідкісні або м’які симптоми;
- покращення функції легень;
- зниження гіперреактивності дихальних шляхів.
Фактори ризику персистенції астми:
- атопія;
- спадковість (астма або алергія в одного з батьків);
- пізній початок симптомів;
- хрипи поза межами інфекцій;
- вплив тютюнового диму.
Ремісія не є одужанням: після безсимптомного періоду у дитинстві або підлітковому віці астма часто повертається в дорослому житті. Особи з ремісією в дитинстві мають підвищений ризик прискореного зниження функції легень у дорослому віці, що посилюється при курінні, і можуть зіткнутися з персистентним обмеженням повітряного потоку.
Наразі немає підтверджених методів, що дозволяють збільшити ймовірність ремісії у дитячому віці або знизити ризик рецидиву. Проте, інгаляційні кортикостероїди значно зменшують тягар хвороби, знижують кількість пропусків школи, покращують участь у фізичних активностях і зменшують ризик госпіталізацій.
Що важливо говорити батькам:
- Якщо симптомів немає, перевірити, чи зберігаються ознаки захворювання (наприклад, уникання активності, хрипи).
- Використовувати обережні формулювання на кшталт «астма наразі стихла».
- Пояснити, що навіть при зникненні симптомів можливе повернення хвороби.
- Наголошувати на користі підтримувальної терапії для поточного стану здоров’я дитини, не обіцяючи запобігання астмі в майбутньому.
Дослідницькі питання включають:
- чинники, що впливають на ремісію та рецидив;
- вплив заходів профілактики;
- значення моніторингу після ремісії;
- можливість зниження ризику персистуючого обмеження повітряного потоку.
Ремісія астми в дорослих
Клінічна або повна ремісія без лікування у дорослих можлива — іноді спонтанно, іноді після припинення контролюючої терапії. Наприклад, близько 16% осіб із астмою дорослого типу досягли ремісії протягом 5 років. Також ремісія можлива після припинення контакту з шкідливими чинниками при професійній астмі.
Проте, навіть у разі відсутності симптомів, запалення або гіперреактивність дихальних шляхів часто зберігаються. Ремісія у дорослому віці частіше настає у тих, хто мав астму з дитинства, ніж у випадку її появи у дорослому віці.
Останніми роками зростає інтерес до ремісії на фоні лікування, особливо за допомогою біологічної терапії при тяжкій астмі. Критерії клінічної ремісії можуть включати:
- відсутність симптомів та загострень;
- відмову від системних кортикостероїдів;
- стабільну або покращену функцію легень протягом тривалого періоду.
Для повної ремісії додатково розглядають нормалізацію запальних маркерів і чутливості дихальних шляхів.
Фактори, що асоціюються з досягненням ремісії на фоні терапії:
- добрий контроль симптомів на початку лікування;
- вища функція легень;
- менше супутніх захворювань;
- ранній початок астми;
- відсутність або низька доза системних кортикостероїдів.
Хоча тема найбільше вивчена для пацієнтів із тяжкою астмою, концепція ремісії актуальна для осіб із будь-яким ступенем тяжкості захворювання — включаючи тих, хто отримує інгаляційні засоби, таблетки, імунотерапію чи немедикаментозні втручання (наприклад, зміна способу життя).
Пацієнтам варто пояснити:
- термін «ремісія» у медицині означає зниження проявів хвороби, а не повне одужання;
- не слід самостійно припиняти прийом ліків, навіть при доброму самопочутті.
Перегляньте запис:
Перспективи досліджень
Для дорослих дослідницький інтерес зосереджений на:
- вивченні зв’язку між клінічними критеріями ремісії та біомаркерами, результатами візуалізації чи гістології;
- ідентифікації предикторів довготривалої ремісії або рецидиву;
- розробці валідованих критеріїв ремісії на фоні терапії.
Індивідуалізоване управління астмою на основі контролю
Контроль над астмою охоплює два основні аспекти: контроль симптомів і зменшення ризику ускладнень. Сучасний підхід до ведення пацієнтів передбачає безперервний цикл: оцінювання контролю та факторів ризику, корекцію лікування, а також регулярний перегляд стану пацієнта кваліфікованими фахівцями. Метою є досягнення оптимальних довгострокових результатів лікування.
Запровадження стратегій управління астмою, заснованих на рівні контролю, довело свою ефективність у покращенні клінічних результатів. У клінічних дослідженнях зміни в терапії пацієнтам призначалися на основі недостатнього контролю симптомів або наявності додаткових факторів ризику — знижених показників функції легень або епізодів загострень.
З 2014 року особлива увага приділяється персоналізованому підходу. Він враховує не лише симптоми, але й модифіковані фактори ризику, інші супутні захворювання, а також переваги та цілі самого пацієнта. Водночас, немодифіковані фактори ризику, як-от госпіталізація в реанімацію через астму, також повинні фіксуватися.
Для більшості пацієнтів, особливо в умовах первинної ланки медичної допомоги, добрий контроль симптомів часто відповідає низькому ризику загострень. Завдяки впровадженню інгаляційних кортикостероїдів, було досягнуто значних покращень: зменшення симптомів, покращення функції легень, зниження частоти загострень і смертності.
Однак навіть у пацієнтів з рідкими симптомами можуть виникати тяжкі загострення. А в інших, попри добрий контроль симптомів, загострення все одно можливі. Крім того, постійне збільшення доз інгаляційних кортикостероїдів не завжди доцільне через ризик побічних ефектів.
Тому в рамках індивідуалізованого підходу важливо одночасно враховувати обидва компоненти контролю — наявність симптомів і ризик ускладнень у майбутньому — як при виборі терапії, так і під час подальших спостережень.
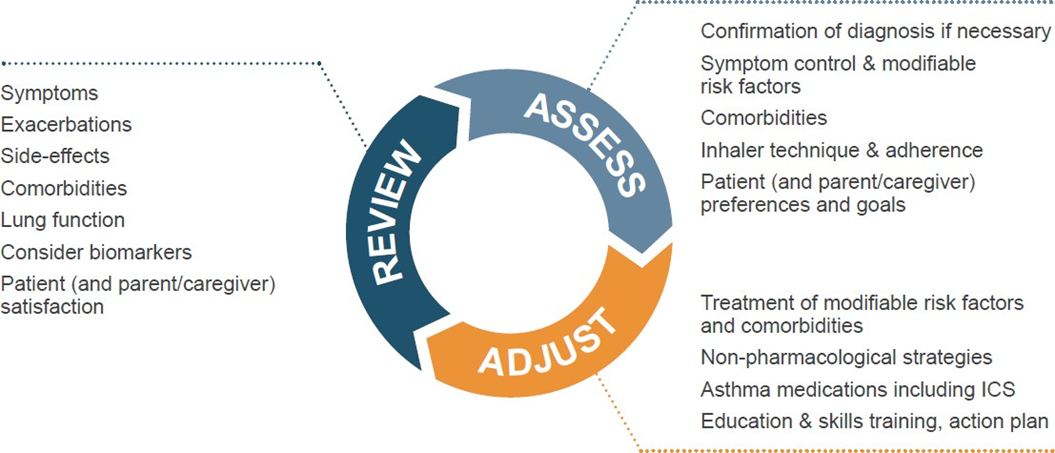
Персоналізоване управління астмою ґрунтується на безперервному циклі, що включає оцінювання, корекцію лікування та перегляд стану пацієнта:
Оцінка
- Аналізуйте контроль симптомів і наявність факторів ризику загострень, погіршення функції легень і побічних ефектів від ліків.
- Особливу увагу приділяйте техніці інгаляції та дотриманню режиму лікування.
- Оцініть супутні захворювання, особисті цілі й уподобання пацієнта.
- За потреби — підтвердьте діагноз астми.
Корекція
- Виходячи з результатів оцінки, адаптуйте план лікування.
- Це включає роботу з модифікованими факторами ризику, лікування супутніх станів, застосування немедикаментозних підходів, освітніх заходів і навчання навичкам самоконтролю.
- За потреби — змінюйте медикаментозну терапію.
- Для дорослих і підлітків на всіх етапах лікування рекомендованим є поєднання інгаляційного кортикостероїду з формотеролом як контролер і як препарат швидкої дії (див. Трек GINA 1).
Перегляд
- Перевіряйте стан пацієнта відповідно до цілей лікування.
- Повторно оцінюйте фактори, що впливають на симптоми, ризик ускладнень, задоволення пацієнта лікуванням.
- Якщо астма залишається неконтрольованою — розгляньте визначення біомаркерів типу 2.
- У разі потреби призначайте додаткові обстеження та повторно коригуйте лікування
Вибір лікування: популяційний та індивідуальний підходи
На кожному етапі ведення астми доступні альтернативні медикаментозні схеми, які можуть забезпечити контроль хвороби, хоча їхня ефективність може відрізнятися.
Популяційні рішення (наприклад, ті, що приймаються на рівні національних формулярів або страховими організаціями) спрямовані на вибір оптимального варіанту для більшості пацієнтів. На кожному етапі запропоновані переважні схеми лікування, які мають найкраще співвідношення ефективності та безпеки для контролю симптомів і зниження ризику загострень. Вибір таких схем базується на даних досліджень ефективності та реальної клінічної практики, із додатковим урахуванням безпеки та вартості.
На п’ятому етапі лікування призначення залежить ще й від типу запального процесу, що переважає у конкретного пацієнта.
Індивідуальний підхід при цьому дозволяє адаптувати загальні рекомендації до конкретної клінічної ситуації — враховуючи анамнез, співіснуючі захворювання, соціальні обставини, доступність ліків і побажання пацієнта.

Мінімізація побічних ефектів медикаментозного лікування
Щоб зменшити ризик локальних і/або системних побічних реакцій при застосуванні інгаляційних препаратів, рекомендується:
- обирати лікувальну стратегію, яка дозволяє використовувати менші дози інгаляційних кортикостероїдів (ІКС), за умови її наявності та відповідності стану пацієнта;
- навчити пацієнта правильно користуватися інгалятором, зокрема із застосуванням спейсеру для ІКС, що вводяться за допомогою дозованого інгалятора;
- нагадувати пацієнтам про необхідність полоскати рот і спльовувати рідину після використання ІКС;
- після досягнення стабільного контролю над астмою протягом щонайменше трьох місяців — підібрати мінімально ефективну дозу терапії, що містить ІКС (тобто найменшу дозу, яка, у поєднанні з планом дій, забезпечує хороший контроль симптомів і мінімізує ризик загострень);
- перевіряти можливі лікарські взаємодії, особливо за участю інгібіторів ферментів системи цитохрому P450.
Для зниження потреби в системних глюкокортикостероїдах, які мають широкий спектр кумулятивних побічних ефектів, необхідно оптимізувати інгаляційну терапію. Зокрема, доцільно переходити на схеми лікування, які включають протизапальний препарат швидкої дії, якщо такі доступні. Такий підхід значно знижує ризик тяжких загострень порівняно з використанням лише бронходилататора короткої дії. Комбіноване застосування підтримуючої терапії та препарату швидкої дії також ефективніше запобігає загостренням, ніж еквівалентна або вища доза ІКС, ІКС у поєднанні з бронходилататором тривалої дії, або стандартне лікування.
Крім того, важливо виявляти та лікувати модифіковані фактори ризику, а також супутні захворювання, адже це також може зменшити ризик загострень і необхідність у системних стероїдах.
Управління іншими модифікованими факторами ризику
Деякі пацієнти продовжують мати загострення навіть за умови максимальної терапії відповідно до поточних рекомендацій. Навіть одне загострення значно підвищує ймовірність повторного епізоду протягом наступного року.
Зростає зацікавленість науковців у виявленні пацієнтів із підвищеним ризиком, а також у розробці нових підходів до подальшого зниження частоти загострень.
У клінічній практиці ризик загострень можна зменшити не лише за допомогою оптимізації медикаментозного лікування, а й шляхом своєчасного виявлення та корекції модифікованих факторів ризику. Варто пам’ятати, що не всі фактори ризику потребують або піддаються корекції за допомогою підвищення дози базисної терапії.
Таблиця 1. Лікування потенційно модифікованих факторів ризику для зниження загострень та мінімізації застосування системних кортикостероїдів (ОКС)
|
Фактор ризику |
Стратегія лікування |
Рівень доказовості |
|
Будь-який пацієнт з одним або більше факторами ризику загострень (включно з поганим контролем симптомів) |
- Призначити лікування, що містить інгаляційні глюкокортикостероїди (ІГКС). |
A |
|
|
- Перейти на режим з протизапальним препаратом-рятувальником (ІГКС-формотерол або ІГКС-САБА), якщо доступно, оскільки це знижує ризик тяжких загострень порівняно з САБА. |
A |
|
|
- Забезпечити пацієнта письмовим планом дій, адаптованим до рівня його здорової грамотності. |
A |
|
|
- Проводити частіший огляд пацієнта, ніж у випадку з низькоризиковими пацієнтами. |
A |
|
|
- Часто перевіряти техніку використання інгалятора та дотримання лікування; коригувати за потреби. |
A |
|
|
- Виявляти та лікувати потенційно модифіковані фактори ризику. |
D |
|
≥1 тяжке загострення протягом останнього року |
- Перейти на режим з протизапальним препаратом-рятувальником (як потрібно ІГКС-формотерол або ІГКС-САБА), якщо доступно, оскільки це знижує ризик тяжких загострень порівняно з САБА. |
A |
|
|
- Якщо немає модифікованих факторів ризику, розглянути підвищення лікування (наприклад, додавання ЛАМА, збільшення дози ІГКС, особливо при підвищених біомаркерах типу 2); направити до спеціаліста для консультації та розгляду біологічної терапії. |
A |
|
|
- Виявляти та контролювати уникаємі тригери загострень. |
C |
|
Куріння чи вплив електронних сигарет |
- Заохочувати відмову від куріння пацієнтом та членами родини; надавати консультації та ресурси. |
A |
|
|
- Розглянути збільшення дози ІГКС, якщо астма погано контрольована. |
B |
|
Низький ОФВ1, особливо <60% від прогнозованого |
- Вирішувати проблеми з дотриманням лікування та технікою інгаляції. |
A |
|
|
- Розглянути пробне лікування високою дозою ІГКС протягом 3 місяців. |
B |
|
|
- Виключити інші захворювання легень, наприклад ХОЗЛ. |
D |
|
|
- Направити до експерта у разі відсутності покращення. |
D |
|
Ожиріння |
- Надати стратегії зниження ваги. |
B |
|
|
- Відрізняти симптоми астми від симптомів, пов’язаних з декондиціонуванням, механічним обмеженням або синдромом обструктивного апное сну. |
D |
|
Важкі психологічні проблеми |
- Направити пацієнта на оцінку та лікування психічного здоров’я. |
D |
|
|
- Допомогти відрізнити симптоми тривоги від симптомів астми; надати рекомендації щодо контролю панічних атак. |
D |
|
Важкі соціально-економічні проблеми |
- Визначити найбільш економічно вигідний режим ІГКС на основі місцевих цін. |
D |
|
|
- Оптимізувати техніку використання інгалятора для максимального ефекту від доступних ліків. |
D |
|
Підтверджена харчова алергія |
- Уникати відповідних продуктів; мати план дій при анафілаксії; наявність ін’єкційного адреналіну; направлення до спеціаліста. |
A |
|
Вплив виробничих або домашніх подразників |
- Якнайшвидше усунути контакт з подразниками. |
A |
|
|
- Якнайшвидше направити до експерта. |
D |
|
Контакт з алергеном при сенсибілізації |
- Розглянути прості стратегії уникнення, якщо є докази їх ефективності; врахувати вартість. |
C |
|
|
- Розглянути підвищення лікування астми, якщо уникнення неможливе. |
D |
|
|
- Розглянути додавання під’язикової алерген-специфічної імунотерапії (СЛІТ) у симптоматичних дорослих або підлітків із частково контрольованою астмою, за умови, що ОФВ1 >70% від прогнозованого. |
A |
|
Високий FeNO при прийомі середніх/високих доз ІГКС |
- Перевірити та покращити дотримання лікування; при неконтрольованій астмі за високої дози ІГКС-ЛABA спостерігалося пригнічення FeNO після безпосереднього контролю прийому кортикостероїдів у двох третинах пацієнтів, що пов’язано з попереднім поганим дотриманням та покращенням результатів при подальшому дотриманні. |
A |
|
Еозинофілія в мокротинні незважаючи на середні/високі дози ІГКС (обмежена кількість центрів) |
- Розглянути збільшення дози ІГКС незалежно від рівня контролю симптомів. |
A |
Таблиця 2. Нефармакологічні стратегії
|
Інтервенція |
Рекомендації |
Рівень доказовості |
|
Відмова від куріння, уникнення тютюнового диму та вейпінгу |
- На кожному візиті наполегливо заохочувати людей з астмою, які курять або вейплять, кинути це. Забезпечити доступ до консультацій і програм відмови від куріння (за наявності). |
A |
|
|
- Радити батькам/опікунам дітей з астмою не курити і не вейпити, а також не дозволяти це у кімнатах чи автомобілях, де перебувають діти. |
A |
|
|
- Наполегливо рекомендувати уникати впливу пасивного тютюнового диму. |
B |
|
|
- Оцінювати курців/колишніх курців на наявність ХОЗЛ або ознак поєднання астми і ХОЗЛ (астма+ХОЗЛ), оскільки можуть знадобитися додаткові лікувальні стратегії. |
D |
|
Фізична активність |
- Заохочувати регулярну фізичну активність для загального покращення здоров’я. |
A |
|
|
- Давати рекомендації щодо профілактики бронхоконстрикції при фізичному навантаженні: застосування низьких доз ICS-формотеролу за потребою і перед тренуванням або регулярне застосування ICS. |
A/B |
|
|
- Поради щодо попередження пробою бронхоконстрикції: розминка перед навантаженням; застосування SABA (або ICS-SABA) перед навантаженням; низькі дози ICS-формотеролу перед навантаженням. |
A, A, B |
|
|
- Регулярна фізична активність покращує кардіореспіраторну витривалість і може трохи покращити контроль астми та функцію легень (включно з плаванням у молодих пацієнтів). |
B |
|
|
- Фізична активність у дорослих з помірною/важкою астмою покращує симптоми та якість життя. |
A |
|
|
- Неможливо рекомендувати конкретну форму фізичної активності як кращу для астматиків. |
D |
|
Програми легеневої реабілітації |
- Структуровані амбулаторні програми легеневої реабілітації покращують функціональну здатність (тест 6-хвилинної ходьби) та якість життя. |
A |
|
Уникнення професійного або домашнього впливу алергенів/роздратників |
- Запитувати пацієнтів з астмою дорослого віку про роботу та інші впливи подразників, включаючи домашні. |
D |
|
|
- При професійній астмі визначати і усувати професійні сенсибілізатори якомога раніше, усувати пацієнта від подальшого впливу. |
A |
|
|
- Пацієнтів із підозрою або підтвердженою професійною астмою швидко направляти до фахівців для оцінки і консультації. |
A |
|
Уникнення медикаментів, які погіршують астму |
- Завжди запитувати про астму перед призначенням НПЗП, радити припинити їх використання при погіршенні астми. |
D |
|
|
- Завжди запитувати про супутні медикаменти у людей з астмою. |
D |
|
|
- Аспірин і НПЗП не є абсолютними протипоказаннями, якщо немає історії алергічних реакцій. |
A |
|
|
- Призначення пероральних або очних бета-блокаторів приймати індивідуально, під наглядом спеціаліста. |
D |
|
|
- При гострих коронарних подіях кардіоселективні бета-блокатори не є абсолютним протипоказанням, треба зважувати ризики/користь. |
D |
|
Здорова дієта |
- Заохочувати вживання великої кількості фруктів і овочів для загального покращення здоров’я. |
A |
|
Уникнення внутрішньолегкових алергенів |
- Уникнення алергенів не рекомендоване як загальна стратегія при астмі. |
A |
|
|
- Для сенсибілізованих пацієнтів обмежена користь від односпрямованого уникнення алергенів у більшості випадків. |
A |
|
|
- Усунення вологи чи цвілі в будинку зменшує симптоми астми і використання ліків у дорослих. |
A |
|
|
- Для пацієнтів, чутливих до пилового кліща або тварин, обмежена користь від уникнення (тільки у дітей). |
B |
|
|
- Стратегії уникнення алергенів складні, дорогі, без валідованих методів ідентифікації пацієнтів, які б виграли. |
D |
|
Зниження ваги |
- Включати зниження ваги у план лікування для пацієнтів з астмою та ожирінням. |
B |
|
|
- Для дорослих з астмою ожирінням ефективніше поєднувати зниження ваги з дворазовими аеробними та силовими вправами на тиждень. |
B |
|
|
- Найкращі покращення спостерігаються після баріатричної хірургії. |
A |
|
Дихальні вправи |
- Можуть бути корисним доповненням до фармакотерапії для покращення симптомів та якості життя, але не знижують ризик загострень і не впливають стабільно на функцію легень. |
A |
|
Уникнення внутрішнього забруднення повітря |
- Заохочувати використання непалючих джерел опалення та приготування їжі, а також виведення забруднювачів назовні, якщо можливо. |
B |
|
Уникнення зовнішніх алергенів |
- Для сенсибілізованих пацієнтів у період високого рівня пилку чи плісняви рекомендувати закривати вікна, залишатися в приміщенні, використовувати кондиціонери (залежно від доступності додатків або попереджень). |
D |
|
Подолання емоційного стресу |
- Заохочувати пацієнтів визначати цілі та стратегії подолання стресу, якщо він погіршує астму. |
D |
|
|
- Недостатньо доказів для вибору конкретної стратегії зниження стресу, але корисні релаксація і дихальні вправи. |
B |
|
|
- Направляти на оцінку психічного здоров’я при симптомах тривоги чи депресії. |
D |
|
Вирішення соціальних ризиків |
- У США комплексні інтервенції щодо соціальних ризиків асоціюються зі зменшенням звернень до швидкої допомоги і госпіталізацій у дітей. Дані з інших країн потрібні. |
A |
|
Уникнення зовнішніх забруднювачів і несприятливих погодних умов |
- При несприятливих умовах (холод, висока забрудненість повітря) рекомендується залишатися в контрольованому кліматі, уникати інтенсивного фізичного навантаження і забруднених місць, особливо під час вірусних інфекцій. |
D |
|
Уникнення продуктів харчування і харчових добавок |
- Уникнення харчових продуктів не рекомендується без підтвердженої алергії або чутливості, зазвичай шляхом контрольованих оральних провокацій. |
D |
|
|
- Пацієнтів з підтвердженою харчовою алергією направляти до фахівців. |
D |
|
|
- Для таких пацієнтів уникнення алергенів може знизити частоту загострень астми. |
D |
|
|
- При харчовій хімічній чутливості повне уникнення зазвичай не потрібне, а чутливість знижується при покращенні контролю астми. |
D |
Найголовніше
- Куріння і пасивний дим значно погіршують астму, збільшують ризик ускладнень і смерті. Відмова від куріння обов’язкова.
- Фізична активність потрібна і корисна, але треба вчасно профілактувати бронхоспазм інгаляційними ліками.
- Пульмонологічна реабілітація покращує якість життя і витривалість, особливо при тяжких порушеннях дихання.
- Уникнення професійних алергенів — ключ до контролю астми у працівників із професійною астмою.
- Комплексне уникнення домашніх алергенів може бути корисним, але одиночні заходи часто неефективні.
- Здорова дієта та контроль ваги покращують контроль астми.
- Дихальні вправи допомагають зменшити симптоми та покращити якість життя.
- Уникати препаратів і факторів, що погіршують астму (ацетисаліцилова кислота у чутливих, бета-блокатори, забруднене повітря, стрес).
Ліки та схеми лікування для дорослих, підлітків і дітей 6–11 років — Основні положення
Для безпеки GINA не рекомендує лікування астми у дорослих, підлітків або дітей 6–11 років тільки короткодіючими бета2-агоністами (SABA). Натомість пацієнти повинні отримувати лікування, що містить інгаляційні кортикостероїди (ІКС), щоб зменшити ризик важких загострень і контролювати симптоми.
ІКС можна застосовувати або регулярно щодня, або, у дорослих і підлітків з рідкісними симптомами астми та нормальною або злегка зниженою функцією легень, за потребою низькодозовий ІКС-формотерол для полегшення симптомів. Для дітей, які не можуть регулярно приймати ІКС, його можна застосовувати разом із використанням SABA.
Запобігання важким загостренням — пріоритет на всіх етапах лікування, щоб зменшити ризик для пацієнтів і навантаження на систему охорони здоров’я, а також знизити потребу у прийомі пероральних кортикостероїдів (ПКС), які мають кумулятивні довготривалі побічні ефекти.
Таблиці низьких, середніх і високих доз ІКС не означають еквівалентної потужності препарату. При переході з одного препарату на інший слід контролювати стабільність астми.
Перегляньте записи:
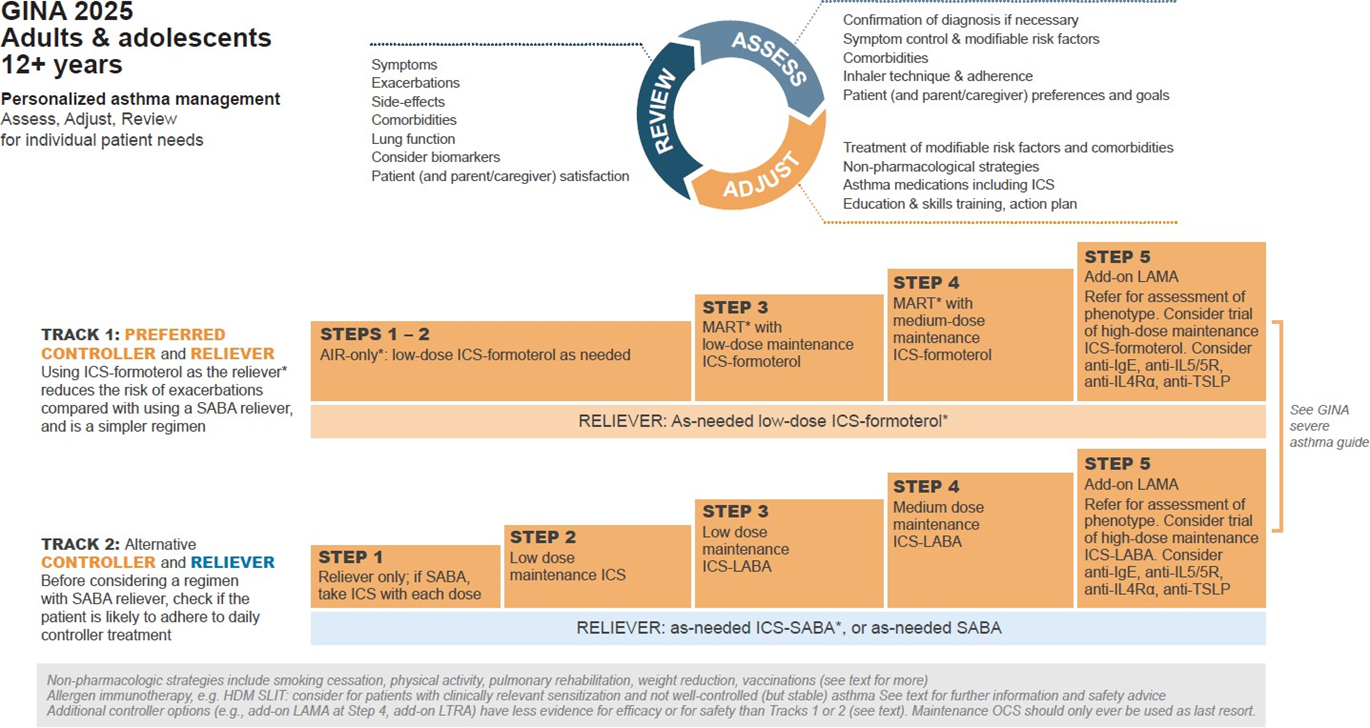
Схеми лікування для дорослих і підлітків
Для зручності GINA пропонує дві основні «траєкторії» лікування, які відрізняються вибором препарату для зняття симптомів (рятівника):
Траєкторія 1: Вибір — низькодозовий ІКС-формотерол. Це рекомендований варіант. Пацієнт використовує ІКС-формотерол за потребою для зняття симптомів. На кроках 3–5 лікування цей препарат також застосовується регулярно щодня. Такий підхід знижує ризик важких загострень порівняно із застосуванням тільки SABA, при цьому контроль симптомів не гірший, і лікування простіше — одна інгаляція замість декількох.
Траєкторія 2: Вибір — SABA або комбінація ІКС-SABA. Це альтернативний варіант, якщо Траєкторія 1 неможлива або пацієнт стабільний і добре дотримується лікування. На кроці 1 пацієнт використовує SABA і низькодозовий ІКС разом (комбінація або ІКС після SABA). На кроках 2–5 рятівником є SABA або ІКС-SABA. Погана прихильність до ІКС збільшує ризик загострень через фактичне лікування тільки SABA.
Кроки 1 і 2 для дорослих і підлітків
Траєкторія 1 (кроки 1–2): Лікування низькодозовим ІКС-формотеролом за потребою значно знижує ризик важких загострень і госпіталізацій порівняно з лікуванням тільки SABA. Порівняно з щоденним ІКС, цей режим також знижує ризик звернень до лікарні без погіршення контролю симптомів.
Траєкторія 2: Регулярне застосування низькодозового ІКС з SABA за потребою ефективно знижує симптоми і ризик загострень порівняно з лікуванням тільки SABA. Однак прихильність до ІКС у реальному житті часто низька, що збільшує ризик загострень через фактичне застосування лише SABA. Для пацієнтів із рідкісними симптомами і дуже низькою прихильністю краще використовувати ІКС-SABA за потребою.
Підвищення ступеня лікування
Перед підвищенням ступеня лікування слід підтвердити, що симптоми справді викликані астмою, і усунути проблеми з технікою інгаляції, прихильністю, алергенами та супутніми захворюваннями; надати пацієнту освіту.
Переважний варіант кроку 3 — Траєкторія 1 із низькодозовим ІКС-формотеролом як підтримувальна і рятівна терапія (MART). Це знижує ризик важких загострень і забезпечує не гірший контроль симптомів, ніж стандартне лікування ІКС + ЛАБА та SABA за потребою.
Зниження ступеня лікування
Після стабільного контролю симптомів протягом 2–3 місяців слід поступово знижувати дозу до мінімальної, що зберігає контроль симптомів і запобігає загостренням.
Пацієнтам слід надати письмовий план дій, регулярно контролювати стан і проводити спостереження.
Вибір інгалятора
Після вибору класу препарату інгалятор підбирають за доступністю, умінням пацієнта користуватися і впливом на навколишнє середовище. Техніку інгаляції потрібно часто перевіряти і тренувати.
Самоконтроль і навчання
Пацієнтам рекомендується навчання самоконтролю симптомів або ПШВ (пікової швидкості видиху), мати письмовий план дій і регулярно проходити медичні огляди.
Пацієнти з підвищеним ризиком загострень
Для них слід призначати ІКС-лікування, переважно Траєкторія 1, надавати план дій і частіше проводити огляди. Важливо усувати змінні фактори ризику (куріння, низька функція легень, надмірне використання SABA).
Важка і складна астма
Пацієнтів із поганим контролем або частими загостреннями при середніх і високих дозах ІКС + ЛАБА слід додатково обстежити, оптимізувати лікування і за потреби направити до спеціаліста для оцінки фенотипу та призначення додаткової терапії, включно з біологічними препаратами.
Алерген-специфічна імунотерапія
Може розглядатися як додаткове лікування для пацієнтів з клінічно значущою сенсибілізацією до аероалергенів і стабільною, але недостатньо контрольованою астмою.
Таблиця 3. Термінологія щодо ліків для астми
|
Термін |
Визначення |
Примітки |
|
Підтримуюче лікування (Maintenance treatment) |
Лікування астми, яке призначається для щоденного або регулярного застосування |
Медикаменти, які слід приймати постійно, навіть якщо немає симптомів астми. Приклади: препарати, що містять ІКС (ICS),ICS-LABA, ICS-LABA-LAMA, антагоністи лейкотрієнів (LTRA*), біологічна терапія. Термін «підтримуюче» описує частоту прийому, а не клас препарату. |
|
Контролер (Controller) |
Препарат, який спрямований на контроль обох аспектів астми: симптомів і майбутнього ризику |
Раніше «контролером» називали переважно ІКС-препарати для регулярного щоденного застосування, через що «контролер» і «підтримуюче лікування» часто ототожнювали. Після появи комбінованих ІКС-реліверів терміни почали розмежовувати. Щоб уникнути плутанини, там, де потрібно, використовують терміни «лікування з ІКС» та «підтримуюче лікування». |
|
Релівер (Reliever) |
Інгалятор для швидкого полегшення симптомів астми, який застосовується за потребою |
Також називається «рятувальним» інгалятором. Використовується для швидкого усунення симптомів, а також перед фізичним навантаженням для профілактики астми, викликаної вправами. Включає короткодіючі бета2-агоністи (КДБА, SABA, наприклад, сальбутамол [albuterol], тербуталін), а також ICS-сальбутамол, ICS-формотерол за потребою. КДБА-релівери не слід застосовувати як підтримуюче лікування або без симптомів (крім фізнавантаження). |
|
Протизапальний релівер (Anti-inflammatory reliever, AIR) |
Інгалятор, що містить низьку дозу ІКС та швидкодіючий бронходилататор |
Включає будесонід-формотерол, беклометазон-формотерол та комбінації ІКС-сальбутамол. Можна використовувати за потребою перед фізичним навантаженням або впливом алергенів для профілактики симптомів. Лабільні LABA без формотеролу не застосовують як релівери. ICS-формотерол не слід поєднувати як релівер із підтримуючим лікуванням на основі інших LABA. AIR можна застосовувати як єдине лікування на початкових стадіях астми (кроки 1–2). |
|
Підтримуюча і реліверна терапія (Maintenance- and-reliever therapy, MART) |
Схема лікування, за якою пацієнт щоденно приймає інгалятор ICS-формотерол як підтримуючий засіб і за потребою для полегшення симптомів |
MART застосовується тільки з комбінованими інгаляторами ICS-формотерол (будесонід-формотерол, беклометазон-формотерол). Інші комбінації ICS з LABA без формотеролу або ICS-SABA не використовуються для MART. MART також називають SMART (single-inhaler maintenance-and-reliever therapy). |
Добові дози інгаляційних кортикостероїдів (ІКС) при астмі
Таблиця 4. Рекомендовані добові дози ІКС
|
Препарат (форма, тип частинок) |
Дозування для дорослих і підлітків (≥12 років), мкг/добу |
Дозування для дітей 6–11 років, мкг/добу |
|
|
Низька |
Середня |
|
Беклометазон дипропіонат |
200–500 |
>500–1000 |
|
(pMDI, стандартна частинка, HFA) |
|
|
|
Беклометазон дипропіонат |
100–200 |
>200–400 |
|
(DPI або pMDI, екстрафіна частинка, HFA) |
|
|
|
Будесонід |
200–400 |
>400–800 |
|
(DPI або pMDI, стандартна частинка, HFA) |
|
|
|
Будесонід (небулайзер) |
— |
— |
|
Циклесонід |
80–160 |
>160–320 |
|
(pMDI, екстрафіна частинка, HFA) |
|
|
|
Флутиказон фуроат |
100 |
200 |
|
(DPI) |
|
|
|
Флутиказон пропіонат |
100–250 |
>250–500 |
|
(DPI або pMDI, стандартна частинка, HFA) |
|
|
|
Мометазон фуроат |
200–400 |
>400 |
|
(pMDI, стандартна частинка, HFA) |
|
|
Скорочення
- pMDI — дозований аерозольний інгалятор (pressurized metered-dose inhaler)
- DPI — інгалятор сухого порошку (dry-powder inhaler)
- HFA — гідрофторалкановий пропелент (hydrofluoroalkane)
- ІКС — інгаляційні кортикостероїди (inhaled corticosteroids)
Лікування астми у дорослих і підлітків: Основні підходи
Лікувальні траєкторії для дорослих і підлітків
Лікування астми у дорослих і підлітків поділяється на дві основні траєкторії (шляхи), які відрізняються за типом препарату, що застосовується для купірування симптомів.
- Рятувальний препарат — за потребою інгаляційний кортикостероїд (ІКС) у низькій дозі у комбінації з формотеролом (ICS-formoterol).
- Такий підхід знижує ризик важких загострень порівняно з використанням короткодіючого β2-агоніста (КДБА, SABA) для симптоматичного лікування.
- Пацієнти використовують один і той самий препарат для контролю симптомів і підтримуючого лікування (якщо воно призначене).
- У перших кроках лікування (1–2) ICS-formoterol застосовується тільки для полегшення симптомів, а з кроків 3–5 додається регулярний прийом для підтримки (Maintenance and Reliever Therapy, MART).
- Рятувальний препарат — за потребою КДБА (SABA) або комбінація ІКС + КДБА (ICS-SABA).
- Застосовується, якщо Траєкторія 1 неможлива або при стабільній астмі з хорошою прихильністю до лікування.
- Пацієнт приймає підтримуючу терапію ІКС регулярно, а симптоматично застосовує SABA або ICS-SABA.
- Важливо переконатися, що пацієнт правильно користується різними інгаляторами, якщо рятувальний і підтримуючий препарати подаються в різних пристроях.
Підвищення та зниження дози
- Лікування можна посилювати або знижувати в межах однієї траєкторії, використовуючи один і той самий рятувальний препарат.
- Можлива також зміна траєкторії відповідно до потреб і уподобань пацієнта.
- Перед зміною дози варто перевірити техніку інгаляції, прихильність до лікування, виключити вплив зовнішніх чинників і підтвердити, що симптоми пов’язані саме з астмою.
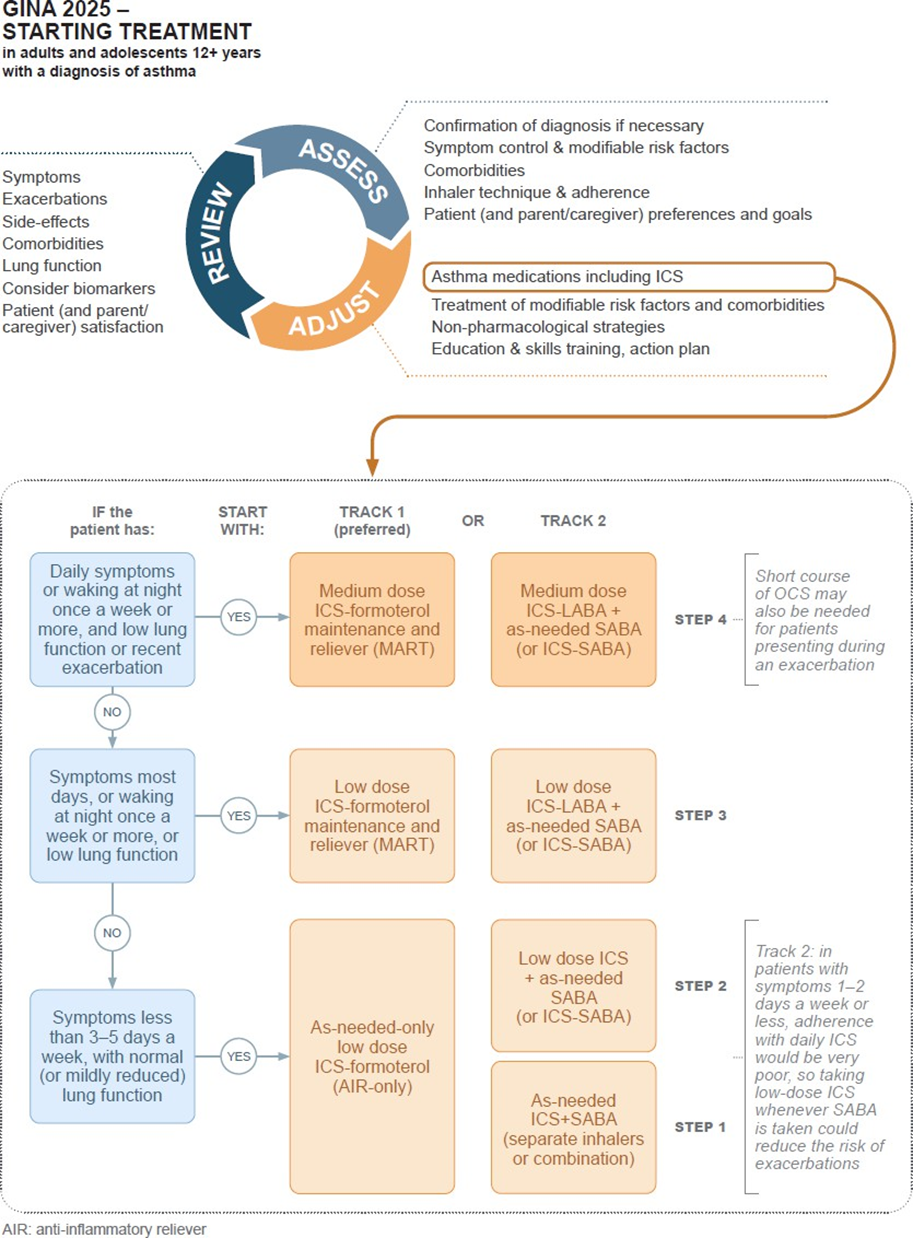
Таблиця 5. Початкове лікування астми у дорослих і підлітків
|
Симптоми |
Переважне початкове лікування (Траєкторія 1) |
Альтернативне початкове лікування (Траєкторія 2) |
|
Рідкі симптоми (1–2 дні на тиждень або рідше) |
За потребою низькодозовий ICS-formoterol |
Низькодозовий ІКС, прийнятий одночасно з SABA або окремо (низька прихильність до регулярного ICS очікується) |
|
Симптоми менше 3–5 днів на тиждень, нормальна або незначно знижена функція легень |
Низькодозовий ICS-formoterol |
Низькодозовий ІКС щодня плюс SABA за потребою (зважити на ймовірність прихильності) |
|
Симптоми більшість днів (≥4 днів на тиждень), або нічні пробудження ≥1 раз на тиждень, знижена функція легень |
Низькодозовий ICS-formoterol у режимі MART |
Низькодозовий ICS-LABA плюс SABA або ICS-SABA за потребою; або середня доза ІКС плюс SABA або ICS-SABA (зважити на прихильність) |
|
Щоденні симптоми або нічні пробудження ≥1 раз на тиждень, низька функція легень або нещодавні загострення |
Середньодозовий ICS-formoterol у режимі MART |
Середньодозовий ICS-LABA плюс SABA або ICS-SABA; або висока доза ІКС плюс SABA (менш прихильність порівняно з ICS-LABA) |
|
Початкове звернення під час загострення |
Лікування загострення, включно з коротким курсом ОКС (при тяжкому перебігу); розпочати середньодозовий MART |
Лікування загострення, включно з коротким курсом ОКС; розпочати середньодозовий ICS-LABA плюс SABA |
Перед початком лікування
- Підтвердити діагноз астми.
- Оцінити рівень контролю симптомів і фактори ризику, включно з функцією легень.
- Врахувати прихильність до лікування при виборі терапії.
- Обрати відповідний інгалятор і навчити пацієнта правильно користуватися ним.
- Запланувати наступний візит для контролю.
Після початку лікування
- Оцінити відповідь на терапію через 2–3 місяці або раніше за необхідності.
- Регулярно перевіряти прихильність і техніку інгаляції.
- При стабільному контролі можна поступово знижувати дозу після 3 місяців.
Абревіатури
- ІКС — інгаляційний кортикостероїд (inhaled corticosteroid, ICS)
- Формотерол — довготривалий β2-агоніст (long-acting β2-agonist, LABA)
- SABA — короткодіючий β2-агоніст (short-acting β2-agonist)
- ICS-formoterol — комбінація інгаляційного кортикостероїда і формотеролу
- MART — терапія підтримки і рятувальна терапія одним препаратом (Maintenance and Reliever Therapy)
- ОКС — пероральні кортикостероїди
Таблиця 6. Рекомендовані препарати та дози для терапії AIR (GINA Track 1) у дорослих і підлітків з астмою
|
Вік |
Препарат (доза мкг/інгаляція [ефективна доза]) |
Максимальна добова кількість інгаляцій |
Дозування за кроками лікування |
|
6–11 років |
Будесонід-формотерол DPI 100/6 [80/4.5] |
8 інгаляцій |
Крок 1–2 (тільки AIR): немає даних Крок 3 (MART): 1 інгаляція 1 раз на день + за потребою 1 інгаляція Крок 4 (MART): 1 інгаляція 2 рази на день + за потребою 1 інгаляція Крок 5: не рекомендовано |
|
|
Будесонід-формотерол pMDI 50/3 [40/2.25]* |
16 інгаляцій |
Крок 1–2 (AIR): немає даних Крок 3 (MART): 2 інгаляції 1 раз на день + 2 за потребою Крок 4 (MART): 2 інгаляції 2 рази на день + 2 за потребою Крок 5: не рекомендовано |
|
12–17 років |
Будесонід-формотерол DPI або pMDI 200/6 [160/4.5] |
12 інгаляцій |
Крок 1–2 (AIR): 1 інгаляція за потребою Крок 3 (MART): 1 інгаляція 1-2 рази на день + 1 за потребою Крок 4 (MART): 2 інгаляції 2 рази на день + 1 за потребою Крок 5 (MART): 2 інгаляції 2 рази на день + 1 за потребою |
|
|
Будесонід-формотерол pMDI 100/3 [80/2.25]* |
24 інгаляції |
Крок 1–2 (AIR): 2 інгаляції за потребою Крок 3 (MART): 2 інгаляції 1-2 рази на день + 2 за потребою Крок 4 (MART): 4 інгаляції 2 рази на день + 2 за потребою Крок 5 (MART): 4 інгаляції 2 рази на день + 2 за потребою |
|
≥18 років |
Будесонід-формотерол DPI або pMDI 200/6 [160/4.5] |
12 інгаляцій |
Крок 1–2 (AIR): 1 інгаляція за потребою Крок 3 (MART): 1 інгаляція 1-2 рази на день + 1 за потребою Крок 4 (MART): 2 інгаляції 2 рази на день + 1 за потребою Крок 5 (MART): 2 інгаляції 2 рази на день + 1 за потребою |
|
|
Будесонід-формотерол pMDI 100/3 [80/2.25]* |
24 інгаляції |
Крок 1–2 (AIR): 2 інгаляції за потребою Крок 3 (MART): 2 інгаляції 1-2 рази на день + 2 за потребою Крок 4 (MART): 4 інгаляції 2 рази на день + 2 за потребою Крок 5 (MART): 4 інгаляції 2 рази на день + 2 за потребою |
|
|
Беклометазон-формотерол pMDI або DPI 100/6 (максимум 12 інгаляцій) |
12 інгаляцій |
Крок 1–2 (AIR): 1 інгаляція за потребою Крок 3 (MART): 1 інгаляція 1-2 рази на день + 1 за потребою Крок 4 (MART): 2 інгаляції 2 рази на день + 1 за потребою Крок 5 (MART): 2 інгаляції 2 рази на день + 1 за потребою |
Пояснення:
- AIR (Anti-inflammatory reliever) — антизапальний засіб-рятівник: інгаляційний препарат, що поєднує протизапальну дію (глюкокортикостероїд) і швидкодіючий бронходилататор (формотерол).
- MART (Maintenance and reliever therapy) — терапія підтримки та рятування одним препаратом.
- Дозування вказані як мікрограми на одну інгаляцію (метрована доза/ефективна доза).
- Максимальна добова кількість — сума всіх інгаляцій (підтримувальна + за потребою).
- Для ICS-formoterol із pMDI рекомендується використовувати спейсер.
- Для беклометазону-формотеролу максимальна кількість інгаляцій в день — 12, ґрунтуючись на безпечних даних від будесоніду-формотеролу.
- У кроках 1–2 AIR застосовується без підтримувальної терапії.
- Для дітей 6–11 років MART рекомендовано з кроку 3 і вище.
- Не рекомендується застосовувати будесонід-формотерол 400/12 як рятівний засіб.
Інші ліки для дорослих і підлітків (треки 1 і 2)
Кроки 1–2:
Існують ліки з обмеженими показаннями або меншою доказовою базою, ніж основні препарати.
- Специфічна алергенна імунотерапія (під’язиковий шлях) рекомендована для пацієнтів, чутливих до пилових кліщів, з недостатнім контролем астми при лікуванні ІКС, якщо ОФВ1 > 70%.
- Антагоністи лейкотрієнових рецепторів (монтелукаст, зафірлукаст, зілейтон) менш ефективні, особливо щодо загострень; можливі нейропсихічні побічні ефекти.
- Щоденна комбінація ІКС-LABA у низькій дозі може зменшувати симптоми, але дорожча і не краща за монотерапію ІКС.
- Для сезонної алергічної астми ІКС призначають на час цвітіння алергену і ще 4 тижні після.
Крок 3:
- Можливе підвищення дози ІКС до середньої, але кращим варіантом є додавання LABA.
- Інші варіанти – комбінація ІКС з LTRA або теофіліном, які мають меншу ефективність та ризики.
Крок 4:
- Додатково можуть використовуватись довго діючі мюскаринові антагоністи (LAMA), як у окремому інгаляторі, так і у комбінації з ІКС-LABA для дорослих. LAMA покращують функцію легень і знижують ризик загострень у певних пацієнтів.
- Якщо астма залишається неконтрольованою, слід підвищувати дозу ІКС або переходити на терапію підтримки і рятівника з ІКС-формотеролом перед додаванням LAMA.
- Інші препарати з меншою доказовістю: підвищена частота дозування будесоніду, LTRA, низькодозовий теофілін (з обережністю через побічні ефекти).
Крок 5 (треки 1 і 2)
-
Пацієнти з постійними симптомами або загостреннями при дотриманні техніки інгаляції і лікування 4-го кроку повинні бути направлені до фахівця з тяжкої астми.
- Варіанти лікування включають:
- Комбінацію ІКС-LABA у високих дозах (з обережністю через побічні ефекти).
- Терапію підтримки і рятівника (MART) з ІКС-формотеролом.
- Додаткові LAMA (окремо або у трьохкомпонентних інгаляторах) — покращують функцію легень, знижують ризик важких загострень.
- Азитроміцин (після консультації зі спеціалістом) для зниження частоти загострень, з контролем потенційних ризиків (ЕКГ, мікобактерії, резистентність).
- Біологічна терапія (анти-IgE, анти-IL-5/5Rα, анти-IL-4Rα, анти-TSLP) для пацієнтів з тяжкою неконтрольованою астмою.
- Лікування, спрямоване на еозинофілію мокротиння (за наявності можливості).
- Бронхіальна термопластика — опція для вибраних пацієнтів.
- Пероральні кортикостероїди в низьких дозах як останній засіб, із контролем побічних ефектів та профілактикою ускладнень.
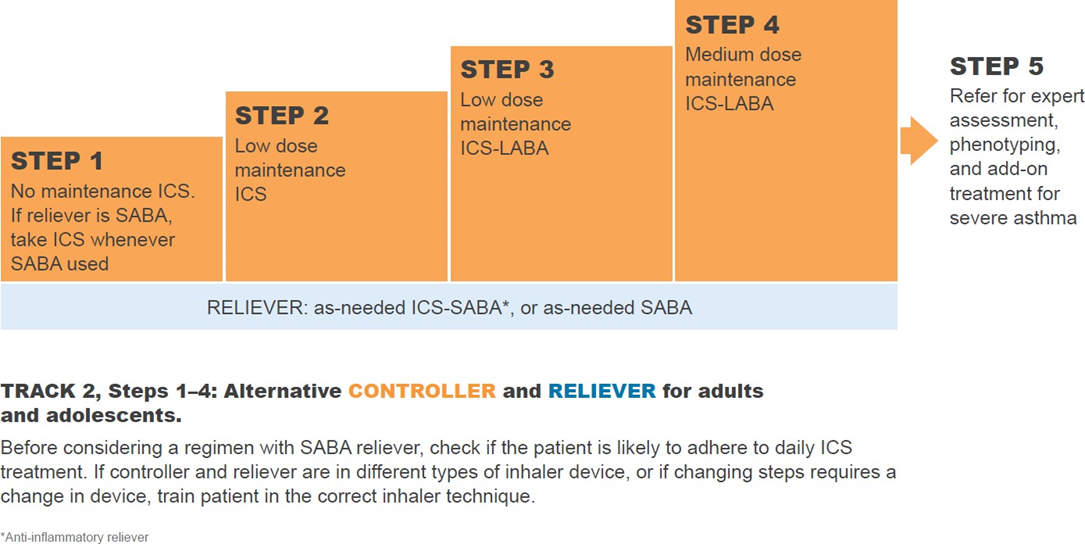
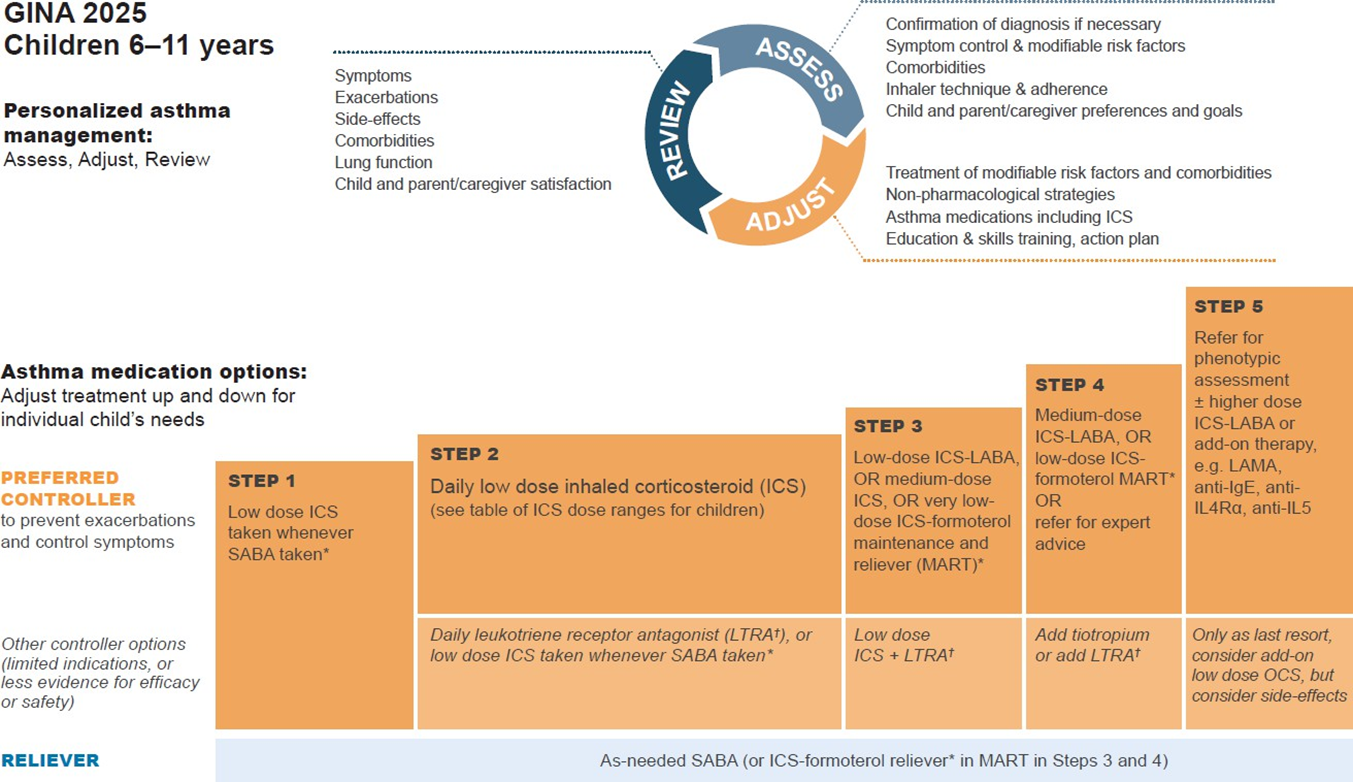
Початкове лікування астми у дітей 6–11 років
1. Симптоми астми зустрічаються рідко (1–2 дні на тиждень або менше)
- Переважне лікування: Низькодозовий інгаляційний глюкокортикостероїд (ІГКС) кожного разу, коли приймають SABA, у вигляді окремих або комбінованих інгаляторів (доказ В).
2. Симптоми астми 2–5 днів на тиждень
- Переважне лікування: Низькодозовий ІГКС + SABA за потребою (доказ А).
- Інші, менш рекомендовані варіанти:
- ІГКС при прийомі SABA (окремо чи комбіновано) (доказ В).
- Щоденне застосування лейкотрієнових рецепторних антагоністів (LTRA)* (доказ А – ІГКС ефективніші для запобігання загострень).
3. Симптоми астми більшість днів (4–5 днів на тиждень) або пробудження через астму ≥1 раз на тиждень
- Переважне лікування:
- Низькодозовий комбінація ІГКС + LABA + SABA за потребою (доказ А),
- або середньодозовий ІГКС + SABA за потребою (доказ А),
- або дуже низькодозовий ІГКС–формотерол (maintenance-and-reliever therapy, MART) (доказ В).
- Інші варіанти: Щоденний низькодозовий ІГКС + LTRA* + SABA за потребою.
4. Щоденні симптоми, пробудження вночі ≥1 раз на тиждень, знижена функція легень
- Середньодозовий ІГКС + LABA + SABA за потребою,
- або низькодозовий ІГКС–формотерол (MART).
5. Початковий випадок астми під час гострого загострення
- Лікувати як загострення, включаючи короткий курс пероральних ГКС при важкому перебігу.
- Розпочати лікування на кроку 3 або 4.
- Організувати подальше спостереження.
Перед початком лікування контролю
- Підтвердити діагноз астми.
- Оцінити контроль симптомів і фактори ризику, включаючи функцію легень.
- Врахувати фактори, що впливають на вибір лікування.
- Підібрати зручний інгалятор, навчити правильному користуванню.
- Запланувати контрольний візит.
Після початку лікування контролю
- Оцінити реакцію на лікування через 2–3 місяці (або раніше, якщо потрібно).
- При стабільному контролі можна поступово знижувати дозу після 3 місяців.
* При призначенні LTRA слід інформувати про можливий ризик нейропсихіатричних побічних ефектів.
ДЖЕРЕЛО: GINA
На платформі Accemedin багато цікавих заходів! Аби не пропустити їх, підписуйтесь на наші сторінки! Facebook. Telegram. Viber. Instagram.
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Харчування з обмеженням у часі: ефективна ...
Ультразвуковое исследование печени в норме ...

Глаукома пов'язана з підвищеним ризиком ро ...

Ранні фактори ризику хвороби Альцгеймера в ...

Запис майстер-класу «Українська школа кард ...

Новий препарат стійко знижує високий артер ...