Дослідження підкреслює ключову роль префронтальної кори в регулюванні швидкого сну
Дата публікації: 26.10.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: мозок, сон, швидкий рух очей, фаза швидкого сну, REM

Сон зі швидкими рухами очей (REM) — це стадія циклу сну, під час якої зазвичай відбуваються яскраві сновидіння. Цю важливу фазу сну, яка характеризується розслабленими м’язами, швидкими рухами очей, прискореним пульсом і нерегулярним диханням, пов’язують із консолідацією спогадів і обробкою емоцій.
Дослідники з Університету Пенсільванії нещодавно провели дослідження, в якому вивчали роль префронтальної кори (PFC), передньої частини зовнішнього шару мозку, у регуляції швидкого сну. PFC містить різні важливі ділянки мозку, які регулюють мислення, дії, емоції, складне планування, процеси пам’яті, навчання та інші життєво важливі функції.
Рекомендуємо переглянути запис семінару Костянтина Зуєва «Ендокринні аспекти розладів сну і неспання»!
«Дослідження зображень людини показали, що медіальна префронтальна кора у людей сильно активується під час швидкого сну», — сказав Франц Вебер, один із дослідників, який проводив дослідження, Medical Xpress. «Нам було цікаво, чи є ця активація лише наслідком підкіркових ланцюгів, що контролюють швидкий сон, чи активність mPFC сама по собі відіграє роль у регулюванні швидкого сну».
У рамках свого нещодавнього дослідження, представленого в Nature Neuroscience, Вебер і його колеги вирішили визначити, чи кортикальні нейрони сприяють запуску швидкого сну. Для цього вони провели два різних експерименти на сплячих мишах.
У першому експерименті дослідники використовували цілеспрямовані методи для експресії світлозалежних іонних каналів (тобто каналродопсину) у нейронах mPFC. Це дозволило їм визначити, що відбувається, коли ці нейрони активуються протягом коротких періодів часу, особливо з точки зору сну мишей.
«Ми виявили, що майже кожного разу, коли ми освітлювали mPFC, щоб активувати нейрони під час NREM-сну, миша переходила в REM-сон», — пояснив Вебер. «Другий важливий експеримент полягав у моніторингу активності нейронів mPFC. Ми використовували візуалізацію кальцію, експресуючи флуоресцентний індикатор кальцію в нейронах mPFC. Використовуючи цю техніку, ми могли потім відобразити активність нейронів mPFC під час сну».
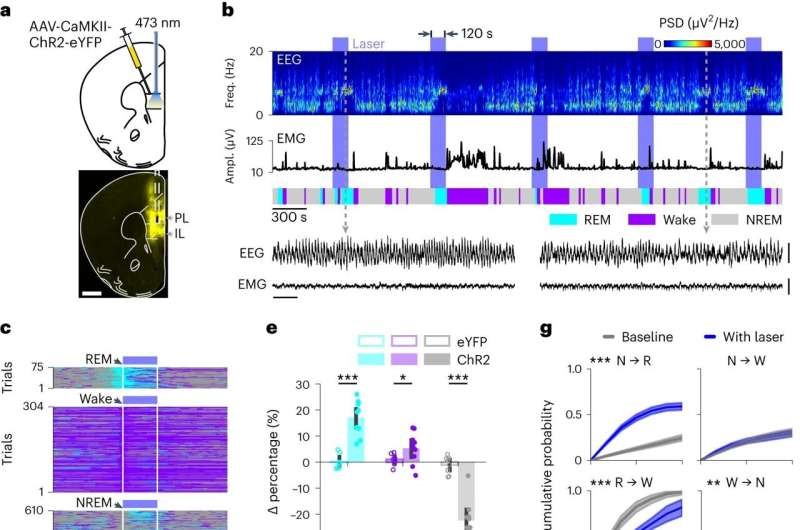
a. Вгорі: схема оптогенетичної активації нейронів mPFC Pyr. Внизу: експресія AAV-CaMKII-ChR2-eYFP (жовтий) у mPFC миші C57BL/6J. Пунктирні лінії, оптоволоконний тракт. Масштабна шкала, 500 мкм. Зображення атласу мозку, адаптоване з дозволу випр. 61.
b. Приклад експерименту стимуляції з відкритим контуром. Показано спектрограму ЕЕГ, амплітуду ЕМГ, стани мозку та необроблені сліди ЕЕГ і ЕМГ у розширеному часовому масштабі для двох часових точок (сірі лінії). Масштабні шкали, 1 с і 0,5 мВ. Сині плями, інтервали лазерної стимуляції 120 с (473 нм, 5 Гц).
c. Стани мозку в усіх дослідженнях стимуляції з n = 11 мишей, вирівняних за початком лазера при t = 0 с. Випробування були відсортовані залежно від стану мозку на момент початку лазера (стрілки).
d. Відсоток станів мозку до, під час і після стимуляції відкритого циклу. Синя пляма, інтервал лазерної стимуляції. Двосторонній RM ANOVA порівнює середній відсоток кожного стану мозку між лазером і попереднім базовим інтервалом 120 с (взаємодія, P = 0,0000); t-критерії з поправкою Холма–Бонферроні; базова лінія проти лазера: REM, P = 0,0000; пробудження, P = 0,0093; NREM, P = 0,0000. n = 11 мишей. Лінії, середні по мишах; затінення, 95% ДІ.
e. Зміни у відсотках кожного стану мозку (різниця між попередніми 120-секундними базовими показниками та лазерним інтервалом), індуковані лазерною стимуляцією у мишей ChR2 та eYFP. Змішаний дисперсійний аналіз зі станом мозку як фактором у межах суб’єктів і вірусом як фактором між суб’єктами (взаємодія, P = 0,0000); t-критерії з поправкою Холма–Бонферроні; eYFP порівняно з ChR2: REM, P = 0,0000; пробудження, P = 0,0321; NREM, P = 0,0000. ChR2, n = 11; eYFP, n = 8 мишей. Стовпчики, середні значення для мишей; точки, окремі миші; смуги помилок, 95% ДІ.
f. Вгорі: спектрограма ЕЕГ, усереднена за результатами лазерного дослідження (нормализована за середньою потужністю в кожному діапазоні частот; Методи). Внизу: часовий хід δ (0,5–4,5 Гц), θ (6–9,5 Гц) і γ потужності (50–90 Гц) до, під час і після лазерної стимуляції. Двосторонній RM ANOVA порівнює середню потужність у кожній частотній смузі між лазером і попереднім базовим інтервалом 120 с (взаємодія, P = 0,0000); t -критерії з поправкою Холма–Бонферроні; базова лінія проти лазера: δ, P = 0,0000; θ, P = 0,0006; γ, P = 0,0000. n = 11 мишей. Лінії, середні по мишах; затінення, 95% ДІ.
g. Сукупні ймовірності переходу від стану мозку X на початку лазерного випромінювання (t = 0 с) до стану Y в межах лазерного інтервалу (синій) і 120-секундного базового інтервалу, що передує лазерному запуску (сірий). Bootstrap; N → R, P = 0,0001; R → W, P = 0,0001; N → W, P = 0,9274; W → N, P = 0,0042; n = 11 мишей. Затінення, 95% ДІ.
h. Графік, що підсумовує відносні зміни кумулятивних ймовірностей переходу між базовою лінією та лазерним інтервалом (Методи). Значення 1 вказує на відсутність змін між базовою лінією та лазером. Краї для переходів wake → REM і REM → NREM були опущені, оскільки ці типи переходів не спостерігалися в наборі даних. Суцільні та пунктирні лінії вказують на значні та незначні зміни ймовірностей переходу відповідно. Дивіться Додаткову таблицю 1 для отримання детальної статистичної інформації.
* P < 0,05,
** P < 0,01,
*** P < 0,001.
Авторство: Nature Neuroscience (2023). DOI: 10.1038/s41593-023-01398-1
Експериментальна методика, використана Вебером і його колегами, відображає активність нейронів на основі концентрації кальцію в них. Коли нейрони активуються, концентрація кальцію в них підвищується, що, своєю чергою, посилює флуоресценцію індикатора кальцію, який вони використовували.
Іншими словами, чим активніші нейрони, тим яскравіше вони виглядатимуть. Спостереження дослідників підтвердили роль PFC-нейронів у швидкому сні, оскільки велика кількість цих нейронів була сильно активована, коли миші входили в цю стадію сну.
«Одним із ключових висновків нашого дослідження є те, що кора відіграє певну роль у регуляції швидкого сну», — сказав Вебер. «Більшість поширених моделей контролю швидкого сну припускають, що цей стан мозку в основному регулюється підкірковими нейронами в гіпоталамусі та стовбурі мозку. По-друге, ми виявили, що активність mPFC під час швидкого сну також регулює фазовий швидкий сон, підстадію швидкого сну, що характеризується швидкими рухами очей».
Недавні відкриття, зібрані Вебером та його командою, окреслюють нейронний ланцюг, що включає кору головного мозку та гіпоталамус, який, здається, регулює швидкий сон. Оскільки дисрегуляція активності нейронів PFC і порушення сну були пов’язані з психічними розладами, їхні висновки також можуть мати клінічні наслідки.
Наприклад, минулі дослідження виявили, що вентромедіальна префронтальна кора, яка виконує ту ж роль, що й mPFC миші в мозку людини, гіперактивована у людей з діагнозом депресія. Оскільки команда виявила, що більша активність нейронів mPFC збільшує кількість швидких рухів очей під час сну мишей, їхні висновки можуть, серед іншого, сприяти розробці методів виявлення та кращого розуміння депресії з використанням фаз швидкого сну.
«Ми виявили, що активація mPFC збільшила кількість швидких рухів очей (під час швидкого сну), тоді як інгібування mPFC мало протилежний ефект», — додав Вебер. «Таким чином, загальна активність mPFC може корелювати з кількістю швидких рухів очей під час швидкого сну. Іншими словами, спостереження за швидкими рухами очей може служити вікном в активність префронтальної кори та може надати інформацію про потенційні аномалії у свою діяльність».
ДЖЕРЕЛО: https://medicalxpress.com/
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

«Здорового» рівня вітаміну В12 недостатньо ...

Роль дофаміну в патофізіології хвороби Пар ...

Клінічний випадок: 42-річна пацієнтка з по ...

Рівень ЛПНЩ асоціюється зі зниженням риз ...
Медична допомога при деменції та легких ко ...

Вплив природи на сприйняття болю: нейробіо ...


