Раннє емпіричне використання антибіотиків у пацієнтів, госпіталізованих із COVID-19
Дата публікації: 24.10.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: антибіотикотерапія, COVID-19, когортне дослідження

Ретроспективне когортне дослідження
Анотація
Мета: дослідити часові тенденції та результати, пов’язані з раннім призначенням антибіотиків пацієнтам, госпіталізованим із COVID-19.
Дизайн: ретроспективне когортне дослідження зі збігом схильності з використанням бази даних National COVID Cohort Collaborative (N3C).
Налаштування: шістдесят шість систем охорони здоров’я по всій території Сполучених Штатів, які додавали до бази даних N3C. Центри, у наборі даних яких було менш як 500 госпіталізацій, були виключені.
Пацієнти: були включені пацієнти, госпіталізовані з COVID-19. Пацієнтів було визначено як раннє застосування антибіотиків, якщо вони отримували принаймні 3 календарних дні внутрішньовенних антибіотиків протягом перших 5 днів після госпіталізації.
Втручання: немає.
Вимірювання та основні результати: із 322 867 кваліфікованих перших госпіталізацій 43 089 пацієнтів отримували ранні емпіричні антибіотики. Використання антибіотиків знизилося в усіх центрах за період збору даних, з березня 2020 року (23%) до червня 2022 року (9,6%). Середні показники раннього емпіричного застосування антибіотиків (EEAU) також значно відрізнялися між центрами (пояснене відхилення 7,33% проти 20,0%, p < 0,001). Застосування антибіотиків трохи зменшилося на 2-й день госпіталізації та значно зменшилося на 5-й день. Механічна вентиляція легень до 2-го дня (співвідношення шансів [OR] 3,57; 95% ДІ, 3,42–3,72), екстракорпоральна мембранна оксигенація до 2-го дня (OR 2,14; 95). % ДІ, 1,75–2,61), і раннє використання вазопресорів (ВШ 1,85; 95% ДІ, 1,78–1,93), але не регіон проживання, було пов’язане з EEAU. Після підбору схильності EEAU асоціювався з підвищеним ризиком госпітальної смертності (OR 1,27; 95% ДІ, 1,23–1,33), тривалої штучної вентиляції легень (OR 1,65; 95% ДІ, 1,50–1,82), пізнього призначення антибіотиків широкого спектра дії. експозиція (OR 3,24; 95% ДІ, 2,99–3,52) та пізня інфекція Clostridium difficile (OR 1,60; 95% ДІ, 1,37–1,87).
Правильне використання емпіричних антибіотиків є клінічним викликом для пацієнтів із тяжкою формою COVID-19. На початку пандемії було занепокоєння, що бактеріальна коінфекція вплине на захворюваність і смертність. Докази попередніх пандемій підтвердили це твердження. Більшість смертей під час пандемії грипу 1918 року були спричинені бактеріальними коінфекціями. Подібним чином під час пандемії грипу H1N1 2009 року 29–59% смертності у всьому світі було спричинено бактеріальними суперінфекціями. На щастя, перші дані про пандемію COVID-19 свідчать про те, що бактеріальна коінфекція нечаста. Метааналіз 3338 пацієнтів з COVID-19 показав, що лише 3,5% пацієнтів мали бактеріальну коінфекцію під час звернення. Серед пацієнтів, які потребували інтенсивної терапії, частота бактеріальної коінфекції була вищою – 8,1%. Дослідження показали, що 76% госпіталізованих пацієнтів з COVID-19 отримують антибіотики. Як показали попередні дослідження, раннє емпіричне застосування антибіотиків (EEAU) не без ризику. Тривале застосування емпіричних антибіотиків пов’язане з підвищенням резистентності до антибіотиків інфекцією, спричиненою Clostridioides difficile, і смертністю. Експериментальні дані на тваринах і спостереження за людьми показують, що ранні анаеробні антибіотики змінюють легеневий мікробіом, підвищують летальність гіпероксії та пов’язані з несприятливими наслідками для пацієнтів. Зміни в респіраторному мікробіомі спостерігалися при тривалому гострому респіраторному дистрес-синдромі при COVID-19. Ми припустили, що: 1) показники EEAU відрізнятимуться між центрами та зменшуватимуться з часом, і 2) EEAU буде пов’язаний із збільшенням рівня інфекції C. difficile , антимікробної стійкості та смертності.
Учасники
У цьому ретроспективному когортному дослідженні зі збігом балів схильності ми визначили першу госпіталізацію в період з березня 2020 року по червень 2022 року для пацієнтів з позитивним результатом ПЛР або тесту на антиген на COVID-19 протягом 48 годин після госпіталізації або за 15 днів до госпіталізації. Ми виключили пацієнтів, госпіталізованих до центрів із загальною кількістю менше 500 госпіталізацій у наборі даних
Експозиції
Ми визначили раннє емпіричне застосування антибіотиків як щонайменше 3 календарні дні введення парентеральних антибіотиків протягом перших 5 днів після прийому. Ми обрали це визначення, щоб охопити антибіотики, розпочаті тоді, коли дані посіву були малоймовірними.
Результати
Наш основний результат – внутрішньолікарняна смертність. Нашими вторинними результатами були пізнє застосування антибіотиків розширеного спектра дії (що визначається як прийом парентерального карбапенему або аміноглікозиду після 7-го дня госпіталізації), наявність епізоду штучної вентиляції легенів довше 14 днів і початок інфекції Clostridium difficile (CDI) після госпіталізованого дня 7.
Вимірювання
Ми зібрали дані про вік на момент діагностики COVID-19, раннє використання інвазивної механічної вентиляції (IMV), раннє використання екстракорпоральної мембранної оксигенації (EКMO), раннє використання вазопресорів, стать, расову/етнічну приналежність, індекс коморбідності Чарлсона місяць госпіталізації, перше вимірювання кількості лейкоцитів, перше вимірювання прокальцитоніну, показник соціальних детермінант здоров’я на рівні громади (BU-ShareCare Community Wellbeing Index) регіон проживання, ідентифікатор центру. Крім того, ми зафіксували ранні серйозні операції (визначені як серйозна хірургічна процедура до 2-го дня госпіталізації) як проксі для випадкового передпроцедурного тестування та ранні повідомлення про травматичні ушкодження (визначені як виставлені травматичні діагнози до 2-го дня госпіталізації) як проксі для випадкового тестування при госпіталізації.
Статистичний аналіз
Для аналізу моделей емпіричної антибактеріальної терапії було проведено статистичне тестування за допомогою тесту хі-квадрат для категоріальних даних і тесту суми рангів Вілкоксона для безперервних даних. Логістичну регресію зі змішаними ефектами використовували для оцінки предикторів з випадковими ефектами для місяця лікування та центру. Ми провели аналіз чутливості, включивши ентеральні антибіотики, змінюючи необхідну кількість днів експозиції від 3 до 5 днів і змінюючи вікно експозиції від 4 до 7 днів. Лінійна регресія за часом була використана для оцінки часових тенденцій нашого впливу, коваріатів і результатів протягом раннього (з березня 2020 року по вересень 2020 року) та пізніх періодів пандемії. Щоб оцінити варіацію центру, ми використали аналіз відхилення за допомогою тесту хі-квадрат, щоб порівняти модель із предикторами пацієнта та часом з моделлю з предикторами пацієнта, часом і центром.
Для аналізу результатів EEAU ми побудували когорту зі збігом за схильністю 1:1 за допомогою пакета MatchThem. Ми розглядали включення статусу вакцинації та попереднього використання імуносупресивних препаратів, але жоден із факторів не був надійно доступним у наборі даних. Коваріативний баланс оцінювали за допомогою кобальту.
Результати
Ми визначили 322 867 перших госпіталізацій для аналізу, а 43 089 пацієнтів отримали ранню емпіричну антибіотикотерапію. Пацієнти, які отримували рання емпіричне застосування антибіотиків, частіше були старшими, чоловіками, страждали ожирінням, курцями та мали більше супутніх захворювань. Додаткові відомості про когорту доступні в додатковій таблиці. У всіх центрах емпіричне застосування антибіотиків знизилось з часом від першого місяця (21,1%) до останнього місяця (13,2%) у період збору даних (p < 0,0001 для тенденції); однак ця тенденція не спостерігалася після виключення даних за перші 6 місяців. Середня тривалість початкової антибіотикотерапії у пацієнтів становила 7 днів (IQR 5–14 днів). Застосування антибіотиків трохи зменшилося на 2-й день госпіталізації та значно зменшилося на 5-й день. Цефтріаксон та азитроміцин були антибіотиками, які найчастіше призначали. Антибіотики з протисиньогнійною дією, включаючи цефепім і піперацилін/тазобактам, також були поширеними.
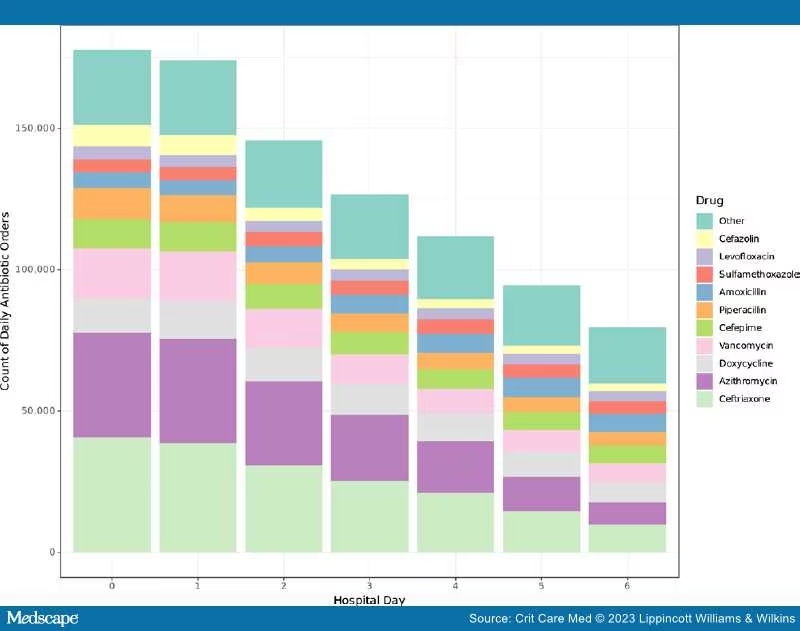
Частота захворювань, наявних під час госпіталізації, змінювалася в залежності від періоду часу: рання ШВЛ зменшувалася в ранньому періоді (p < 0,001 для тенденції), а потім стабілізувалася, тоді як раннє використання ЕКМО не змінювалося протягом жодного періоду. Навпаки, як частота ранніх травматичних діагнозів (p < 0,001), так і ранніх основних процедур (p = 0,004) зросла протягом пізнього періоду пандемії. Рівень раннього застосування вазопресорів знизився протягом раннього періоду пандемії (p = 0,005), а потім знизився протягом пізнього періоду пандемії (p < 0,001).
Обговорення
Це велике ретроспективне когортне дослідження демонструє, що багато пацієнтів, госпіталізованих із COVID-19, отримували емпіричну антибіотикотерапію протягом пандемії COVID-19, і відмінності між центрами та показаннями є великими. Наші спостережувані показники нижчі, ніж раніше повідомлялося про 76%, але наша когорта в 10 разів більша, ніж попередні когорти, і включає два роки додаткових даних.
Хоча ми не намагалися оцінити рівень бактеріальної суперінфекції, і справжній рівень невідомий, емпірична антибіотикотерапія при COVID-19 являє собою терапію зі значною потенційною шкодою та невизначеною користю, оскільки переважна більшість пацієнтів не мають бактеріальної інфекції та не можуть отримати користь від протимікробних засобів.
Схоже, що рання антибіотикотерапія пов’язана із збільшенням частоти подальшого використання антибіотиків широкого спектра дії, пізньої госпіталізації, тривалої штучної вентиляції легень та смертності. Пацієнти все ще мали більше шансів померти, незважаючи на отримання антибіотикотерапії. Механізм, що зв’язує прийом антибіотиків зі смертністю та тривалою штучною вентиляцією легенів, менш ясний. Зміни в мікробіомі легенів пов’язують із погіршенням результатів критичних захворювань. Таким чином, інтригуюча можливість полягає в тому, що підвищена смертність може частково бути наслідком дисбактеріозу дихальних шляхів, викликаного антибіотиками. Подібним чином тяжкохворі пацієнти, які отримували ранні антианаеробні антибіотики, мали менше днів без пневмонії, пов’язаної з вентиляцією легенів, днів без інфекції та загального виживання. Антианаеробні протимікробні препарати були поширеними в нашій досліджуваній популяції і можуть пояснити відмінності в смертності в нашій когорті, хоча подальші дослідження виправдані. Шкода непотрібних антибіотиків чітко визначена в літературі. Однак чітких вказівок щодо показань до емпіричної антибактеріальної терапії та частоти вторинної бактеріальної інфекції немає. Класично, золотистий стафілокок був визначений як поширена причина вторинної бактеріальної інфекції. Однак дані про легеневий мікробіом свідчать про те, що гіпероксія надає селективну перевагу росту для S. aureus над іншими видами, які є менш толерантними до кисню.
Висновки
Незважаючи на те, що лікування пацієнтів із COVID-19 емпіричними внутрішньовенними антибіотиками знизилося під час пандемії, частота використання залишається вищою, ніж повідомляється про випадки бактеріальної суперінфекції, із значними міжцентровими варіаціями в практиці призначення антибіотиків. Ці спостережувані моделі використання можуть бути пов’язані з надмірною шкодою, і наші результати створюють гіпотези. Майбутні дослідження мають бути зосереджені на порівнянні результатів і побічних ефектів серед пацієнтів із COVID-19, які отримували емпіричні антибіотики та не отримували їх.









