Патогенез тиреоїдиту Хашимото (хронічний аутоімунний тиреоїдит)
Дата публікації: 28.07.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: клінічна настанова, патогенез, тиреоїдит, Хашимото
ВСТУП
Хронічний аутоімунний тиреоїдит (тиреоїдит Хашимото) є найпоширенішою причиною гіпотиреозу в регіонах світу, де достатньо йоду. Це зустрічається у 10 відсотків населення, особливо жінок, і його поширеність зростає з віком. Клінічно характеризується поступовою недостатністю щитовидної залози з утворенням зоба або без нього внаслідок лімфоцитарної інфільтрації та аутоімунного опосередкованого руйнування щитовидної залози, що включає апоптоз тиреоїдних епітеліальних клітин. Майже всі пацієнти мають високі сироваткові концентрації антитіл проти одного або кількох антигенів щитовидної залози, а також інтенсивну та дифузну лімфоцитарну інфільтрацію щитовидної залози, яка включає переважно тиреоїдні специфічні B- і T-клітини. Деструкція фолікула є характерною патологічною ознакою тиреоїдиту.
Вважається, що причиною того, що найчастіше називають тиреоїдитом Хашимото, є поєднання генетичної схильності та факторів навколишнього середовища. Сімейний зв’язок із хворобою Грейвса та той факт, що хвороба Грейвса іноді може еволюціонувати в тиреоїдит Хашимото (і навпаки, тиреоїдит Грейвса), вказує на те, що ці два захворювання тісно пов’язані патофізіологічно, хоча й не функціонально.
КЛІНІЧНІ ФЕНОТИПИ
Клінічні прояви хронічного аутоімунного тиреоїдиту (тиреоїдит Хашимото) можуть бути різними. Ці прояви вважаються проявами одного і того ж розладу з різними аутоімунними явищами, що призводять до клінічних фенотипів. Загальною патологічною ознакою є лімфоцитарна інфільтрація, а загальною серологічною ознакою є наявність високих концентрацій антитіл до тиреоїдної пероксидази (ТПО) і тиреоглобуліну в сироватці крові. Сироваткові концентрації аутоантитіл до ТПО підвищені більш ніж у 90 відсотків пацієнтів. Наявність тиреоїдних антитіл добре корелює з наявністю лімфоцитарного інфільтрату в щитовидній залозі
Гіпотиреоз – найпоширенішою причиною гіпотиреозу в регіонах світу, де достатньо йоду, є хронічний аутоімунний тиреоїдит (Хашимото). Двома основними фенотипами хронічного аутоімунного гіпотиреозу є зобний аутоімунний тиреоїдит і атрофічний аутоімунний тиреоїдит. У хворих на зоб збільшення щитовидної залози зазвичай протікає безсимптомно; однак у рідкісних пацієнтів спостерігається біль і чутливість щитовидної залози, особливо якщо є швидкий набряк щитовидної залози, і таким пацієнтам може знадобитися навіть хірургічне лікування.
Нормальні тести на функцію щитовидної залози – іноді антитіла до ТПО вимірюють одночасно з тиреотропним гормоном (ТТГ) у пацієнтів, які мають симптоми гіпотиреозу та/або зоб під час фізичного огляду, а антитіла до ТПО виявляються підвищеними у пацієнтів із нормальними тестами на функцію щитовидної залози. Ці пацієнти мають хронічний аутоімунний тиреоїдит, але не мають гіпотиреозу. У них більша ймовірність розвитку гіпотиреозу, ніж у осіб з негативним антитілами, оскільки звичайний перебіг тиреоїдиту Хашимото полягає в поступовій втраті функції щитовидної залози. Серед пацієнтів із цим розладом, які мають легкий (субклінічний) гіпотиреоз, що проявляється у вигляді незначного підвищення рівня ТТГ та наявності антитіл до щитовидної залози, явний гіпотиреоз виникає приблизно з частотою 5 відсотків на рік. Явний гіпотиреоз, коли він виявляється, є постійним майже у всіх випадках, за винятком деяких дітей і жінок після пологів, у яких він може бути тимчасовим.
Транзиторний гіпертиреоз або гіпотиреоз, що чергується з гіпертиреозом – хоча гіпотиреоз є характерною функціональною аномалією, запальний процес на ранніх стадіях може включати достатній апоптоз, щоб викликати руйнування фолікулів щитовидної залози та вивільнення тиреоїдних гормонів, що призводить до транзиторного гіпертиреозу, який іноді називають «хашитоксикозом». Деякі з цих пацієнтів можуть навіть мати тимчасове підвищення поглинання радіойоду. Крім того, рідкісні пацієнти можуть змінювати гіпотиреоз і хворобу Грейвса, можливо, вторинно через чергування блокування рецепторів ТТГ і стимулюючих антитіл.
Тиреоїдит Хашимото — захворювання переважно жінок із співвідношенням статей приблизно 7:1; він також може виникати у дітей. Варіанти легких форм тиреоїдиту Хашимото отримали такі назви, як тихий (або безболісний) тиреоїдит і післяпологовий тиреоїдит, обидва з яких є минущими, але через роки можуть супроводжуватися відмовою щитовидної залози.
ВНУТРІШНЬОЩИТОВИДНИЙ ЛІМФОЦИТАРНИЙ ІНФІЛЬТРАТ
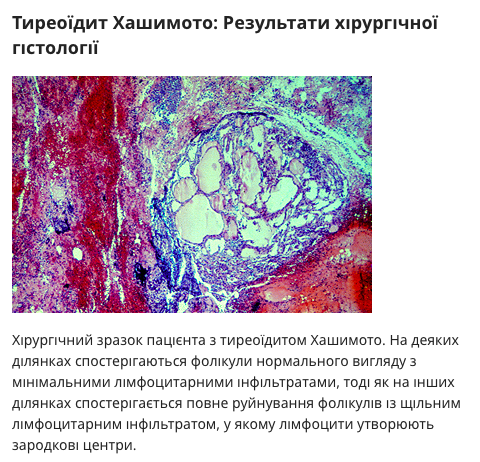
Характерними гістопатологічними аномаліями є профузна лімфоцитарна інфільтрація, лімфоїдні зародкові центри та деструкція тиреоїдних фолікулів. Фіброз і ділянки гіперплазії фолікулярних клітин, імовірно спричинені тиреотропним гормоном (ТТГ), також спостерігаються у пацієнтів із тяжким захворюванням, і реакція фібробластів може стати надмірною, як це спостерігається при тиреоїдиті Рейделя. Інтратиреоїдні лімфоцити є як Т-, так і В-лімфоцитами. Т-клітини та плазматичні клітини можна побачити між фолікулярними клітинами всередині фолікула щитовидної залози, це явище називається «периполез». Було отримано певне розуміння розвитку інтратиреоїдних зародкових центрів і лімфатичних судин, що свідчить про важливість місцевих хемокінів.
Тиреоїдні антигени
Кілька антитіл і антигенспецифічних Т-клітин, спрямованих проти антигенів щитовидної залози, були описані при хронічному аутоімунному тиреоїдиті. Основними антигенами є:
● Тиреоглобулін (Tg).
● Тиреоїдна пероксидаза (TPO, історично відома як «мікросомальний» антиген).
● Рецептор тиреотропного гормону (ТТГ).
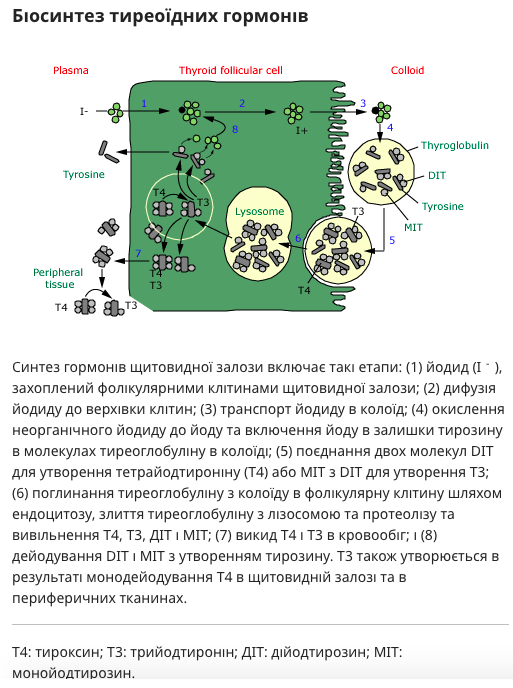
Тиреоглобулін і тиреоїдна пероксидаза — Tg синтезується фолікулярними клітинами і секретується в просвіт фолікула щитовидної залози, де зберігається у вигляді колоїду. ТПО каталізує йодування залишків тирозину Tg з утворенням монойодтирозину та дийодтирозину. Індукція експериментального аутоімунного тиреоїдиту у мишей шляхом імунізації Tg або TPO як антигеном надала докази їхньої потенційної ролі в патогенезі тиреоїдиту Хашимото у людей. Ген TG може бути геном сприйнятливості до аутоімунного захворювання щитовидної залози, кодуючим варіанти Tg різної імуногенності.
При стимуляції ТТГ фолікулярні клітини щитовидної залози поглинають Tg з колоїду. Потім Tg розщеплюється пептидазами з утворенням тироксину (T4) і трийодтироніну (T3), які вивільняються у позаклітинну рідину. Деяка кількість Tg виявляється в сироватці здорових суб’єктів, і концентрація може підвищуватися у пацієнтів із будь-яким захворюванням щитовидної залози.
Tg є великим димером глікопротеїну, кожна субодиниця має приблизно 330 кДа. Приблизно 45 із 72 залишків тирозину можуть бути йодовані in vitro, але лише деякі з них є первинними акцепторами йоду in vivo. Ці кілька розташованих в певних амінокислотних послідовностях поблизу аміно- та карбоксильних кінців молекули Tg. Як ступінь йодування, так і посттрансляційні модифікації Tg, ймовірно, є важливими детермінантами його імуногенності.
ТПО є ключовим ферментом у гормоногенезі щитовидної залози. Він розташований на просвітній поверхні мікроворсинок тиреоїдних епітеліальних клітин. Ген TPO людини кодує фермент, який є глікопротеїном 107 кД (933 амінокислоти) з 10 відсотками вуглеводів і областю, що охоплює мембрану поблизу карбокси-кінця. TPO каталізує як йодування тирозину, так і сполучення йодтирозильних залишків з утворенням Т3 і Т4. Поліморфізм гена TPO був пов’язаний з антитілами до TPO, але не був безпосередньо пов’язаний з клінічним тиреоїдитом Хашимото.
Рецептор ТТГ
Рецептор тиреотропного гормону (ТТГ) містить 764 амінокислоти і є G-білковим рецептором. Перші 415 амінокислот визначають великий позаклітинний домен, кодований 10 екзонами. Решта 349 амінокислот утворюють сім трансмембранних сегментів, внутрішньоцитоплазматичні сегменти між ними та внутрішньоцитоплазматичний хвіст. ТТГ зв’язується з декількома ділянками позаклітинного домену. Антитіла до рецептора ТТГ можуть бути виявлені у невеликої кількості пацієнтів з хворобою Хашимото (приблизно 15 відсотків) і можуть бути блокуючими або стимулюючими.
Експресія рецептора ТТГ також була виявлена в інших тканинах (наприклад, фібробластах, адипоцитах, клітинах серцевого м'яза, клітинах гіпофіза, клітинах кісток і мозку). Хоча роль рецептора в багатьох із цих тканин неясна, дані свідчать про те, що ТТГ може модулювати функцію кісткових клітин і адипоцитів. Ретроокулярна експресія рецептора ТТГ була причетна до захворювань ока щитовидної залози (орбітопатія Грейвса) і претибіальної мікседеми (дермопатія щитовидної залози).
РОЛЬ В-КЛІТИН
В-клітини з тканини щитовидної залози пацієнтів з тиреоїдитом Хашимото активуються, на що вказує їхня здатність спонтанно виділяти тиреоїдні антитіла in vitro. Таким чином, щитовидна залоза є основним місцем секреції тиреоїдних антитіл. Додатковим доказом цього є зниження концентрації тиреоїдних антитіл у сироватці крові, яке відбувається після хірургічного втручання та під час введення антитиреоїдних препаратів пацієнтам із цим захворюванням. Однак є також докази того, що екстратиреоїдні лімфоїдні тканини можуть сприяти виробленню антитіл.
Антитіла до Tg і TPO — Майже всі пацієнти з тиреоїдитом Хашимото мають високі сироваткові концентрації антитіл до тиреоглобуліну (Tg) і тиреоїдної пероксидази (TPO). Ці антитіла також виявляються, хоча зазвичай у нижчій концентрації, у пацієнтів з іншими захворюваннями щитовидної залози, включаючи хворобу Грейвса, а також у багатьох суб’єктів без клінічних чи біохімічних ознак дисфункції щитовидної залози, але які ймовірно мають легкий тиреоїдит. У середньому до 20 відсотків усіх жінок можуть мати такі антитіла залежно від різних повідомлених аналізів.
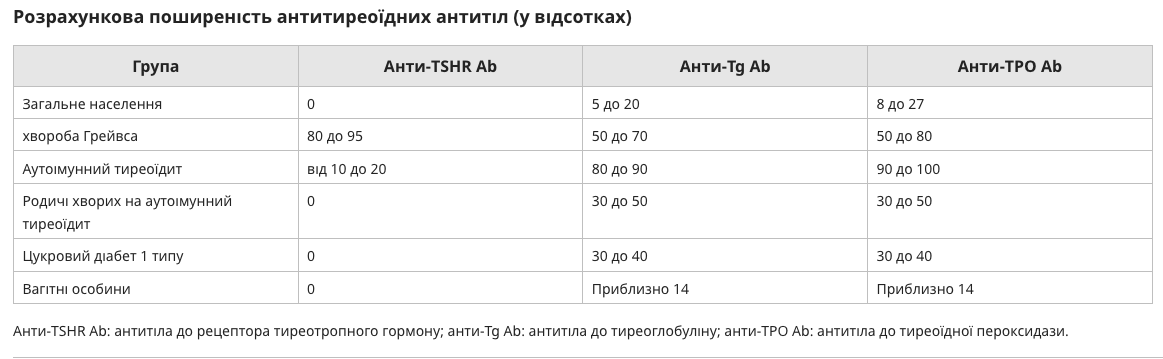
Функція антитіл щитовидної залози — антитіла Tg і TPO є поліклональними і зазвичай є антитілами до імуноглобуліну G1 (IgG1) або IgG3, але можуть бути будь-якого підкласу. Поліклональність цих аутоантитіл є переконливим доказом того, що вони є вторинним явищем до пошкодження щитовидної залози, спричиненого спочатку Т-клітинами. Їхня поліклональність також вказує на їхню змінну здатність фіксувати комплемент (головним чином IgG1 та IgG3) та їхню здатність проходити через плаценту. Проте цитотоксичність, опосередкована комплемент-залежними антитілами, дійсно може сприяти пошкодженню щитовидної залози у пацієнтів з тиреоїдитом Хашимото. Крім того, антитіла до ТПО можуть інгібувати активність ферменту ТПО, хоча значення таких спостережень in vitro є предметом суперечок. Це пояснюється тим, що важливість цих дій у порівнянні з апоптозом, опосередкованим Т-клітинами та цитокінами, швидше за все, незначна. Більш важливою є потенційна роль В-клітин, що секретують антитіла щитовидної залози, у представленні прикріпленого тиреоїдного антигену Т-клітинам.
Антитіла до рецептора ТТГ — Антитіла до рецептора тиреотропного гормону (ТТГ) зв’язуються з багатою на лейцин повторюваною областю позаклітинного домену рецептора. Вони можуть бути стимулюючими або блокуючими.
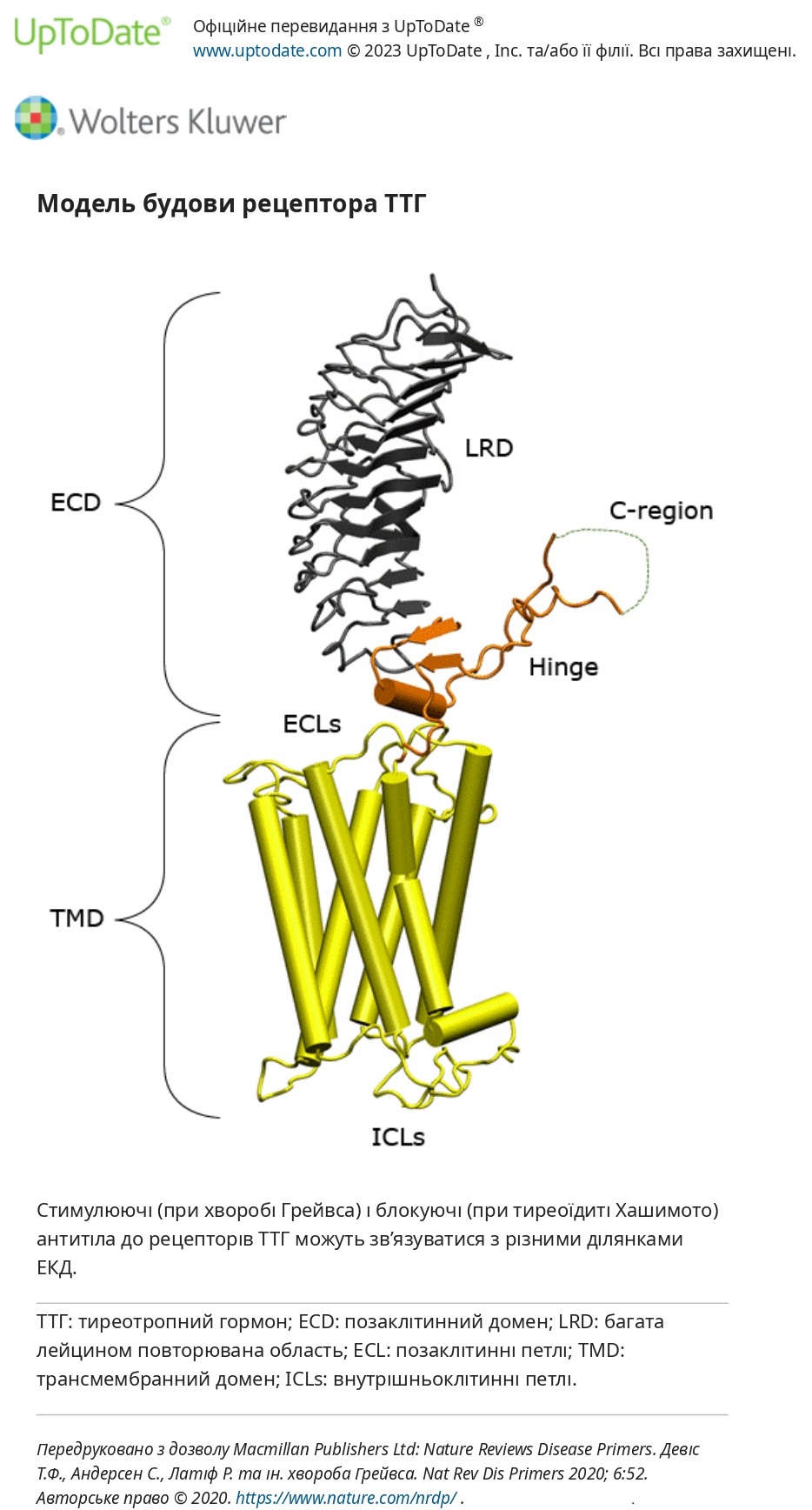
Стимулюючі антитіла до рецепторів ТТГ були вперше ідентифіковані за їх тривалою тиреоїдстимулюючою активністю, коли тваринам вводили сироватку крові пацієнтів із гіпертиреозом Грейвса; ця активність спочатку називалася тиреоїдним стимулятором тривалої дії (LATS). Було виявлено, що ці фракції IgG у сироватці цих пацієнтів мають тиреоїдстимулюючу дію, якісно подібну до дії ТТГ у багатьох біотестах, і блокують зв’язування радіоактивно міченого ТТГ з мембранами щитовидної залози; іншими словами, фракція IgG містила антитіла до рецептора ТТГ, які діяли як агоністи ТТГ.
За допомогою аналізів конкуренції за зв’язування ТТГ антитіла до рецептора ТТГ були виявлені в сироватці деяких пацієнтів з тиреоїдитом Хашимото. Ці антитіла, які також зазвичай є поліклональними, блокували дію ТТГ, а не активували його.
Як зазначалося вище, були описані пацієнти, які мали тиреоїдит Хашимото та гіпертиреоз Грейвса в різний час; у відповідний час їх сироватка містила переважання антитіл, що блокують рецептор ТТГ, або антитіл, що стимулюють рецептор ТТГ. Дослідження також припускають, що пацієнти з Хашимото також можуть мати стимулюючі антитіла до рецепторів ТТГ, але які не здатні стимулювати більшу кількість синтезу гормонів щитовидної залози через руйнування клітин щитовидної залози.
Як блокуючі, так і стимулюючі типи антитіл до рецепторів ТТГ можуть проникати через плаценту та впливати на функцію щитовидної залози.
РОЛЬ Т-КЛІТИН
Т-клітини у пацієнтів з тиреоїдитом Хашимото реагують з обробленими тиреоїдними антигенами та пептидами, отриманими з цих антигенів. Ці активовані Т-клітини виділяють цитокіни, які самі по собі активують ряд інших імунних клітин. Т-клітини відіграють три ролі в цій хворобі:
● посилення вироблення антитіл (тип функції Th2);
● апоптозна деструкція клітин щитовидної залози шляхом активації цитотоксичних Т-клітин (функція Th1);
● регуляція місцевої імунної відповіді через клітини Treg.
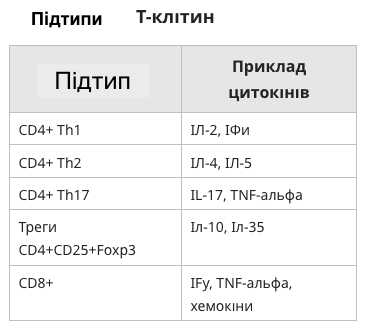
Th1 CD4+ лімфоцити при стимуляції антигеном секретують інтерлейкін-2 (IL-2), інтерферон гамма та фактор некрозу пухлини бета. Навпаки, клітини Th2 при стимуляції антигенами секретують IL-4 та IL-5. Обидва типи Т-клітин виявляються в тканині щитовидної залози пацієнтів з тиреоїдитом Хашимото, але клітини Th1 можуть переважати. В одному звіті клон Т-клітин викликав цитоліз аутологічних клітин щитовидної залози пацієнта з хворобою Хашимото. Це було прямим доказом індукції апоптозу епітеліальних клітин щитовидної залози.
Репертуар генів V рецептора антигену Т-клітин. Більшість рецепторів антигену на поверхні Т-клітин складаються з двох нековалентно з’єднаних ланцюгів (альфа та бета), кожен з яких має варіабельність (V), різноманіття (D) і з’єднання (J). ) областями та зі спільними постійними (C альфа та C бета) областями. Гени V, D і J кодують сайт на рецепторі, який розпізнає комплекс людського лейкоцитарного антигену (HLA), що забезпечує специфічність антигену. На додаток до багатьох генів V (>100) і J (>50), присутніх у геномі, випадкові додавання та делеції нуклеотидів у ділянці D додають надзвичайної складності репертуару рецепторів, спричиняючи цю ділянку, яку називають третьою комплементарністю. визначальна область (CDR3), яка є основним локусом розпізнавання антигену.
Хоча деякі пацієнти демонструють обмежений (олігоклональний) Т-клітинний репертуар, багато різних V-генів, що кодують рецептор Т-клітинного антигену, зазвичай присутні в Т-клітинах щитовидної залози та периферичної крові пацієнтів з тиреоїдитом Хашимото Це відкриття свідчить про те, що багато антигенних епітопів беруть участь у патогенезі захворювання до того часу, коли патологічний матеріал пацієнта стає доступним для дослідження. Навпаки, кількість V-генів, що кодують рецептори Т-клітинного антигену в Т-клітинах пацієнтів з гіпертиреозом Грейвса, зазвичай значно обмежена.
Імунна регуляція.
Імунна система здійснює певну частину свого загального контролю за допомогою регуляторних «супресорних» клітин (CD4+CD25+Foxp3+), які здійснюють пригнічення, опосередковане клітинами та цитокінами (так звані клітини Treg). Пацієнти з тиреоїдитом Хашимото можуть мати знижену кількість та/або неадекватну функцію таких циркулюючих регуляторних клітин CD4+CD25+. Пригнічення імунітету також може здійснюватися різними способами, включаючи безпосередній вплив цитокінів і вплив «анергізованих» Т-клітин. Також відбувається видалення клітин шляхом апоптозу, що сприяє антигенспецифічній толерантності.
МОЖЛИВІ МЕХАНІЗМИ УРАЖЕННЯ ЩИТОВИДНОЇ ЗАЛОЗИ
Було запропоновано декілька механізмів порушення толерантності до антигенів щитовидної залози та спричинення тиреоїдиту Хашимото. Вони включають поточні основні гіпотези для всіх аутоімунних захворювань: молекулярна мімікрія та активація спостерігачів, а також залучення клітин щитовидної залози до експресії лейкоцитарних антигенів людини (HLA) та активації апоптозу клітин щитовидної залози за допомогою взаємодії Fas ліганд-Fas.

Молекулярна мімікрія
Згідно з цією теорією, хвороба Хашимото спричинена імунною відповіддю на чужорідний антиген, такий як вірус, структурно подібний до ендогенної речовини. Наприклад, і бактерії, і люди мають білки теплового шоку. Під час бактеріальної інфекції у хазяїна є антитіла та реакція Т-клітин на білок теплового шоку мікроба. Потім ці антитіла та Т-клітини можуть перехресно реагувати з білком теплового шоку господаря. Якщо імітований білок був тиреоїдним антигеном на щитовидній залозі, то міг виникнути тиреоїдит. Крім того, потенціал такої мімікрії може бути пов’язаний із власним репертуаром генів HLA пацієнта та тим, як розпізнаються антигени щитовидної залози.
Активація спостерігачів — потрапляння вірусу клітин щитовидної залози або активованих неспецифічних лімфоцитів у щитовидну залозу може спричинити локальне вивільнення цитокінів, які самі по собі можуть активувати резидентні локальні тиреоїдні специфічні Т-клітини. Ця гіпотеза ефекту сторонніх спостерігачів підтверджена дослідженнями інсуліту на тваринах і моделі експериментального аутоімунного тиреоїдиту.
Експресія антигенів HLA клітинами щитовидної залози — молекули HLA класу II присутні на фолікулярних клітинах щитовидної залози пацієнтів із тиреоїдитом Хашимото, але не у нормальних суб’єктів. Експресія цих молекул на фолікулярних клітинах щитовидної залози може бути індукована гамма-інтерфероном та іншими цитокінами та хемокіновими продуктами Т-клітин, коли Т-клітини активуються (наприклад, вірусною інфекцією); експресія також може бути індукована вірусами безпосередньо. Клітини щитовидної залози, що експресують молекули головного комплексу гістосумісності (MHC) класу II, зможуть презентувати антигени, чужорідні або власні, Т-клітинам, тим самим активуючи Т-клітини. Наступні спостереження непрямо підтверджують цю гіпотезу:
● Індукція гамма-інтерферону молекул MHC класу II на фолікулярних клітинах щитовидної залози може викликати аутоімунний тиреоїдит у чутливих мишей.
● Фолікулярні клітини щитовидної залози, що експресують молекули МНС класу II, можуть презентувати вірусні пептидні антигени клонованим Т-клітинам людини.
● Аутологічні клітини щитовидної залози можуть зв’язуватися з клонованими Т-клітинами, специфічними для антигену щитовидної залози, за відсутності більш традиційних антигенпрезентуючих клітин.
Апоптоз клітин щитовидної залози
Загибель клітин щитовидної залози при хворобі Хашимото є центральним патологічним явищем. Нормальні епітеліальні клітини щитовидної залози експресують різноманітні рецептори смерті, включаючи Fas. Активація сигнальної системи Fas-ліганд-Fas може сприяти руйнуванню фолікулярних клітин, характерному для тиреоїдиту Хашимото. При аутоімунному тиреоїдиті фолікулярні клітини щитовидної залози індукуються до експресії функціонального Fas, а також ліганду Fas за допомогою цитокінової стимуляції антигенпрезентуючих клітин і клітин Th1 (наприклад, інтерлейкіну-1 [IL-1]). Це може спричинити самоапоптоз. В одному дослідженні, наприклад, апоптоз стався в клітинах щитовидної залози пацієнтів з тиреоїдитом Хашимото, що експресують Fas, або в нормальних клітинах щитовидної залози, в яких Fas був індукований IL-1b, після того, як клітини піддавалися впливу інших клітин щитовидної залози, які конститутивно експресують ліганд Fas. Таким чином, будь-яка подія, яка призводить до локального виробництва IL-1b, може ініціювати індукований клітинами щитовидної залози апоптоз клітин щитовидної залози. Більш імовірно, однак, що накопичені та активовані Т-клітини, що експресують ліганд Fas, можуть безпосередньо індукувати апоптоз тироцитів шляхом взаємодії з Fas на клітинах. Це важливий спосіб опосередкування аутоімунної загибелі клітин.
ГЕНЕТИЧНА СХИЛЬНІСТЬ
Зараз зрозуміло, що існує генетична схильність до тиреоїдиту Хашимото, і за останні роки багато чого було вивчено щодо генів сприйнятливості до цього розладу зокрема та до аутоімунного захворювання щитовидної залози в цілому. Докази генетичної схильності до тиреоїдиту Хашимото включають такі спостереження:
● Захворювання групується в сім’ях, іноді окремо, а іноді в поєднанні з хворобою Грейвса.
● Ризик рецидиву у братів і сестер >20.
● Коефіцієнт конкордантності у монозиготних близнюків становить від 30 до 60 відсотків, незважаючи на випадкові комбінації рецепторів Т-клітин і генів V антитіл під час рекомбінації.
● Частіше зустрічається у пацієнтів із синдромом Дауна та Тернера.
● Існує зв’язок (співвідношення ризику [RR] приблизно від 4 до 5) з певними алелями людського лейкоцитарного антигену (HLA), такими як DR3, і зв’язок із присутністю Arg 74 у кишені, що зв’язує амінокислоти DR3.
● Існує зв’язок з певними алелями невеликої кількості імунозалежних генів, включаючи гени цитотоксичного Т-лімфоцит-асоційованого антигену 4 (CTLA-4) і CD40, поверхневих молекул Т-клітин, які беруть участь в активації Т-клітин.
● Ген тиреоглобуліну (Tg) ( TG ) був пов’язаний з аутоімунним захворюванням щитовидної залози, і було запропоновано кодувати форми Tg з різною імунною реактивністю.
ПРОВОКУЮЧІ ФАКТОРИ
Інфекція, стрес, статеві стероїди, вагітність, споживання йоду та опромінення є відомими можливими факторами провокації тиреоїдиту Хашимото. Також можливий мікрохімеризм плода в щитовидній залозі матері.
Інфекція
Відомо, що жодна інфекція не викликає чи навіть тісно пов’язана з тиреоїдитом Хашимото у людей, хоча тиреоїдит може бути індукований у експериментальних тварин певними вірусними інфекціями. Пацієнти з підгострим гранулематозним тиреоїдитом (ймовірно вірусною інфекцією) та вродженою краснухою можуть мати антитіла до щитовидної залози протягом кількох місяців після хвороби, і інфекції можуть ініціювати експресію молекул головного комплексу гістосумісності (MHC) класу II у щитовидній залозі. залоза. Однак відомо, що жоден із захворювань не супроводжується хронічним тиреоїдитом, хоча докази аутоімунітету щитовидної залози можуть зберігатися.
Стрес
Другий випадок гіпертиреозу, описаний Паррі в 1825 році, був у 21-річної жінки, симптоми якої з’явилися через чотири місяці після того, як її випадково скинули зі сходів у інвалідному візку. Згодом стреси різних типів були пов'язані з гіпертиреозом Грейвса. Запропоновані механізми включають індукцію імунної супресії неантигенспецифічними механізмами, можливо, через вплив кортизолу або кортикотропін-рилізинг-гормону на імунні клітини з наступною імунною гіперактивністю, що призводить до аутоімунного захворювання щитовидної залози. Такий механізм може діяти при післяпологовому тиреоїдиті, який виникає через три-дев’ять місяців після пологів. Однак наразі немає жодних доказів зв’язку емоційного чи психологічного стресу з тиреоїдитом Хашимото, ймовірно, через тривалий природний перебіг захворювання, що вимагає пошкодження значної частини залози, перш ніж порушується функція щитовидної залози. Будь-який серйозний стрес міг статися багато років тому.

Стать
Більше жінок, ніж чоловіків, мають тиреоїдит Хашимото, що свідчить про роль статевих стероїдів. Однак літні жінки можуть частіше мати тиреоїдит Хашимото, ніж молоді жінки, що свідчить про те, що наявність або відсутність естрогену може не бути важливим фактором.
Більш вірогідним поясненням переважання жінок є роль Х-хромосоми. По-перше, існує спотворена інактивація Х-хромосоми, яка була виявлена у 34 відсотків близнюків з аутоімунним захворюванням щитовидної залози та лише в 11 відсотків контрольної групи, тому можливо, що власні антигени в інактивованій Х-хромосомі можуть не бути достатньо вираженим, щоб допускати толерантність. По-друге, ген FOXP3 асоціюється з аутоімунним захворюванням щитовидної залози. Ген FOXP3 знаходиться в Х-хромосомі та перетворює наївні Т-клітини на Treg-клітини, але зв’язок не є сильним і не спостерігається в жодному з загальногеномних досліджень асоціації (GWAS) хвороби Грейвса.
Вагітність
Вагітні особини повинні виробити толерантність до свого плоду. Під час вагітності спостерігається помітне збільшення CD4+CD25+ регуляторних Т-клітин, що призводить до зниження функції як Т-клітин, так і В-клітин, і вважають, що відскок від цієї імуносупресії сприяє розвитку післяпологового тиреоїдиту Хашимото. Імунні зміни, пов’язані з вагітністю, пов’язані зі зсувом до Т-клітин Th2 і зрушенням у профілях цитокінів.
Також відомо, що низка місцевих факторів на межі імунних клітин-трофобластів є важливими модуляторами імунної функції під час вагітності. Клітини трофобласта, розташовані в плаценті та піддані материнському імунному нагляду, служать фізичними бар’єрами між матір’ю та плодом, і було показано, що вони експресують кілька імуномодулюючих молекул, таких як людський лейкоцитарний антиген-G (HLA-G), Fas-ліганд та індоламін-2,3-діоксигеназа, а також секретує різноманітні цитокіни. HLA-G є одним із членів сімейства MHC класу I і, як відомо, пригнічує функцію природних кілерів і дозрівання дендритних клітин. Ліганд Fas взаємодіє з антигеном Fas і індукує апоптотичну загибель клітин фетальних антиген-реактивних материнських лімфоцитів. Індолеамін 2,3-діоксигеназа, яка каталізує триптофан в лімфоцитах, виявився вирішальним у підтримці алогенної вагітності у миші. Окрім цих локальних модуляторів, прогестерон, що виробляється плацентою, впливає на профілі цитокінів у всій імунній системі матері. Приблизно у 20 відсотків пацієнтів з післяпологовим тиреоїдитом розвивається класична хвороба Хашимото в наступні роки.
Споживання йоду
Легкий дефіцит йоду пов’язаний із меншою поширеністю хвороби Хашимото та гіпотиреозу, тоді як надмірне споживання пов’язане з більшою поширеністю. Як приклад, у Китаї аутоімунний тиреоїдит був виявлений у 0,3 відсотка пацієнтів із помірним дефіцитом йоду та у 1,3 відсотка пацієнтів із надмірним споживанням йоду. Подібним чином, препарати з високим вмістом йоду, такі як аміодарон, часто спровокують аутоімунний тиреоїдит, хоча припускають, що існують різні механізми.
Радіаційний вплив . Радіаційний вплив навколишнього середовища може збільшити ймовірність розвитку маркерів аутоімунного захворювання щитовидної залози, хоча докази цього та розвитку аутоімунного гіпотиреозу суперечливі.
Після трагічної аварії на Чорнобильській АЕС у дітей, які зазнали опромінення, виникла висока частота аутоантитіл до щитовидної залози. Крім того, через 12-15 років після аварії на Чорнобильській АЕС антитіла до тиреоїдної пероксидази (ТПО) були підвищені з залежністю доза-відповідь у когорті осіб, які зазнали опромінення. У тій же когорті було виявлено невелике збільшення субклінічного гіпотиреозу, пов’язаного з рівнем радіаційного опромінення. Проте ризик субклінічного гіпотиреозу був меншим при наявності антитіл до ТПО. В іншому дослідженні в Чорнобильському регіоні, де порівнювали людей із високим і низьким рівнями опромінення, поширеність антитіл до ТПО зросла, а потім зменшилася без доказів помітного рівня гіпотиреозу.
У популяційному дослідженні 4299 суб'єктів 160 мали професійний вплив іонізуючого випромінювання. Майже 60 відсотків досліджуваних працювали на атомній електростанції, а решта були або медичними, або лабораторними працівниками. Десять відсотків жінок, які зазнали радіаційного опромінення, відповідали критеріям аутоімунного захворювання щитовидної залози (антитіла до ТПО понад 200 міжнародних одиниць/мл і гіпоехогенність на ультразвуковому дослідженні) порівняно з 3,4 відсотками тих, хто не опромінювався. Суб'єкти, які понад п'ять років перебували під дією іонізуючого випромінювання, були в групі особливо високого ризику.
Однак у довгостроковому спостереженні за постраждалими від атомної бомби не було виявлено зв’язку «доза-реакція» для аутоімунного захворювання щитовидної залози, що є найпереконливішим доказом того, що зв’язок не існує. Подібним чином довготривале спостереження за людьми, які зазнали опромінення в результаті викидів з ядерної установки в Хенфорді, не виявило збільшення аутоімунних захворювань щитовидної залози та гіпотиреозу.

Фетальний мікрохімеризм — у пацієнтів з аутоімунним захворюванням щитовидної залози були виявлені фетальні клітини в щитовидній залозі матері. Такі клітини можуть ініціювати реакції «трансплантат проти хазяїна» в щитовидній залозі та відігравати значну роль у розвитку тиреоїдиту Хашимото. Однак на сьогодні це залишається гіпотетичним.
ДЖЕРЕЛО: https://www.uptodate.com