Клінічні настанови з менеджменту цукрового діабету 1-го типу
Дата публікації: 20.07.2023
Ключові слова: ендокринологія, глікований гемоглобін, глюкоза, інсулінотерапія, цукровий діабет 1 го типу

Цукровий діабет 1 типу (ЦД1), одне з найпоширеніших хронічних захворювань у дитячому віці, спричинено дефіцитом інсуліну після руйнування бета-клітин підшлункової залози, що продукують інсулін. Найчастіше він проявляється в дитинстві, але чверть випадків діагностується у дорослих. ЦД1 залишається найпоширенішою формою діабету в дитячому віці, незважаючи на зростання частоти цукрового діабету 2 типу (ЦД2).
Епідеміологія
Захворюваність на ЦД1 у дітей залежить від географії, віку, статі, сімейного анамнезу та етнічного походження.
Географічні відмінності. Захворюваність на цукровий діабет 1 у дітей різна по всьому світу. Найвищий зареєстрований рівень захворюваності на ЦД1 спостерігається у Фінляндії та Сардинії (від 45 до 65 на 100 000 дітей віком до 15 років). У Сполучених Штатах щорічна захворюваність на ЦД1 у дітей і підлітків становить 22,3 на 100 000 загалом із суттєвими відмінностями між расовими/етнічними групами (27,3 на 100 000 серед білої молоді неіспаномовного походження, 20,8 на 100 000 серед чорношкірої молоді та 16,3 на 100 000). в іспаномовній молоді).
Вік і стать. Вік появи ЦД1 у дитинстві має бімодальний розподіл, з одним піком у віці від чотирьох до шести років і другим у період раннього статевого дозрівання (від 10 до 14 років). Загалом приблизно 45 відсотків дітей приходять до 10 років. ЦД1 є причиною майже всіх випадків діабету у віці до 10 років, 90 відсотків випадків у дітей від 10 до 14 років і 80 відсотків у молоді від 15 до 19 років. Хоча більшість аутоімунних захворювань частіше зустрічаються у жінок, схоже, що немає статевих відмінностей у загальній захворюваності на ЦД1 у дітей. Однак у деяких дослідженнях ЦД1 частіше зустрічається у чоловіків. У всьому світі співвідношення чоловіків і жінок з діагнозом ЦД1 у молодому віці становить приблизно 1,5:1. Таке ж співвідношення чоловічої та жіночої статі також було зареєстровано у дітей молодше шести років в обсерваційному дослідженні в Массачусетсі.
Тенденції часу. Кілька звітів показують, що захворюваність на цукровий діабет 1 у дітей зростає в усьому світі, при цьому в Європі, на Близькому Сході та в Австралії цей показник зростає на 2–5 відсотків на рік. У Сполучених Штатах захворюваність зростає приблизно на 2 відсотки на рік (з 19,5 на 100 000 у 2002-2003 роках до 22,3 у 2014-2015 роках). Поширеність зросла з 1,48 на 1000 до 2,15 на 1000 за аналогічний період часу. Причини такої тенденції залишаються невідомими.Тенденції часу в межах вікових груп різняться між популяціями. У звіті з використанням даних із 17 європейських країн між 1989 і 2003 роками виявлено більший щорічний приріст серед дітей молодшого віку порівняно з підлітками. Навпаки, у Сполучених Штатах між 2001 і 2017 роками річна зміна поширеності дещо зменшилася для дітей молодшого віку, тоді як збільшилася для дітей старшого віку. Подібне зниження тенденцій серед дітей молодшого віку, народжених після 2000 року, спостерігалося в дослідженнях у Швеції і Новій Зеландії.
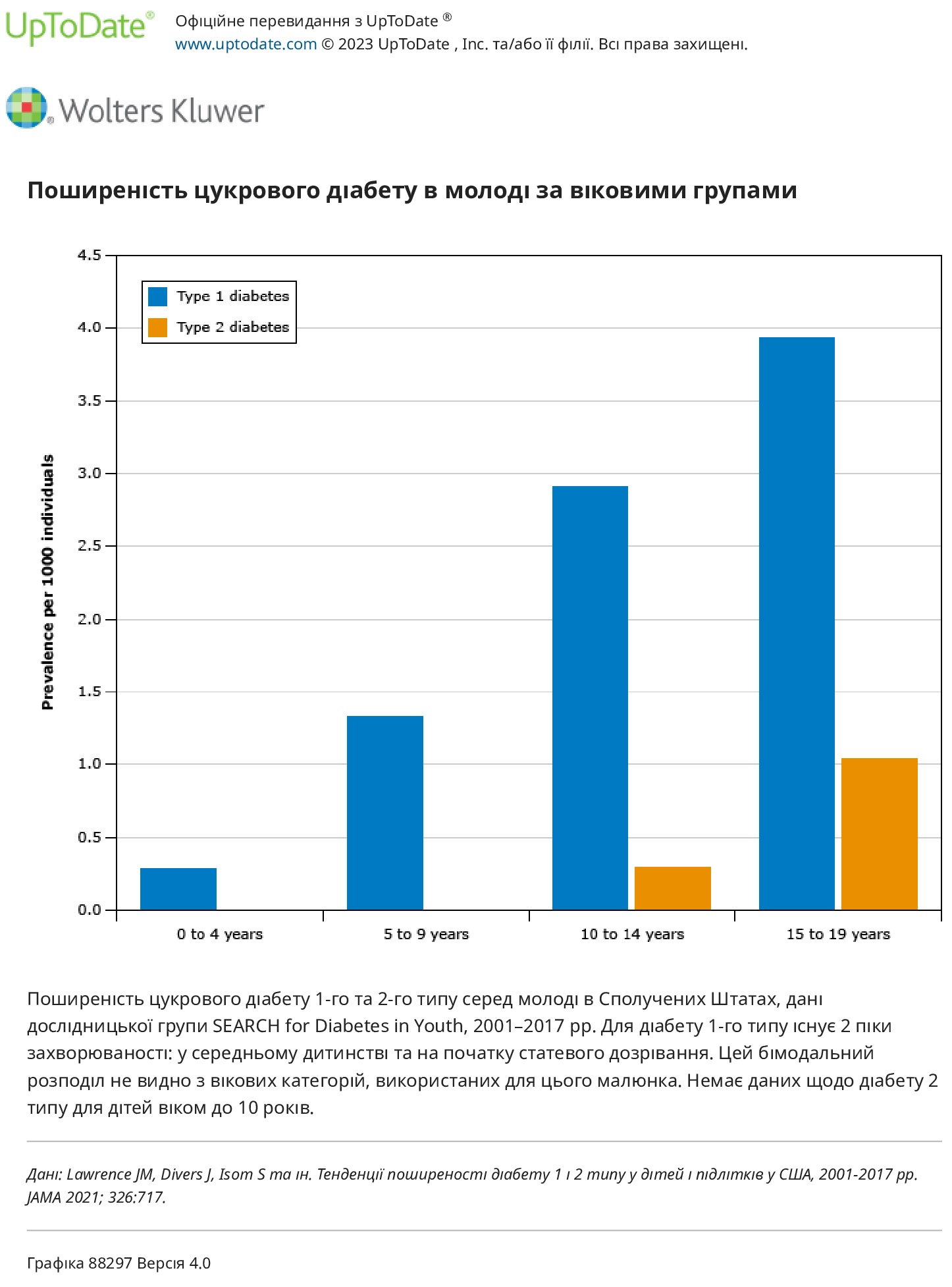
Фактори ризику
І генетичні фактори, і фактори навколишнього середовища сприяють ризику розвитку ЦД1.
Генетична сприйнятливість
Ризик розвитку ЦД1 протягом життя значно підвищується у близьких родичів пацієнта з ЦД1:
- Відсутність сімейного анамнезу – 0,4 відсотка
- Діти хворої мами – від 1 до 4 відсотків
- Діти хворого тата – від 3 до 8 відсотків
- Нащадки з ураженими обома батьками – повідомляється про 30 відсотків
- Не є братом-близнюком хворого пацієнта – від 3 до 6 відсотків до 20 років і 10 відсотків до 60 років
- Дизиготна двійня – 8 відсотків
- Монозиготна двійня – 30 відсотків протягом 10 років після діагностики першого близнюка і 65 відсотків конкордантності у віці 60 років
Інші можливі фактори ризику.
У генетично сприйнятливих осіб вплив одного або кількох факторів навколишнього середовища (наприклад, вірусів або харчових продуктів) ініціює імунну відповідь, яка зрештою спричиняє руйнування бета-клітин підшлункової залози, що виробляють інсулін. Ідентифікація цих факторів має привести до кращого розуміння патогенезу захворювання та допомогти у розробці стратегій запобігання ЦД1.
КЛІНІЧНА ПРЕЗЕНТАЦІЯ
Для клінічних цілей ЦД1 має три початкові прояви:
- Класичний новий початок полідипсії, поліурії та втрати ваги з гіперглікемією та кетонемією (або кетонурією)
- Діабетичний кетоацидоз (ДКА)
- Тихо (безсимптомне) захворювання з випадковим діагностуванням
Зараз визнано, що ЦД1 має чотири стадії:
- Стадія 1 – аутоімунність бета-клітин (≥2 острівцевих аутоантитіл), нормальний рівень глюкози в крові; немає симптомів;
- Стадія 2 – аутоімунність бета-клітин (≥2 острівцевих аутоантитіл) і аномальна толерантність до глюкози; зазвичай без симптомів;
- Стадія 3 – аутоімунність бета-клітин і підвищення рівня глюкози в крові вище діагностичних порогів; зазвичай з симптомами;
- Стадія 4 – Встановлений/тривалий ЦД1.
Класичний новий початок — гіперглікемія без ацидозу є найпоширенішим проявом ЦД1 у дітей у більшості груп населення. У пацієнтів зазвичай спостерігаються такі симптоми:
Поліурія
Поліурія виникає, коли концентрація глюкози в сироватці крові значно підвищується вище 180 мг/дл (10 ммоль/л), перевищуючи нирковий поріг для глюкози, що призводить до збільшення екскреції глюкози з сечею. Глюкозурія викликає осмотичний діурез (тобто поліурію) і гіповолемію. Поліурія може проявлятися у вигляді ніктурії, нічного нетримання сечі або нетримання сечі вдень у дитини. У дітей, які не навчені користуватися туалетом, вихователі можуть помітити підвищену частоту мокрих підгузків та/або надзвичайно важких (мокрих) підгузків.
Полідипсія
Полідипсія виникає внаслідок посиленої спраги через підвищення осмолярності сироватки внаслідок гіперглікемії та гіповолемії. Незважаючи на гіповолемію, у пацієнтів може не бути класичних ознак сухості слизових оболонок або зниження тургору шкіри.
Втрата ваги
Втрата ваги є результатом гіповолемії та посилення катаболізму. Дефіцит інсуліну у дітей з цукровим діабетом порушує утилізацію глюкози в скелетних м’язах і збільшує розпад жиру та м’язів. Спочатку апетит підвищується, але з часом діти більше відчувають спрагу, ніж голод, і кетоз призводить до нудоти та анорексії, що сприяє втраті ваги.
Пацієнти з цими симптомами зазвичай звертаються в амбулаторні умови, виглядаючи трохи хворими, з нечіткими скаргами, такими як втрата ваги та млявість. Класичні симптоми поліурії та полідипсії присутні у більш ніж 90 відсотків пацієнтів, але це не завжди початкові скарги й можуть стати очевидними лише після конкретного запитання про ніктурію та нічне нетримання сечі, часті та/або незвично вологі підгузки та постійну спрагу. Втрата ваги є симптомом приблизно у половини дітей.
Інші клінічні симптоми включають:
- Кандидоз промежини – це відносно поширений симптом у маленьких дітей та дівчат.
- Гострі розлади зору – вони поширені через зміни в осмотичному середовищі кришталика та, меншою мірою, водянистої та склоподібної вологи, що призводить до змін показника заломлення.
- Катаракта – катаракта іноді розвивається у дітей із тривалою гіперглікемією та може бути симптомом. У великому багатоцентровому дослідженні за участю осіб віком від 0,5 до 21 року катаракта була відзначена у 0,25 відсотка дітей і підлітків із ЦД1; вони були більш поширеними у жінок і пацієнтів з вищим гемоглобіном A1c (A1C) і старшим віком на початку діабету.
Діабетичний кетоацидоз
ДКА (гіперглікемія та кетоацидоз) є другою за поширеністю формою прояву ЦД1 у більшості популяцій. Симптоми подібні, але зазвичай більш серйозні, ніж у пацієнтів без ацидозу. Крім поліурії, полідипсії та втрати ваги, у пацієнтів з кетоацидозом може спостерігатися фруктовий запах і неврологічні симптоми, включаючи сонливість і млявість. ДКА може бути неправильно витлумачено як гостру хворобу блювання, оскільки класичні педіатричні симптоми дегідратації (зменшення сечовипускання) маскуються поліурією, яка асоціюється з глюкозурією. Повідомляється, що частота ДКА як початкового прояву ЦД1 у дітей становить приблизно 30 відсотків, але коливається від 15 до 70 відсотків. Маленькі діти (віком до 6 років) або діти з несприятливим соціально-економічним становищем частіше мають ДКА як початковий прояв ЦД1. Серед дітей віком до трьох років більша частина мали ДКА як початковий прояв ЦД1.
Діти з ДКА потребують госпіталізації, регідратації та замісної інсулінотерапії. Безсимптомний прояв
Деяким дітям буде діагностовано ЦД1 до появи клінічних симптомів. Ця презентація є найменш поширеною і зазвичай виникає у дітей, у яких є ще один близький член родини з ЦД1, за якими вони ретельно спостерігаються. Діагноз часто ставить або член сім’ї, або клініцист із високим індексом підозри. Діти з ураженими близькими родичами також можуть пройти скринінг на аутоантитіла до підшлункової залози для оцінки ризику захворювання, хоча це не є клінічною рекомендацією. Ці діти можуть бути класифіковані як такі, що мають діабет стадії 1 або 2, використовуючи рекомендації Міжнародного товариства з діабету у дітей та підлітків. Діагноз цукрового діабету 2 стадії ставиться на підставі підвищеної концентрації глюкози в крові за критеріями, наведеними нижче.

Діагностика
ЦД1 є одним із кількох різних типів цукрового діабету. Початковий етап - діагностика цукрового діабету. Другим кроком є иференціація ЦД1 від інших причин діабету на основі клінічної картини пацієнта та лабораторних досліджень.
Діагностичні критерії діабету.Діагноз цукрового діабету встановлюється на підставі однієї з наступних чотирьох ознак аномального метаболізму глюкози
- Рівень глюкози в плазмі крові натще ≥126 мг/дл (7 ммоль/л) більше одного разу. Голодування визначається як відсутність споживання калорій протягом принаймні восьми годин.
- Випадковий рівень глюкози у венозній плазмі ≥200 мг/дл (11,1 ммоль/л) у пацієнта з класичними симптомами гіперглікемії.
- Рівень глюкози в плазмі ≥200 мг/дл (11,1 ммоль/л), виміряний через дві години після навантаження глюкозою 1,75 г/кг (максимальна доза 75 г) у пероральному тесті на толерантність до глюкози. Більшість дітей і підлітків мають симптоми та концентрацію глюкози в плазмі значно вище ≥200 мг/дл (11,1 ммоль/л); таким чином, пероральний тест на толерантність до глюкози рідко необхідний для діагностики ЦД1.
- Глікований гемоглобін (A1C) ≥6,5 відсотка (з використанням аналізу, сертифікованого Національною програмою стандартизації глікогемоглобіну). Цей критерій повинен бути підтверджений іншим показником гіперглікемії.
За винятком випадків однозначної симптоматичної гіперглікемії діагноз слід підтвердити повторним тестуванням.
За відсутності постійного моніторингу глюкози A1C є цінним методом контролю глікемічного контролю. A1C вимірює відсоток гемоглобіну А, зв’язаного з глюкозою через неферментативну глікацію, і є корисним показником середнього глікемічного контролю за 10–12 тижнів до часу вимірювання.
Диференційна діагностика ЦД1 та ЦД2
Наступним кроком після встановлення діагнозу цукрового діабету є відрізнити ЦД1 від цукрового діабету 2 типу (ЦД2). ЦД1 характеризується головним чином дефіцитом інсуліну, тоді як ЦД2 характеризується головним чином резистентністю до інсуліну з відносним дефіцитом інсуліну. Оскільки поширеність ожиріння та захворюваність на цукровий діабет 2 типу зростає серед дітей і підлітків, стає все більш важливим розглядати обидва типи. Жоден набір критеріїв або діагностичних тестів не може чітко відрізнити ЦД1 від ЦД2. Тому диференціація між двома типами ґрунтується на поєднанні клінічних проявів та анамнезу, що часто підтверджується лабораторними дослідженнями

Клінічна характеристика
- Габітус тіла – Пацієнти з ЦД 2 типу зазвичай мають ожиріння (індекс маси тіла ≥95- го процентиля для віку та статі). Навпаки, діти з ЦД1 рідше мають надлишкову масу тіла і часто нещодавно втрачають вагу, хоча до 25 відсотків мають надлишкову вагу (індекс маси тіла ≥85-95-го процентиля )
- Вік. Пацієнти з цукровим діабетом 2 типу зазвичай з’являються після настання статевого дозрівання, тоді як пацієнти з цукровим діабетом 1 типу часто з’являються в більш ранньому віці. Приблизно 45 відсотків дітей із ЦД1 виявляються до 10 років. Навпаки, майже всі випадки цукрового діабету 2-го типу виникають після 10 років.
- Інсулінорезистентність. Пацієнти з цукровим діабетом 2 типу часто мають чорний акантоз (ознака інсулінорезистентності), гіпертензію, дисліпідемію та синдром полікістозних яєчників (у дівчат). Ці знахідки менш імовірні у дітей із ЦД1.
- Сімейний анамнез. До 10 відсотків пацієнтів із ЦД 1 мають ураженого близького родича, тоді як від 75 до 90 відсотків пацієнтів із ЦД 2 мають ураженого близького родича.
Лабораторне обстеження
Ми пропонуємо включити в оцінку такі лабораторні обстеження, щоб допомогти розпізнати діабет 1-го та 2-го типу:
- Аутоантитіла підшлункової залози – виміряйте аутоантитіла проти GAD65 (декарбоксилази глутамінової кислоти 65), IA2 (фрагмент 40K тирозинфосфатази), інсуліну та ZnT8 (транспортер цинку 8). Цю панель тестів слід виконувати під час звернення до лікаря або незабаром після початку інсулінотерапії. Антитіла до інсуліну можуть розвинутися приблизно через 10-14 днів після впливу екзогенного інсуліну.
Більшість пацієнтів із цукровим діабетом 1 типу мають одне або кілька із зазначених вище панкреатичних аутоантитіл, що вказує на аутоімунне руйнування бета-клітин підшлункової залози; це іноді називають діабетом типу 1А. Навпаки, до 30 відсотків осіб із клінічними характеристиками ЦД 2 типу мають позитивні аутоантитіла та можуть мати повільно прогресуючий тип аутоімунного діабету.
- Рівні інсуліну та С-пептиду – ми вимірюємо ці рівні для дітей із клінічними характеристиками, які підвищують ймовірність цукрового діабету 2 типу. Пацієнтам із нещодавно встановленим діагнозом ці тести слід проводити після того, як дитина одужає від початкового гіперглікемічного стресу, оскільки рівні інсуліну та С-пептиду можуть бути пригнічені тяжкою гіперглікемією (токсичність глюкози) та гострим захворюванням.
У дітей із цукровим діабетом 1 рівень інсуліну натщесерце та С-пептиду є неадекватно низькими відносно супутньої концентрації глюкози в плазмі (тобто низькі або в межах норми, незважаючи на гіперглікемію). Навпаки, високий рівень інсуліну та С-пептиду натще свідчить про ЦД2.
ЛІКУВАННЯ
Інсулінотерапія є основою лікування цукрового діабету 1 типу (ЦД1). Метою інсулінотерапії є заміщення дефіциту гормону та досягнення нормоглікемії. Однак ця мета залишається недосяжною через труднощі відтворення щохвилинних варіацій секреції ендогенного (фізіологічного) інсуліну безпосередньо у ворітній вені порівняно з доставкою екзогенного інсуліну, який всмоктується з місця підшкірної ін’єкції або інфузії в системну систему. тираж. Гострі та хронічні ускладнення діабету в основному пов’язані з гіперглікемією як наслідком неспроможності екзогенної доставки інсуліну повністю імітувати фізіологічну секрецію інсуліну.
Моніторинг глікемічного контролю
Метою лікування як у дітей, так і у дорослих є підтримання контролю рівня глюкози якомога ближче до норми, наскільки це безпечно, шляхом збалансування ризиків довгострокових ускладнень діабету та короткострокових ризиків гіпоглікемії та діабетичного кетоацидозу (ДКА). Загальні цілі однакові для всіх вікових груп, але можуть відрізнятися залежно від індивідуальних особливостей пацієнта.
Моніторинг глікемічного контролю складається з трьох компонентів:
- Гемоглобін A1c – гемоглобін A1c (A1C; також званий глікованим гемоглобіном крові або глікогемоглобіном) використовується для оцінки тривалого контролю глікемії.
- Рівень глюкози в крові. Часті вимірювання рівня глюкози в крові використовуються для моніторингу гіпо- та гіперглікемії, а також для коригування дозування інсуліну та споживання вуглеводів. Ці вимірювання можна провести за допомогою капілярного зразка (пальцем) і вимірювання за допомогою домашнього глюкометра або за допомогою пристрою для постійного підшкірного моніторингу рівня глюкози.
- Кетони – якщо розвивається виражена та стійка гіперглікемія, необхідно провести тестування на кетони в крові або сечі. Раннє виявлення та лікування кетозу може допомогти запобігти або припинити ДКА.
Цільовий рівень гемоглобіну A1c — ми пропонуємо цільовий A1C <7 відсотків (53 ммоль/моль) для більшості дітей і підлітків, які мають доступ до комплексного лікування діабету, щоб уникнути мікросудинних і макросудинних ускладнень, відповідно до рекомендацій Американської діабетичної асоціації (ADA). та Міжнародне товариство дитячого та підліткового діабету. Щоб досягти цільового A1C <7 відсотків, цільовий рівень глюкози в крові становить приблизно від 70 до 144 мг/дл (4-8 ммоль/л) до їжі та від 70 до 180 мг/дл (4-10 ммоль/л) загалом.

Моніторинг рівня глюкози в крові. Частий моніторинг рівня глюкози має вирішальне значення для лікування ЦД1, щоб забезпечити:
- Загальний глікемічний контроль. Оптимальний глікемічний контроль вимагає частого контролю рівня глюкози та відповідного коригування дози інсуліну. Послідовний аналіз рівня глюкози в крові за допомогою пальця (CGM) дозволяє дитині та родині/опікуну ознайомитися з глікемічною реакцією пацієнта на різні види та кількість їжі, фізичні вправи та стрес. Показано, що частий моніторинг покращує контроль глікемії у дітей.
- Виявлення гіпоглікемії та гіперглікемії – частий моніторинг рівня глюкози також важливий для виявлення гострих епізодів гіпер- та гіпоглікемії. Діти та їхні батьки/опікуни погано розпізнають високий або низький рівень глюкози в крові лише за симптомами. У дослідженні, яке порівнювало самостійні повідомлення про гіпоглікемію з результатами глюкометра, діти віком від 6 до 11 років та їхні батьки не змогли виявити приблизно половину епізодів клінічно значущої гіпоглікемії (<55 мг/дл). Епізоди гіперглікемії ще частіше залишаються нерозпізнаними пацієнтом; регулярний моніторинг рівня глюкози допомагає виявити ці епізоди, спонукаючи до коригування дозування інсуліну та моніторингу кетозу, який може запобігти або зупинити ДКА.
- Безперервний моніторинг рівня глюкози. Для більшості дітей ми пропонуємо використовувати CGM, а не палички для моніторингу рівня глюкози в крові, якщо такий пристрій доступний і пацієнт або особи, які доглядають за ним, можуть безпечно використовувати його відповідно до кількох рекомендацій. Ця технологія допомагає оптимізувати глікемічний контроль для багатьох пацієнтів і особливо корисна для тих, хто в анамнезі не підозрює про гіпоглікемію, і для маленьких дітей
ПРЕПАРАТИ ІНСУЛІНУ
Типи інсуліну можна класифікувати за початком і тривалістю дії. Зазвичай використовувані інсуліни включають:
- Інсуліни швидкої дії (наприклад, лізпро, аспарт, глулізин) зазвичай вводять у вигляді болюса перед їдою за 5-15 хвилин до їди. Доза залежить від вмісту вуглеводів у їжі та рівня глюкози в крові. Дітям молодшого віку, у яких прийом непередбачуваний, при необхідності інсулін швидкої дії можна вводити після їжі. Однак мета полягати в тому, щоб ввести дозу інсуліну, як тільки батьки або опікун дізнаються, скільки грамів вуглеводів дитина з’їсть, щоб уникнути невідповідності вуглеводів і інсуліну та високого, а потім низького рівня глюкози в крові. Препарат інсуліну аспарт з двома доданими ексципієнтами (ніацинамід для збільшення швидкості всмоктування та L-аргінін для стабілізації складу) доступний, який діє ще швидше та може бути введений під час або протягом 20 хвилин після прийому їжі. Як тільки дитина досягне достатнього віку, щоб надійно приймати інсулін перед їдою, вкрай необхідно змінити режим введення, щоб можна було досягти кращого контролю глікемії.
- Інсулінова помпова терапія використовує швидкодіючий інсулін для забезпечення базального рівня інсуліну, а також для прандіальних болюсів або корекційних доз для гіперглікемії.
- Препарати інсуліну тривалої дії (наприклад, інсулін гларгін , інсулін детемір) вводять один або два рази на день. Інсулін деглюдек має більшу тривалість дії, але все ще вводиться один раз на день. Загалом, якщо використовується одноразова ін’єкція, її слід робити ввечері, щоб забезпечити доступність інсуліну вночі та протидіяти контррегуляторній гормональній реакції рано вранці. Проте деяким дуже маленьким дітям, які мають більший ризик гіпоглікемії, краще вводити інсулін тривалої дії вранці.
Рідше використовувані інсуліни включають:
- Інсуліни короткої дії (наприклад, звичайний інсулін) більше не входять до планового лікування ЦД1 у Сполучених Штатах. При застосуванні для болюсів перед їдою його зазвичай вводять за 20–30 хвилин до їди. Цей тип інсуліну також може бути корисним за особливих обставин, таких як гастропарез і прийом їжі з високим вмістом жиру, якщо його змішувати з інсуліном швидкої дії. Крім того, інсулін короткої дії іноді використовується в поєднанні з інсуліном середньої тривалості дії для контролю нічних безперервних годувань у пацієнтів з діабетом, пов’язаним з кістозним фіброзом, хоча інсулінова помпа стає все більш популярною серед цих пацієнтів.
- NPH (нейтральний протамін-хагедорн) інсулін середньої тривалості дії зазвичай призначається цілеспрямовано в комбінації з інсулінами тривалої дії. Інсулін середньої тривалості дії забезпечує певне покриття для їжі. Наприклад, інсулін NPH, введений перед сніданком, покриє обід, що може бути корисним для маленьких дітей, у яких немає шкільної медсестри для введення інсуліну швидкої дії перед обідом. Використання інсуліну проміжної дії втратило популярність, коли стали доступними препарати інсуліну тривалої дії, враховуючи вищий ризик гіпоглікемії при першому, особливо коли споживання їжі не відповідає піку дії інсуліну. Інсулін середньої тривалості дії все ще іноді використовується в особливих ситуаціях, наприклад, у комбінації з інсуліном короткої дії для покриття нічних безперервних годувань у пацієнтів з цукровим діабетом, пов’язаним з кістозним фіброзом, або у вигляді фіксованої комбінації з інсуліном короткої або швидкої дії для введення двічі на день пацієнтам, які погано дотримуються схем більш частого введення інсуліну. Він також часто використовується в ситуаціях з обмеженими ресурсами, оскільки він набагато дешевший.
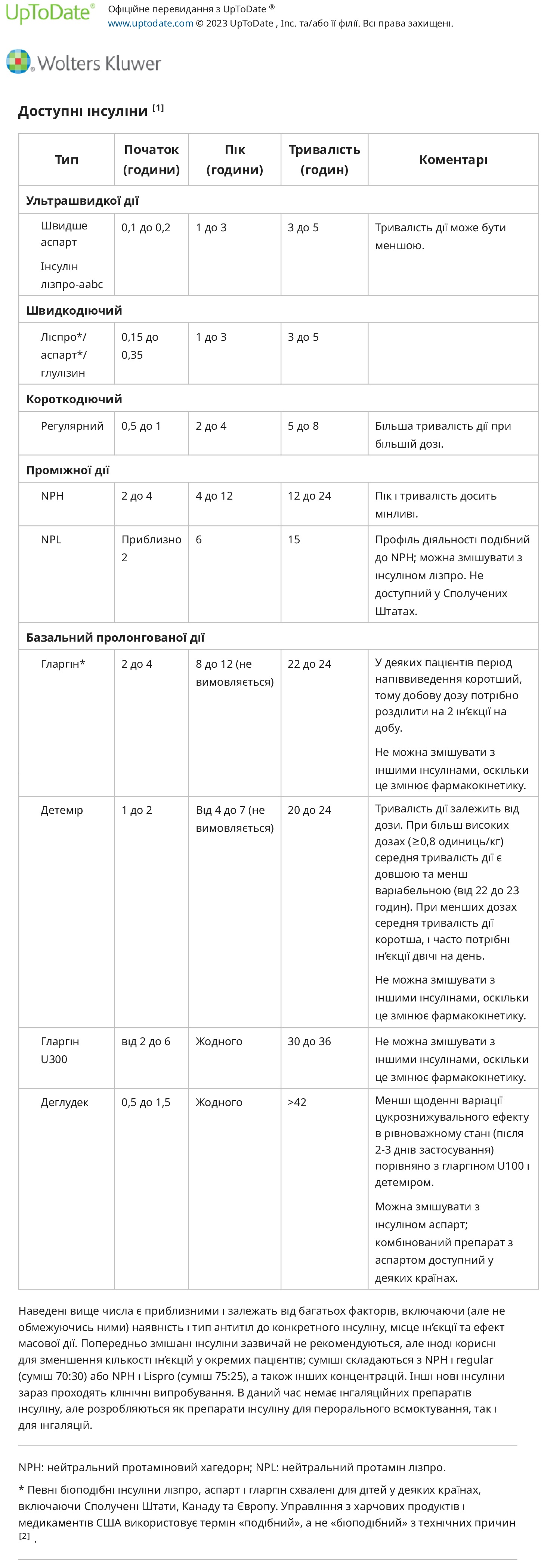
ЦІННІСТЬ ІНТЕНСИВНОГО РЕЖИМУ
Введення інсуліну можна класифікувати як «інтенсивне» або «традиційне» залежно від частоти та типу дозування інсуліну. Загалом рекомендуються інтенсивні режими, оскільки вони з більшою ймовірністю досягнути цільових показників глікованого гемоглобіну (A1C) і мають кращі клінічні результати.
- Інтенсивний режим забезпечує інсулін таким чином, що ближче до фізіологічної секреції інсуліну, ніж традиційна терапія. Він складається з базальної дози інсуліну для придушення ліполізу та вироблення глюкози в печінці з додатковими болюсами інсуліну швидкої дії перед їдою та перед перекусом для мінімізації підвищення рівня глюкози в крові після прийому їжі. Прандіальні болюси регулюються відповідно до вмісту вуглеводів у їжі, а також виміряного поточного рівня глюкози в крові. Цей підхід забезпечує більшу гнучкість, ніж звичайний режим, щодо часу та вмісту вуглеводів у їжі. Схеми введення інсуліну за допомогою інсулінової помпи також вважаються інтенсивними.
- Для лікування діабету традиційно використовувався звичайний режим, але сьогодні цей підхід є рідкісним, оскільки навряд чи він досягне оптимального контролю глікемії. Цей тип схеми, як правило, складався з фіксованих доз інсуліну середньої тривалості дії (NPH [нейтральний протаміновий хагедорн]) принаймні двічі на день (під час сніданку та другої дози або під час вечері, або перед сном), із швидкодіючим (тобто лізпро, аспарт або глулізин) або інсулін короткої дії («звичайний»), який вводять два-три рази на день. Оскільки дози є фіксованими, цей тип режиму вимагає коригування способу життя таким чином, щоб прийом їжі та інтенсивна фізична активність відбувалися за відносно фіксованим щоденним розкладом. Дві третини загальної добової дози вводять перед сніданком (дві третини як NPH і одну третину як інсулін швидкої або короткої дії) і одну третину перед вечерею та перед сном (від третини до половини швидкої дози). - або інсулін короткої дії перед обідом і від двох третин до половини у вигляді NPH перед сном). Дозу NPH можна розділити таким чином, щоб частина була доставлена перед обідом, а решта перед сном.
- Модифікована інтенсивна схема іноді використовується для дітей і пропонує переваги меншої кількості ін’єкцій у шкільні години (корисно, коли шкільна медсестра недоступна) і гнучкості щодо прийому їжі вдома. Така схема включає введення інсуліну середньої тривалості дії (NPH) з інсуліном швидкої дії (на основі підрахунку вуглеводів) під час сніданку та інсуліну гларгін або детемір з дозою інсуліну швидкої дії (на основі підрахунку вуглеводів) під час вечері. Цей режим дозволяє уникнути потреби в обідній дозі інсуліну швидкої дії.
ДОЗУВАННЯ ІНСУЛІНУ
Початкова схема — для дитини з нещодавно діагностованим ЦД1 початкова доза інсулінотерапії визначається наступним чином:

Оцініть загальну потребу в інсуліні — Першим кроком є оцінка загальної потреби в інсуліні. Це залежить від маси тіла, віку та стадії статевого дозрівання дитини, а також від того, чи є у дитини кетоацидоз, чи вона приймає ліки, які можуть підвищити резистентність до інсуліну (такі як глюкокортикоїди). Загалом, дитина з нещодавно виявленим діагнозом потребує початкової загальної добової дози інсуліну від 0,3 до 1 одиниць/кг/день. Дітям препубертатного віку зазвичай потрібні відносно низькі початкові дози (0,3-0,7 одиниці/кг/добу). Вищі дози (наприклад, від 0,7 до 1 одиниці/кг/добу) потрібні дітям пубертатного віку, пацієнтам з кетоацидозом або пацієнтам, які отримують терапію глюкокортикоїдами. Цю орієнтовну дозу буде скориговано вгору або вниз залежно від реакції дитини на початковий режим. Після коригування загальна доза інсуліну може становити лише 0. 25 одиниць/кг/день (або навіть менше) для деяких дітей під час «періоду медового місяця». Після періоду «медового місяця» дітям препубертатного віку зазвичай потрібно від 0,7 до 1,0 одиниць/кг/день, а дітям пубертатного віку — від 1 до 1,5 одиниць/кг/день.
Обчисліть дозу базального інсуліну. Наступним кроком є розрахунок дози базального інсуліну. У дітей потреба в базальному інсуліні (наприклад, інсулін гларгін, детемір або деглюдек або базальна швидкість помпи) становить приблизно 50 відсотків від загальної добової дози. Потреба може бути нижчою (зазвичай від 30 до 40 відсотків) у дітей, які швидко ростуть. Він може бути вищим (до 60 відсотків) у пацієнтів, які дотримуються дієти з низьким вмістом вуглеводів.
Розрахуйте прандіальний інсулін — на додаток до базального інсуліну перед кожним прийомом їжі або перекусом слід вводити дозу інсуліну швидкої дії. Доза залежить від очікуваної кількості вуглеводів, які будуть прийняті, і передпрандіальної концентрації глюкози в крові.
Покриття вуглеводами (також називається «вуглеводним співвідношенням інсуліну [ICR]») оцінюється на основі загальної дози інсуліну пацієнта таким чином:
Кількість вуглеводів (грами), що покривається 1 одиницею інсуліну = 500 ÷ загальна добова доза інсуліну (за умови, що використовується інсулін швидкої дії)
Корекція дози для підвищеного рівня глюкози в крові. Для пацієнтів із рівнем глюкози в крові вище цільового діапазону доза інсуліну перед їдою додатково коригується на основі наступного розрахунку:
Розрахункове зниження рівня глюкози в крові для кожної одиниці введеного інсуліну = 1500 або 1800 ÷ загальна добова доза інсуліну

Подальші зміни дози інсуліну
Коригування режиму — запланований режим введення інсуліну слід періодично коригувати на основі загального контролю глікемії (на що вказує рівень гемоглобіну A1c [A1C], час перебування в діапазоні та інші показники CGM) та епізоди гіперглікемії та гіпоглікемії. Частий перегляд і коригування режиму є важливими, оскільки дозування інсуліну суттєво різниться між людьми, а також змінюється з часом.
- Коригування дози інсуліну зазвичай виконується з кроком або зменшенням від 10 до 20 відсотків за раз на основі показань рівня глюкози в крові з пальця або результату безперервного моніторингу глюкози (CGM). Часті коригування дози (наприклад, щоденної) часто необхідні протягом перших кількох тижнів після встановлення діагнозу.
- Коли дитина вступає у фазу «медового місяця» діабету (зазвичай через кілька тижнів після початку інсулінотерапії), для уникнення гіпоглікемії, як правило, потрібне швидке скорочення базального та болюсного режимів інсуліну.
- Загальну добову дозу інсуліну та співвідношення базальної до загальної дози інсуліну слід переглядати під час кожного візиту, щоб переконатися, що вони знаходяться в очікуваних межах.
- Загальна добова доза інсуліну після фази медового місяця становить від 0,7 до 1,5 одиниць/кг/день. Типовий діапазон для дітей препубертатного віку становить від 0,7 до 1 одиниці/кг/день, хоча дуже маленьким дітям можуть знадобитися менші дози. У період статевого дозрівання добова потреба в інсуліні зростає, як правило, до 1-1,5 одиниць/кг/день через підвищення інсулінорезистентності через високі концентрації гормону росту.
- Базальний інсулін повинен складати приблизно від 30 до 60 відсотків загальної добової дози; нижча ціль підходить для дітей, які швидко ростуть, а вища ціль підходить для тих, хто дотримується дієти з низьким вмістом вуглеводів.
- Базальний режим можна регулювати з різною швидкістю в різний час доби. Наприклад, деяким дітям потрібна вища базальна норма рано вранці через підвищення контррегуляторних гормонів і між сніданком і обідом (коли вони малорухливі в школі) і нижча норма під час і протягом певного періоду після фізичних вправ (залежно від тривалості та характеру вправ).
- Деяким дітям також можуть знадобитися різні співвідношення вуглеводів, різні коригуючі коефіцієнти (ISF) і різні цільові концентрації глюкози в крові в різний час доби, залежно від рівня активності, а також як стратегія зниження ризику нічної гіпоглікемії.
ДЖЕРЕЛА:
1. https://www.uptodate.com/contents/epidemiology-presentation-and-diagnosis-of-type-1-diabetes-mellitus-in-children-and-adolescents?search=diabetes%201&source=search_result&selectedTitle=3~150&usage_type=default&display_rank=3
2. https://www.uptodate.com/contents/insulin-therapy-for-children-and-adolescents-with-type-1-diabetes-mellitus?source=autocomplete&index=1~2&search=diabetes%20type%201%20tr
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу
Клінічні випадки. Хвороба легіонерів

МОЗ пропонує змінити правила електронних і ...

Клінічний випадок. Ураження шкіри.

Уніфікований клінічний протокол первинної ...
Клінічний випадок. ЕКГ

Стандарт медичної допомоги «Хвороба Каваса ...