Мікоплазмова інфекція у дітей
Дата публікації: 19.11.2024
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: мікоплазмова інфекція, респіраторний мікоплазмоз, атипова пневмонія у дітей, настанови Аксемедін

Mycoplasma pneumoniae є одним з небагатьох видів Mycoplasma, які часто викликають інфекцію у людей. M. pneumoniae переважно викликає інфекцію дихальних шляхів, але має широкий спектр клінічних проявів.
Мікробіологія та патогенез
Термін «мікоплазма» використовується для позначення будь-якого організму в класі Mollicutes, який складається з п’яти родів (Mycoplasma, Ureaplasma, Acholeplasma, Anaeroplasma та Asteroloplasma).
M. pneumoniae не має клітинної стінки, що відрізняє його від інших патогенних бактерій. Незважаючи на те, що він росте як в аеробних, так і в анаеробних умовах і може бути виділений на середовищах, доповнених сироваткою, це вибагливий організм, і виділення зазвичай не проводиться в клінічних лабораторіях.
Механізми, за допомогою яких мікоплазми викликають інфекцію, стають все краще зрозумілими. Вони включають прямі ефекти бактерій, непрямі імуноопосередковані ефекти та ефекти, опосередковані через васкуліт або тромбоз, вторинні цитокінам, хемокінам або імуномодуляції.
Патогенні мікоплазми мають спеціалізовані верхівкові органели, які опосередковують їх взаємодію з клітинами-хазяїнами через трансмембранні білки (наприклад, P1, P30), які сприяють адгезії та рухливості ковзання вздовж респіраторного епітелію. Toll-подібний рецептор 2 також вважається важливим для зв’язування мікоплазми та активації медіаторів запалення, включаючи цитокіни.
Адгезивні білки M. pneumoniae мають особливу спорідненість до епітелію дихальних шляхів. Після приєднання M. pneumoniae виробляє перекис водню та супероксид, спричиняючи пошкодження епітеліальних клітин та пов’язаних з ними війок. Виживання досягається шляхом поверхневого паразитування клітин-мішеней, придбання основних біосинтетичних попередників, а в деяких випадках — проникнення в клітину та внутрішньоклітинного виживання. Після гострої інфекції тривале безсимптомне носійство може бути опосередковане внутрішньоклітинною інвазією, індукованою бактеріями перебудовою цитоскелету та ремоделюванням тканин.
На клінічні прояви інфекції M. pneumoniae впливає імунна компетентність та імунна відповідь організму-хазяїна, що свідчить про те, що деякі патогенетичні ознаки інфекції M. pneumoniae, зокрема позалегеневі прояви (наприклад, гемолізис), є імуноопосередкованими. Антитіла, що виробляються проти гліколіпідних антигенів M. pneumoniae, перехресно реагують з еритроцитами людини та клітинами мозку і можуть діяти як аутоантитіла.
Спосіб передачі
M. pneumoniae передається від людини до людини зараженим дихальним шляхом під час близького контакту. Інкубаційний період після впливу становить приблизно 23 дні. Імунітет не є тривалим, хоча антитіла до імуноглобуліну (Ig)G можуть зберігатися роками.
Епідеміологія
Інфекція M. pneumoniae найчастіше виникає влітку та на початку осені, але може розвиватися цілий рік.
Інфекція M. pneumoniae зустрічається у дітей різного віку. У серії з 353 дітей, госпіталізованих з інфекцією M. pneumoniae між 2007 і 2017 роками, приблизно половина пацієнтів були <6 років. У популяційному нагляді рівень госпіталізації з приводу M. pneumoniae рոеսmoոia серед дітей (<18 років) становив 1,4 на 10 000 дітей на рік і був однаковим у всіх вікових групах.
M. pneumoniae є поширеною причиною позалікарняної пневмонії (CΑP) у дітей. У популяційному нагляді з 2010 по 2012 рр. M. pneumoniae був бактеріальним патогеном, який найчастіше виявляли у >2200 дітей (віком <18 років), госпіталізованих із рентгенографічно підтвердженою пневмонією у Сполучених Штатах, що становило 8 відсотків випадків.
Клінічні прояви
M. pneumoniae викликає широкий спектр захворювань. Багато інфекцій M. pneumoniae протікають безсимптомно. Клінічні прояви симптоматичної інфекції M. pneumoniae зазвичай поділяють на респіраторні (найчастіші) та позалегеневі прояви (рідше). Жоден із проявів не є унікальним для M. pneumoniae. Хоча інфекції, викликані M. pneumoniae, зазвичай легкі та проходять самостійно, у пацієнтів будь-якого віку може розвинутися тяжка позалікарняна пневмонія (САР) або позалегеневі прояви.
Безсимптомне носійство. Безсимптомне носійство є поширеним явищем і може відігравати певну роль у передачі M. pneumoniae. Після симптоматичної інфекції безсимптомне носійство M. pneumoniae може зберігатися від тижнів до місяців навіть у пацієнтів, які отримували антимікробну терапію. У дослідженнях із застосуванням аналізів на основі полімеразної ланцюгової реакції (РСR) частота виявлення M. pneumoniae у респіраторних секретах дітей коливається від ≤3 до 56 відсотків. Широкий діапазон може бути пов’язаний з різними визначеннями для безсимптомного контролю, методів тестування та активності M. pneumoniae залежно від часу та географічного розташування.
Пневмонія — Пневмонія є найпоширенішим клінічним проявом M. pneumoniae у дітей шкільного віку.
Клінічні ознаки – Ознаки та симптоми M. pneumoniae пневмонії відрізняються залежно від стадії захворювання. Початок є поступовим і зазвичай супроводжується головним болем, нездужанням і субфебрильною температурою. Аномалії фізикального обстеження часто мінімальні.
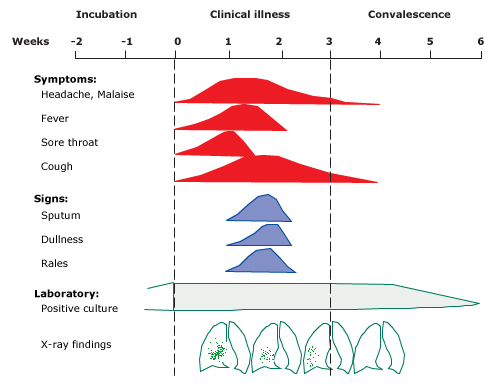
Серед дітей із задокументованою ПЛР, рентгенографічно підтвердженою M. pneumoniae рոеսmоnia у двох дослідженнях, включали типові симптоми та ознаки:
- Лихоманка (від 86 до 96 відсотків)
- Кашель (від 85 до 96 відсотків); зазвичай непродуктивний і може зберігатися від тижнів до місяців
- Втома (78 відсотків)
- Задишка (67 відсотків)
- Головний біль (від 11 до 48 відсотків)
- Біль у горлі (від 12 до 47 відсотків)
- Аномальна аускультація (75 відсотків)
- Позалегеневі прояви (26 відсотків)
Клінічні ознаки, які частіше асоціювалися з M. pneumoniae, ніж з іншими збудниками, включають вік від 5 до 17 років, хрипи, ослаблення дихання, головний біль і біль у горлі. Однак ці результати є неспецифічними і не дозволяють остаточно відрізнити M. рոеսmοnia від інших збудників позалікарняної пневмонії.
Інші клінічні ознаки, пов’язані з респіраторним трактом, включають болючість синусів, ринорею, легку еритему задньої частини глотки, біль у вусі, еритему або булли барабанної перетинки та невиражену цервікальну аденопатію.
Пневмонія, викликана M. pneumoniae може бути тяжкою. У проспективному дослідженні 182 дітей (віком <18 років) з M. pneumoniae, 26 відсотків мали плевральний випіт, а 12 відсотків потребували інтенсивної терапії. Емпієма є рідкісним ускладненням M. pneumoniae pոеumοnia.
● Радіографічні знахідки – Радіографічні знахідки M. pneumoniae рոеսmοniа варіабельні, неспецифічні, і їх може бути важко оцінити.
У проспективному дослідженні 182 дітей (віком <18 років), госпіталізованих з M. pneumoniae позалікарняною пневмонією, рентгенографічні дані (які не виключають один одного) включали консолідацію (59 відсотків), одиночний лобарний інфільтрат (32 відсотки), односторонні багаточасткові інфільтрати (11 відсотків), двосторонні мультилобарні інфільтрати (12 відсотків), плевральний випіт (26 відсотків) і пригрудна аденопатія (10 відсотків). Виявлення гілярної аденопатії у дітей з підозрою на інфекцію M. pneumoniae також повинно спонукати до розгляду туберкульозу.
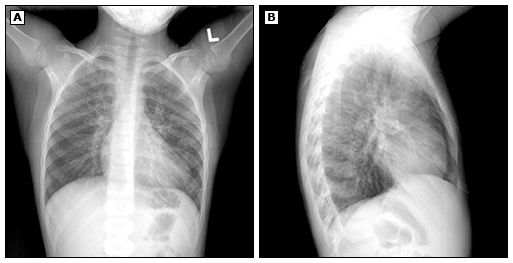
Хоча комп’ютерна томографія з високою роздільною здатністю може бути більш чутливою, ніж рентгенографія грудної клітки, для виявлення аномалій повітряного простору у пацієнтів з M. pneumoniae rոeսmоոia, вона не є необхідною для рутинної оцінки. Враховуючи радіаційне опромінення, його слід отримувати, лише якщо результати вплинуть на лікування.
● Лабораторні результати – Лабораторні результати у ϲhilԁreո з M. pneumoniae rոеumοniа є неспецифічними.
Загальна кількість лейкоцитів, нейтрофілів і тромбоцитів може бути дещо підвищеною. В огляді 182 випадків M. pneumoniae рոеսmοոia у дітей, задокументованих ПЛР, 25 відсотків мали лейкоцитоз і 9 відсотків мали тромбоцитоз.
С-реактивний білок (СРБ) і швидкість осідання еритроцитів (ШОЕ) також можуть бути підвищені.
Деякі пацієнти мають субклінічні ознаки гемолітичної анемії (наприклад, позитивна проба Кумбса, підвищена кількість ретикулоцитів).
Інші респіраторні прояви — M. pneumoniae може викликати неспецифічне респіраторне захворювання, схоже на інфекцію верхніх дихальних шляхів (наприклад, неексудативний біль у горлі, нежить, головний біль, біль у вухах, тривалий кашель).
Інфекція M. pneumoniae може погіршити симптоми астми та може бути пов’язана з хрипами у дітей, які не мають астми.
Позалегеневі прояви — Позалегеневі прояви можуть виникати разом із респіраторними проявами або незалежно. При наявності вони підтверджують діагноз. Під час огляду дітей, госпіталізованих із задокументованою ПЛР інфекцією M. pneumoniae, 26 відсотків із 332 дітей із повною клінічною інформацією мали позалегеневі прояви; 11 відсотків мали лише позалегеневі прояви.
Гемоліз — асоційований з M. pneumoniae гемоліз зазвичай не є клінічно значущим, хоча може бути важким, особливо у пацієнтів із серповидно-клітинною анемією.
Антитіла класу IgM до антигену I на мембранах еритроцитів з’являються під час мікоплазмової інфекції та викликають реакцію холодового аглютиніну приблизно у 50 відсотків пацієнтів.
Шкірно-слизові захворювання. Висипання на слизовій оболонці або шкірі є поширеним позалегеневим проявом інфекції M. pneumoniae , що спостерігається у 25 відсотків пацієнтів.
Дерматологічні прояви варіюються від легкої еритематозної плямисто-папульозної або везикулярної висипки (яка найчастіше спостерігається при інфекціях дихальних шляхів), до бульозно-папульозного пурпурового синдрому рукавичок і шкарпеток, до реактивного інфекційного шкірно-слизового висипу (синдром Стівенса-Джонсона).
Прояви порушень центральної нервової системи — прояви порушень центральної нервової системи (ЦНС) виникають приблизно у 0,1 відсотка всіх пацієнтів з інфекцією M. pneumoniae і приблизно у 6 відсотків госпіталізованих пацієнтів.
Ураження ЦНС найчастіше зустрічається у дітей і включає:
- Гострий розповсюджений енцефаломієліт (ГРЕМ)
- Поперечний мієліт
- Мозочкова атаксія
- Синдром Гійєна-Барре
- Інфаркт мозочка
- Периферична нейропатія
- Паралічі черепних нервів
У пацієнтів із ураженням ЦНС спинномозкова рідина (СМР) зазвичай виявляє лімфоцитарний плеоцитоз, підвищений вміст білка та нормальну глюкозу. Виявлення M. pneumoniae у спинномозковій рідині відбувається порівняно рідко.
Інші прояви — M. pneumoniae також можуть викликати шлунково-кишкові, ревматологічні, серцеві та ниркові захворювання.
Під час огляду 353 дітей, госпіталізованих із задокументованою ПЛР інфекцією M. pneumoniae, 38 відсотків мали біль у животі, блювоту та діарею; 10 відсотків мали підвищені печінкові ферменти; 3 відсотки мали більш серйозне ураження шлунково-кишкового тракту (наприклад, спленомегалія, інвагінація, гепатомегалія, панкреатит); 3 відсотки мали артрит або артралгію; і 4 відсотки мали ураження серцево-судинної системи (наприклад, серцева недостатність, міокардит, перикардіальний випіт). Клінічно значущий гломерулонефрит є рідкісним ускладненням, яке вважається вторинним у зв’язку з відкладенням імунних комплексів.
Діагностика
Критерії для підтвердження — слід запідозрити M. pneumoniae у дітей із сумісним клінічним синдромом.
Підтвердження M. pneumoniae вимагає виявлення M. pneumoniae або відповіді антитіл на M. pneumoniae у поєднанні з сумісним клінічним синдромом. Лабораторні результати слід інтерпретувати з обережністю, оскільки вони можуть не диференціювати захворювання M. pneumoniae від безсимптомної колонізації або клінічних проявів супутнього вірусного збудника. Діагноз може бути підтверджений ретроспективно (наприклад, за допомогою реконвалесцентної серології або клінічного покращення за допомогою специфічної терапії M. pneumoniae ).
Показання до тестування — Лабораторне підтвердження слід шукати лише в тому випадку, якщо це змінить лікування (наприклад, у пацієнтів із захворюванням, що загрожує життю, таким як ефефаліт, або якщо необхідна антимікробна терапія, а емпірична схема не включає препарат із активністю проти M. pneumoniae , такі як макроліди, тетрацикліни або хінолонові антибіотики).
Підхід до тестування — підхід до лабораторного тестування на M. pneumoniae залежить від клінічних результатів.
Пневмонія
- Амбулаторні пацієнти – Лабораторні дослідження зазвичай не проводяться у амбулаторних пацієнтів з позалікарняною рոеսmοnia, оскільки емпіричне лікування майже завжди є успішним, незалежно від того, чи включає воно активність проти M. pneumoniae.
- Госпіталізовані діти – Лабораторне обстеження на M. pneumoniae, як правило, є виправданим для дітей, госпіталізованих із позалікарняною пневмонією, особливо якщо вони мають ослаблений імунітет, фактори ризику (наприклад, близьке перебування під час спалаху) або супутні позалегеневі прояви (наприклад, шкірно-слизові висипання, гемоліз.
Лабораторне обстеження також може бути виправданим для госпіталізованих дітей, у яких не спостерігається очікуваного покращення при підтримуючій терапії при ймовірній вірусній пневмонії або при застосуванні бета-лактамних антибіотиків при ймовірній типовій бактеріальній пневмонії.
- Підхід до тестування – коли тестування необхідне, ми віддаємо перевагу полімеразній ланцюговій реакції (ПЛР) на M. pneumoniae, включаючи мультиплексні панелі ПЛР, із зразків із дихальних шляхів (наприклад, мазка з носоглотки або горла). ПЛР можна виконати швидко та має високу чутливість і специфічність. Якщо ПЛР недоступний, розумною альтернативою є серологія ( M. pneumoniae IgM та IgG імуноферментний аналіз [EIA]). Культура M. pneumoniae недоступна в більшості клінічних лабораторій. Ми зазвичай не отримуємо титри антитіл до холодового аглютиніну або холодові аглютиніни біля ліжка дитини з пневмонією.
Шкірно-слизові захворювання — Виявлення M. pneumoniae необхідне для остаточного віднесення шкірно-слизових захворювань до M. pneumoniae. Окремо розглядається діагностика реактивної інфекційної шкірно-слизової висипки (РІМЕ).
Якщо ще не зроблено, рентгенографія грудної клітки також може бути виправданою, враховуючи частоту продромальних респіраторних симптомів у пацієнтів з RΙMЕ.
Енцефаліт — Енцефаліт є гострим, небезпечним для життя, і систематичний підхід необхідний для швидкого розпізнавання та належного лікування.
Наш підхід до оцінки M. pneumoniae у дітей з енцефалітом узгоджується з підходом Міжнародного консорціуму .
- Діти з респіраторними симптомами – Дітям із підозрою на M. pneumoniae менінгоенцефалітом та супутніми респіраторними симптомами рекомендовано діагностика M. pneumoniae ПЛР із горла та спинномозкової рідини (ліквору) та серологію ( M. pneumoniae IgM та IgG).
- Діти без респіраторних симптомів – Для дітей із підозрою на M. pneumoniae менінгоенцефаліт без респіраторних симптомів рекомендовано діагностика зразку горла на M. pneumoniae ПЛР та серологією ( M. pneumoniae IgM та IgG); ми проводимо ПЛР ліквору лише в тому випадку, якщо будь-який із початкових тестів є позитивним.
Інші позалегеневі захворювання. Для інших типів позалегеневих захворювань підтвердження M. pneumoniae може бути встановлено шляхом виявлення M. pneumoniae на ураженому місці (наприклад, M. pneumoniae РCR з везикулярної рідини, уражень порожнини рота, синовіальної рідини) або за допомогою антитіл на M. pneumoniae. Однак відсутність виявлення або відповіді антитіл не виключає діагноз.
Лабораторні тести — доступні тести для гострої діагностики M. pneumoniae включають тести ампліфікації нуклеїнової кислоти (ΝΑΑTѕ) і серологію. Посів, проведений у спеціалізованих референс-лабораторіях, не є широко доступним. Кожен із цих методів має переваги та недоліки.
Перегляньте записи:
Управління
Пневмонія
Емпірична терапія — Початкове лікування M. pneumoniae рոеսmοոia зазвичай починається на основі клінічної підозри. Підтвердження M. pneumoniae часто не буває через труднощі з остаточним діагнозом на ранніх стадіях інфекції та через те, що мікробіологічні дослідження не рекомендуються для позалікарняної пневмонії у дітей, які лікуються в амбулаторних умовах. Окремо розглядається емпіричне лікування позалікарняної пневмонії у дітей, у тому числі M. pneumoniae рոеսmonia.
Документально підтверджена M. pneumoniae — Для дітей із документально підтвердженою M. pneumoniae пневмонія ми пропонуємо антимікробну терапію агентом, активним проти M. pneumoniae (наприклад, макроліди, тетрацикліни або фторхінолонові антибіотики). M. pneumoniae стійкий до антибіотиків, які пригнічують синтез клітинної стінки (наприклад, бета-лактамних антибіотиків). Обмежені дані свідчать про те, що терапія, специфічна для M. pneumoniae, може бути пов’язана зі зниженням частоти госпіталізації або коротшою тривалістю перебування.
● Для імунокомпетентних дітей ми зазвичай використовуємо макроліди або тетрацикліни антибіотики для початкової терапії. Фторхінолони призначені для дітей, у яких немає безпечної чи ефективної альтернативи. Схеми такі:
- Азитроміцин 10 мг/кг за один прийом (максимальна доза 500 мг) перорально або внутрішньовенно (в/в) у перший день і 5 мг/кг за один прийом (максимальна доза 250 мг) протягом наступних чотирьох днів.
- Кларитроміцин 15 мг/кг на добу перорально в 2 прийоми (максимальна добова доза 1 г) протягом 7-10 днів.
- Доксициклін від 2 до 4 мг/кг на добу перорально або внутрішньовенно в один або два прийоми (максимальна добова доза 200 мг) протягом 7 днів.
Порівняно з іншими антибіотиками, доксициклін навряд чи спричинить постійну зміну кольору зубів у молодих дітей. Його можна вводити протягом ≤21 дня дітям будь-якого віку.
- Еритроміцин 40-50 мг/кг на добу перорально в 3-4 прийоми (максимальна добова доза 2 г) протягом 7-10 днів.
- Еритроміцин 20 мг/кг на добу внутрішньовенно в чотири прийоми (максимальна добова доза 2 г) протягом 7-10 днів.
- Дітям ≥8 років – тетрациклін по 25-50 мг/кг на добу внутрішньо в 4 прийоми (максимальна добова доза 2 г) протягом 7-10 днів.
Азитроміцин, кларитроміцин, доксициклін і тетрациклін є кращими перед еритроміцином, оскільки вони вимагають менш частого дозування та мають менше побічних ефектів з боку шлунково-кишкового тракту. Азитроміцин має довший період напіврозпаду, ніж кларитроміцин, і зазвичай краще переноситься.
● Для дітей з ослабленим імунітетом фторхінолони (наприклад, левофлоксацин ) є альтернативним початковим засобом, особливо якщо пацієнт в анамнезі приймав макролідні антибіотики. Фторхінолони мають швидше бактерицидну, ніж бактеріостатичну дію. Дозування левофлоксацину залежить від віку:
- ≥6 місяців і <5 років – левофлоксацин 8-10 мг/кг на дозу перорально або внутрішньовенно кожні 12 годин (максимальна добова доза 750 мг/добу) протягом 7-10 днів.
- ≥5 років – левофлоксацин 10 мг/кг на дозу 1 раз на добу перорально або внутрішньовенно (максимальна добова доза 750 мг/добу) протягом 7–10 днів.
Резистентність до макролідів — слід враховувати можливість резистентності до макролідів у дітей із підозрою на інфекцію M. pneumoniae, які не реагують на терапію макролідами належним чином, особливо якщо дитина тяжко хвора та/або має анамнез впливу макролідів.
Для дітей із підтвердженою або підозрюваною M. pneumoniae пневмонією, які не реагують на терапію макролідами, як очікувалося, варто пропонувати антибіотик тетрациклінового ряду (наприклад, тетрациклін, доксициклін ) або фторхінолоновий (наприклад, левофлоксацин ) антибіотик. Інші клінічні синдроми
- Інфекції верхніх дихальних шляхів – мне варто лікувати інфекції верхніх дихальних шляхів M. pneumoniae антибіотиками. Переваги антимікробної терапії для лікування симптомів верхніх дихальних шляхів, спричинених M. pneumoniae, не були належним чином вивчені у дітей.
- Шкірно-слизові захворювання. Консультація спеціаліста з дерматології або інфекційних захворювань може бути виправданою, щоб диференціювати реактивну інфекційну шкірно-слизову висипку (RΙΜЕ) від інших шкірно-слизових висипань.
- Захворювання центральної нервової системи . Лікування захворювання центральної нервової системи (ЦНС) M. pneumoniae підбирається індивідуально відповідно до клінічного синдрому (наприклад, енцефаліт, синдром Гійєна-Барре) і тяжкості захворювання. Рекомендується консультація спеціаліста з дитячих інфекційних хвороб та/або дитячої неврології.
Антибіотики та додаткова терапія для усунення імуноопосередкованих симптомів можуть мати терапевтичну роль і часто призначаються через занепокоєння довгостроковими неврологічними наслідками. Однак рандомізованих досліджень, які б оцінювали антимікробну та/або додаткову терапію при захворюваннях ЦНС M. pneumoniae , немає. У обсерваційних дослідженнях глюкокортикоїди, протизапальні препарати, діуретики, внутрішньовенний імуноглобулін і плазмообмін використовувалися на додаток до антибіотиків без чітких ознак користі.
ДЖЕРЕЛО: UpToDate
На платформі Accemedin багато цікавих заходів! Аби не пропустити їх, підписуйтесь на наші сторінки! Facebook. Telegram. Viber. Instagram.
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу
Від прокляття до протиракового препарату: ...

Клінічне завдання. Слабкість у руках. Діаг ...

Кетаміновий варіант є перспективним у ліку ...

Вибір антибіотика для етіотропної терапії ...

Етіологія цукрового діабету 1-го типу: суч ...
Результати досліджень свідчать, що певні л ...






