Вплив використання інгібіторів протонної помпи на клінічні результати у пацієнтів зі Східної Азії, які отримували клопідогрель після імплантації стента з лікарським покриттям
Дата публікації: 20.08.2024
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: інгібітори протонної помпи, антитромбоцитарна терапія, аспірин, клопідогрель, імплантація стента, Клопідогрель
Вступ
Пацієнти, які отримують подвійну антитромбоцитарну терапію (DAPT) після черезшкірного коронарного втручання (PCI) з імплантацією стента з лікарським покриттям (DES), мають ризик ускладнень як ішемії, так і кровотечі. Інгібітори протонної помпи (ІПП) зазвичай призначають таким пацієнтам для лікування або профілактики шлунково-кишкової (ШКТ) кровотечі. Клопідогрель є проліками, які потребують біоактивації ферментом печінки CYP2C19 (цитохром P450, родина 2, підродина C, поліпептид 19), тоді як ІПП метаболізуються тим самим ферментом у неактивні метаболіти. Це конкурентне пригнічення викликало занепокоєння щодо клінічно значущих взаємодій між лікарськими засобами, які можуть знизити ефективність клопідогрелю. Крім того, наявність алелей CYP2C19 втрати функції (LoF) підвищує ймовірність взаємодії ІПП-клопідогрелю.
Деякі рандомізовані клінічні випробування (РКД) та обсерваційні дослідження показали суперечливі результати щодо впливу одночасного застосування ІПП на ефективність клопідогрелю, причому деякі дослідження вказують на ослаблене інгібування рецептора P2Y12 і підвищення несприятливих клінічних результатів. Однак попередні дослідження були переважно зосереджені на метаболічних взаємодіях, оцінених за допомогою тесту на функцію тромбоцитів у обмеженій популяції пацієнтів. Найбільше РКД (користувачі ІПП; n = 1876) не виявило суттєвої серцево-судинної взаємодії між клопідогрелем і омепразолом, але переважно біле населення дослідження (94%) свідчить про недооцінку гомозиготності для алеля CYP2C19 LoF. Жодне дослідження не досліджувало взаємодію ліків-генів щодо реактивності тромбоцитів і клінічних результатів у пацієнтів, які отримували DAPT на основі клопідогрелю після імплантації DES.
Популяція Східної Азії має вищу поширеність алеля CYP2C19 LoF, ніж популяція Заходу, але вони значно недостатньо представлені в знакових РКД. Пацієнти зі Східної Азії демонструють чіткий клінічний профіль, що характеризується меншою кількістю тромбоемболічних подій і підвищеним ризиком кровотечі під час антитромботичної терапії. Через цей східноазіатський парадокс клопідогрель залишається найбільш часто призначеним інгібітором тромбоцитів у клінічній практиці через його нижчий профіль кровотечі. Щоб усунути ці прогалини, широкомасштабне обсерваційне багатоцентрове дослідження функції тромбоцитів і довгострокового прогнозу, пов’язаного з генотипом, у пацієнтів, які отримували DES (PTRG-DES), у Південній Кореї включало регулярне тестування на реактивність тромбоцитів (до та після навантаження клопідогрелю) та Генотипування CYP2C19 . У дослідженні PTRG-DES ми намагалися оцінити безпеку одночасного застосування ІПП і DAPT на основі клопідогрелю щодо наслідків ішемії та кровотечі за допомогою аналізу відповідності показників схильності (PS).
Методи
PTRG-DES — це загальнонаціональний реєстр, який підтримується Корейським товариством інтервенційної кардіології (NCT04734028). Детальний дизайн дослідження та повні критерії включення та виключення були описані раніше. У період з січня 2003 року по грудень 2018 року 33 академічні центри Південної Кореї зарахували 13 160 послідовних пацієнтів, які перенесли ЧКВ з імплантацією DES і отримували лікування DAPT на основі клопідогрелю. Пацієнти, які отримували інгібітори P2Y12, крім клопідогрелю, і ті, хто потребував пероральних антикоагулянтів, були виключені з дослідження. Інституційна наглядова рада кожного центру-учасника затвердила реєстр PTRG-DES (корейська університетська лікарня Анам; 2018AN0283) і скасувала вимогу письмової інформованої згоди для доступу до інституційного реєстру.
Вивчення вимірювань і процедур
Переконавшись, що антитромбоцитарні ефекти триватимуть достатньо довго, було проведено аналіз VerifyNow (Accriva, Сан-Дієго, Каліфорнія, США) для вимірювання одиниці реакції P2Y12 (PRU) протягом перипроцедурного часу. Аспірин застосовували або в дозі 300 мг, покритій оболонкою, принаймні за 2 години до ЧКВ, або в дозі 100 мг принаймні за 5 днів до ЧКВ. Клопідогрель призначали в дозах 600 мг щонайменше за 6 годин до ЧКВ, 300 мг щонайменше за 12 годин до ЧКВ або 75 мг щонайменше за 5 днів до ЧКВ. Жоден пацієнт, який отримував абциксимаб, не був зареєстрований через тривалий період виведення. Якщо під час ЧКВ використовувався ептифібатид або тирофібан, перед тестуванням VerifyNow потрібен був 24-годинний період відмивання. Висока реактивність тромбоцитів (HPR) була визначена як PRU під час лікування > 208.
Піросеквенування кожного окремого нуклеотидного поліморфізму було виконано для генотипування за допомогою комерційно доступних аналізаторів, таких як PSQ 96MA Pyrosequencer (Pyrosequencing AB, Упсала, Швеція), генетичний аналізатор ABI PRISM® 3100 (Applied Biosystems, Foster City, CA, США) або Система Spartan RXTM (Spartan Bioscience, Оттава, Канада). Основні корейські алелі включають CYP2C19 *2 (rs4244285), CYP2C19 *3 (rs4986893) і CYP2C19 *17 (rs12248560). Екстенсивні метаболізатори включають CYP2C19 *1/*1 і CYP2C19 *1/*17. Проміжні метаболізатори включають CYP2C19 *1/*2, CYP2C19 *1/*3, CYP2C19 *2/*17 і CYP2C19 *3/*17. Погані метаболізатори включають CYP2C19 *2/*2, CYP2C19 *2/*3 і CYP2C19 *3/*3. Лікарі та пацієнти не були проінформовані про результати PRU та генотипування CYP2C19.
Усі процедури ЧКВ проводились відповідно до чинних рекомендацій. Під час ЧКВ застосовували парентеральну антикоагуляцію для підтримки активного часу згортання 250–300 с. Оператор вибирав метод лікування, тип стента, діаметр, довжину та використання препарату. Рекомендації щодо індексного ЧКВ рекомендують DAPT з підтримуючими дозами аспірину та клопідогрелю протягом щонайменше 1 року. Тривалість DAPT визначалася на розсуд лікуючого лікаря.
Інгібітори протонної помпи та результати дослідження
ІПП призначалися на розсуд лікуючого лікаря та були задокументовані як клас препарату у формі звіту про випадок під час ЧКВ. Проте про конкретні ІПП та дозування детально не повідомляється. Анемія визначалася як рівень гемоглобіну < 13 г/дл у чоловіків і < 12 г/дл у жінок. Хронічна хвороба нирок (ХНН) визначалася як розрахункова швидкість клубочкової фільтрації < 60 мл/хв/1,73 м 2.
Первинним результатом була частота великих побічних серцевих і цереброваскулярних подій (MACCE), включаючи смерть з усіх причин, інфаркт міокарда (ІМ), тромбоз стента або порушення мозкового кровообігу через 12 місяців після індексного ЧКВ. Смертність від усіх причин, сильна кровотеча (Кровотеча Academic Research Consortium [BARC] типи 3–5) і шлунково-кишкова кровотеча (BARC типи 3–5) були важливими вторинними результатами. ІМ визначався як підвищення рівня зв’язування креатинкінази та міоглобіну вище верхньої межі норми або рівень T/I тропоніну > 99-го процентиля верхньої межі норми, що супроводжувалося ішемічними симптомами, електрокардіографічними відхиленнями або аномальними результатами візуалізації, що вказують на ішемію. Будь-який новий емболічний, тромботичний або геморагічний інсульт з неврологічними порушеннями, що тривають щонайменше 24 години, вважався порушенням мозкового кровообігу. Якщо незаперечна причина не була виявлена, всі смерті класифікувалися як серцево-судинні смерті. Для отримання демографічних, ангіографічних та процедурних даних були використані опитування пацієнтів та медичні записи. Усі подальші візити проводились у формі офісних візитів або телефонних дзвінків, якщо це було необхідно. Незалежний комітет, не знаючи генетики та даних PRU, вивчив і оцінив усі клінічні події з кожного сайту-учасника.
Статистичний аналіз
Категориальні змінні представлені у вигляді кількості та відсотків, тоді як безперервні змінні представлені як середні значення та стандартні відхилення. Групові порівняння проводили за допомогою параметричного непарного t-критерію або непараметричного U-тесту Манна-Уїтні для безперервних змінних і χ 2 або точного критерію Фішера для категоріальних змінних. Щоб зменшити ефект зміщення відбору, ми провели аналіз відповідності PS, щоб порівняти несприятливі клінічні події між користувачами ІПП і некористувачами. Використовуючи багатофакторну логістичну регресію, ми оцінили ймовірність отримання ІПП під час індексної госпіталізації. Змінні були представлені як гострий ІМ, вік, стать, ожиріння, дисліпідемія, паління, ХХН, анемія, застійна серцева недостатність, захворювання периферичних артерій, попередній ІМ, попереднє аортокоронарне шунтування, попереднє ЧКВ, рівень гемоглобіну, кількість тромбоцитів, клубочкова фільтрація частота, вихідний PRU, багатосудинна хвороба, біфуркаційне ураження, хронічна тотальна оклюзія, ЧКВ лівої головної або лівої передньої низхідної артерії, припинення DAPT протягом 1 року та використання інгібіторів ренін-ангіотензинової системи, статинів, блокаторів кальцієвих каналів та аспірин. Ми зіставили кожного пацієнта, який користувався ІЦН, із тими, хто не користувався, у співвідношенні 1:1, використовуючи оптимальний метод, із шириною каліпера, що дорівнювала 0,2 стандартного відхилення logit PS. Було досліджено баланс базових ознак, і стандартизована середня різниця < 0,1 вказувала на незначну різницю.
Протягом періоду спостереження пацієнти піддавалися цензурі щодо часу події або дати останнього спостереження. Лише перша подія була врахована у пацієнтів з кількома подіями, повідомленими про той самий результат. Кумулятивні показники захворюваності розраховувалися на основі оцінок Каплана-Мейєра, а міжгрупові порівняння оцінювали за допомогою логарифмічного рангового тесту. Для аналізу впливу різних коваріатів на результати від часу до події шляхом розрахунку коефіцієнтів ризиків (HR) і 95% довірчих інтервалів була використана модель пропорційної регресії ризику Кокса з різними параметрами. Підрозподіл ЧСС для первинного результату оцінювали за допомогою конкуруючої моделі ризику Fine-Gray, а припинення DAPT було змодельовано як єдину конкуруючу подію. Аналіз підгруп проводили відповідно до наявності гіпертензії, цукрового діабету, генотипу CYP2C19 і HPR. Статистичний аналіз проводили за допомогою R версії 4.1.2 (R Foundation for Statistical Computing, Відень, Австрія) зі значенням p < 0,05, яке вважалося статистично значущим.
Результати
Досліджувана популяція. З 13 160 пацієнтів 2 235 (17,0%) отримували ІПП із середнім віком 65,4 року, і 64,0% були чоловіками (додатковий файл 1: таблиця S1). Користувачі ІПП були старшими, частіше страждали від гострого ІМ і мали вищий рівень дисліпідемії, ХХН, анемії та багатосудинних захворювань. Аналіз відповідності PS включав 6673 пацієнтів, у яких були як базові вимірювання PRU, так і генотипування CYP2C19 (користувачі PPI, n = 1133; додатковий файл 1: рис. S1). Після відповідності 1:1 PS 2266 пацієнтів було включено до остаточного аналізу. Демографічні та клінічні параметри на початку дослідження були добре збалансованими, зі стандартизованою середньою різницею < 0,1. Користувачі ІПП продемонстрували вищі рівні PRU під час лікування (після завантаження клопідогрелю), ніж ті, хто не використовував як у невідповідній когорті, так і в когорті з ПС. Користувачі PPI мали більший середній діаметр стента та демонстрували процедурні характеристики, подібні до тих, хто не використовував когорту PS-сумісності.

Вплив ІПП на ішемічні події та кровотечі
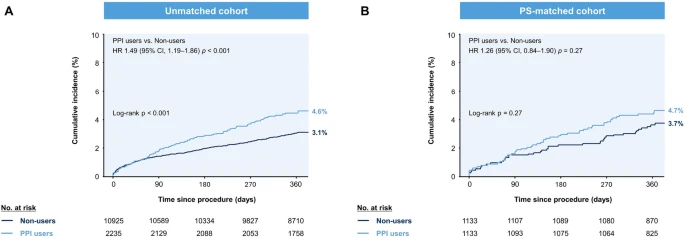
Наведені нижче таблиці підсумовують первинні та вторинні результати через 12 місяців відповідно до використання ІПП. До відповідності PS складний MACCE спостерігався у 99 користувачів PPI (сукупна частота 4,6%) і 326 некористувачів (сукупна частота 3,1%; log-rank p < 0,001). Після підбору PS захворюваність MACCE через 12 місяців була порівнянною між користувачами ІПП і некористувачами (сукупна частота 4,7% проти 3,7%; log-rank p = 0,27;). Інші вторинні ішемічні наслідки, включаючи ІМ, тромбоз стента та цереброваскулярні інциденти, були подібними між двома групами в PS-сумісній когорті. Користувачі ІПП показали кількісно більшу частоту спонтанного ІМ, ніж ті, хто не використовував (1,6% проти 0,9%, р = 0,17). Модель Fine-Gray додатково підтвердила ці висновки, коли припинення DAPT було змодельовано як єдину конкуруючу подію.

Загалом за 12 місяців у 13 160 пацієнтів виникло 257 великих кровотеч, з яких 208 (80,9%) потребували переливання крові. Причини великої кровотечі (BARC типи 3–5) включали ШКТ (42,0%, n = 108), центральну нервову систему (8,6%), місце доступу через ЧКВ (6,6%), пов’язане з хірургічним втручанням (5,4%), носову кровотечу (3,5%), сечостатевих (3,1%), легеневих (1,9%), периферичних (1,6%), травматичних (0,8%), судинних (0,8%), перикардіальних (0,8%), заочеревинних (0,4%), інших (6,2%), і невідомі (18,3%). До підбору PS шлунково-кишкова кровотеча виникла у 28 користувачів ІПП (сукупна частота 1,3%) і 90 тих, хто не використовував (сукупна частота 0,9%; log-rank p = 0,05). З них 10 пацієнтів зі шлунково-кишковою кровотечею не відповідали критеріям великої кровотечі. На відміну від цього, частота серйозних кровотеч і шлунково-кишкових кровотеч (BARC типи 3–5) була порівнянною між користувачами ІПП і некористувачами в когорті, відповідній PS. Загалом було задокументовано 81 випадок великої кровотечі після підбору PS та класифіковано за типами BARC наступним чином: тип 3a, 70,4%; тип 3b, 18,5%; тип 3c, 4,9%; тип 4, 3,7%; типи 5а і 5б 1,2%. Шлунково-кишкова кровотеча (BARC типи 3–5) виникла у 17 користувачів ІПП (сукупна частота 1,6%) і 12 тих, хто не користувався (сукупна частота 1,1%; log-rank p = 0,34). Був лише один випадок невеликої шлунково-кишкової кровотечі в когорті, що відповідає PS.
Аналіз підгруп у PS-підібраній когорті
В аналізі підгруп, заснованому на генотипуванні CYP2C19, використання ІПП було пов’язане з підвищеним ризиком MACCE (HR, 3,22; p = 0,02) у повільних метаболізаторів (n = 313). Взаємодія між використанням ІПП та визначенням генотипу CYP2C19 не була статистично значущою для MACCE (p для взаємодії = 0,28). Не спостерігалося жодних істотних відмінностей у MACCE між користувачами ІПП і некористувачами в підгрупах відповідно до гіпертензії, цукрового діабету та гіпертензії. Також не було суттєвих відмінностей у сильних кровотечах між користувачами ІПП і некористувачами в різних підгрупах.
PRU під час лікування та клінічні результати в когорті, що відповідає PS
У когорті, що відповідає PS, PRU був тісно пов’язаний із нескоригованим ризиком MACCE, а HPR асоціювався з вищим ризиком MACCE через 12 місяців. PRU ≥ 252 під час лікування також було пов’язано з вищим ризиком MACCE через 12 місяців. Раніше повідомлялося про зв’язок між PRU під час лікування та клінічними результатами в загальній когорті.
Прогнози 12-місячного MACCE у когорті, що відповідає PS
Незалежними предикторами первинного результату були HPR і статус поганого метаболізму в когорті, що відповідає PS. Поганий метаболізатор був найсильнішим предиктором первинного результату (скоригований HR 1,80, p = 0,05). Навпаки, проміжний метаболізатор не становив значного ризику. HPR був значущим предиктором як в однофакторному, так і в багатофакторному аналізах (скоригований HR 1,73, p = 0,03). Застосування ІПП не було незалежно пов’язане з первинним результатом (скоригований HR 1,24, p = 0,31).
Обговорення
У цьому дослідженні вивчався зв’язок між використанням ІПП, PRU, генотипом CYP2C19 і несприятливими клінічними наслідками у великій реальній популяції пацієнтів, які перенесли ЧКВ з імплантацією DES і отримували DAPT на основі клопідогрелю. Основні висновки нашого дослідження полягали в наступному: використання ІПП під час ЧКВ було пов’язане з вищими значеннями PRU під час лікування клопідогрелем, які були постійними в усіх підгрупах генотипу CYP2C19 ; частота випадків MACCE та сильних кровотеч через 12 місяців була порівнянною між користувачами ІПП та некористувачами після підбору ПС; і одночасне застосування ІПП і клопідогрелю було пов’язане з підвищеним ризиком складного MACCE у повільних метаболізаторів.
Кровотечі після виписки пов’язані зі збільшенням подальшої смертності від усіх причин у пацієнтів із гострим коронарним синдромом. Шлунково-кишкова кровотеча суттєво впливає на клінічні результати у пацієнтів, які отримували тривале лікування DAPT або потужними інгібіторами P2Y12 після ЧКВ. ІПП часто призначають разом і рекомендують поточні рекомендації для зниження ризику шлунково-кишкової кровотечі у пацієнтів, які отримують DAPT або інші інгібітори P2Y12. Кілька обсерваційних досліджень показали, що одночасне застосування ІПП може зменшити антиагрегантну дію клопідогрелю. Проте залишається незрозумілим, чи метаболічна взаємодія між ІПП і клопідогрелем призводить до підвищеного ризику несприятливих ішемічних наслідків, і чи може використання ІПП бути сурогатним маркером поганих клінічних результатів. Омепразол є єдиним ІПП, дослідженим у РКД, який не продемонстрував явної взаємодії між клопідогрелем і омепразолом щодо важких серцево-судинних кінцевих точок. Проте, найбільше РКД було передчасно припинено після середньої тривалості 106 днів і максимум 341 днів, і очікувана поширеність поганих метаболізаторів у цій когорті була оцінена як менш як 3%. Щоб переконатися, що ІПП суттєво знижують рівень активного метаболіту клопідогрелю до такої міри, що погіршує його ефективність, необхідним є всебічне дослідження, що включає генотипування як PRU, так і CYP2C19.
ІПП, як клас препаратів, незалежно асоціювався з PRU> 208 у пацієнтів, які отримували клопідогрель після успішної імплантації DES (користувачі ІПП; n = 2697). Наше дослідження однозначно описує рівні PRU до та після навантаження клопідогрелем у пацієнтів, які отримували ІПП, і надає результати відповідно до підгруп генотипу CYP2C19. Початкові значення PRU були порівнянними як у когортах непідібраних, так і в когортах з PS, а PRU під час лікування був значно вищим серед користувачів ІПП, ніж серед тих, хто не використовував (232,0 ± 82,9 проти 224,4 ± 81,7 у когорті з PS). Проте випадки ішемії та кровотечі були подібними між двома групами після відповідності PS. Цілком імовірно, що середня різниця в PRU під час лікування була надто малою, щоб бути клінічно значущою, або що взаємодія між ІПП і клопідогрелем була надто слабкою, щоб перевести її в клінічні жорсткі кінцеві точки. Іншим міркуванням є те, що ішемічні події, здається, групуються у вищому тертилі або квартилі PRU під час лікування над певною граничною точкою. Хоча зв’язок між PRU під час лікування та MACCE був значною мірою лінійним у когорті PS-сумісності, існував такий пороговий ефект, що PRU під час лікування має бути понад 252, перш ніж ризик пацієнта підвищиться в когорті PTRG-DES. Частка пацієнтів із PRU ≥ 252 під час лікування була порівнянною між користувачами ІПП і некористувачами (41,9% проти 38,4%, p = 0,10) у когорті, що відповідає PS.
Попри те, що європейські рекомендації рекомендують рутинне використання ІПП у всіх пацієнтів, які отримують DAPT, тестування функції тромбоцитів або генетичне тестування не рекомендовані та можуть розглядатися лише в окремих ситуаціях (наприклад, рецидивний тромбоз стента). Взаємодія ІПП-клопідогрелю може бути клінічно значущою лише у пацієнтів з алелями LoF CYP2C19. Сьогодні у дослідженнях, що оцінюють адитивні ефекти взаємодії між ліками та між ліками та генами, використовувалися обмежені розміри вибірки для виявлення клінічно значущих відмінностей. Недавній метааналіз виявив, що у пацієнтів із будь-яким алелем CYP2C19 LoF приймання клопідогрелю з ІПП був пов’язаний із підвищеним ризиком несприятливих результатів порівняно з приймання клопідогрелю без ІПП (p <0,0001). Наше дослідження показало, що використання ІПП особами зі слабким метаболізмом було пов’язане з підвищеним ризиком MACCE через 12 місяців. Тим часом пацієнти, які отримували клопідогрель з єдиним алелем LoF (проміжні метаболізатори), можуть безпечно приймати ІПП без явного підвищення серцево-судинних ризиків, як показано в наших даних. Очікується, що у пацієнтів зі слабким метаболізмом активність ферменту CYP2C19 на початковому етапі буде незначною або взагалі відсутня, і використання ІПП може призвести до подальшого повного інгібування ферменту CYP2C19 до ступеня, яка буде клінічно значущою. Це особливо важливо, якщо пацієнти з високим ризиком кровотечі розглядаються для стратегії деескалації за допомогою монотерапії клопідогрелем, оскільки це може ненавмисно збільшити ризик тромботичних подій після раннього припинення DAPT. Тому слід з обережністю призначати ІПП та клопідогрель без визначення генотипу CYP2C19, особливо коли планується монотерапія клопідогрелем.
Обмеження
Наше дослідження мало обмеження. По-перше, попри добре збалансовані результати зіставлення PS, не можна було виключити зміщення відбору та невиміряні змішуючі фактори. До підбору PS лише 17% пацієнтів отримували лікування ІПП, а ознаки високого ризику кровотечі, такі як ХХН, частіше спостерігалися у користувачів ІПП. Попри проведення ретельного аналізу відповідності PS, який включав 26 змінних для адекватного усунення будь-якого потенційного зміщення, була кількісно вища частота серйозних шлунково-кишкових кровотеч у користувачів ІПП (1,6%), ніж у тих, хто не використовував (1,1%) у когорті відповідності PS. Враховуючи добре встановлені переваги ІПП для захисту ШКТ, ті, хто вже був сприйнятливий до ускладнень кровотечі, частіше отримували ІПП у нашій когорті. Це пояснюється тим, що в корейській системі відшкодування призначення ІПП під час DAPT обмежено пацієнтами, які мають інші вагомі медичні обґрунтування, наприклад гастроезофагеальну рефлюксну хворобу. Загальні висновки слід інтерпретувати з обережністю без рандомізації використання ІПП. Однак рішення про використання ІПП у попередніх дослідженнях також ґрунтувалося на клінічному судженні лікаря, а не на випадковому розподілі. По-друге, окремі ІПП не були визначені, а показання до ІПП, такі як дозування, тривалість, перерва та припинення ІПП, не були оцінені, попри тривале спостереження. Більшість попередніх досліджень щодо цієї взаємодії між лікарськими засобами не вказували на індивідуальні ІПП, а дослідження, які вказували на ІПП, включали обмежену кількість пацієнтів для оцінки віддалених несприятливих результатів. У спостережному аналізі проспективних досліджень використання ІПП також оцінювалося як клас препаратів. Крім того, вплив препарату є важливою залежною від часу коваріантою, яка може впливати на опосередковане клопідогрелем інгібування тромбоцитів. У нашому дослідженні терапевтичне перехресне приймання як у користувачів ІПП, так і у тих, хто його не використовує, міг схилити результати до нульової гіпотези. По-третє, реєстр PTRG-DES охоплює значний період включення з 2003 по 2018 рік, який охоплює значні зміни в клінічній практиці, включаючи еволюцію медикаментозної терапії, технології DES і техніки ЧКВ. Нарешті, наш аналіз був обмежений корейським населенням, обмежуючи його релевантність іншими етнічними групами з різноманітною поширеністю генотипу CYP2C19. У PS-сумісній когорті 61,8% мали будь-який алель CYP2C19 LoF (проміжні метаболізатори, 48,0%; погані метаболізатори, 13,8%), що відповідає вищій частоті у пацієнтів зі Східної Азії. У нещодавньому проспективному дослідженні 23% пацієнтів були вихідцями зі Східної Азії, і серед них 59,7% мали алелі CYP2C19 LoF. Східноазіатські пацієнти мають вищий рівень ускладнень кровотечі, ніж білі пацієнти з подібною реактивністю тромбоцитів. У нашій PS-сумісній когорті сильна кровотеча виникла у 81 пацієнта (сукупна частота 3,6%) через 12 місяців, що можна порівняти з даними, про які повідомлялося в попередніх дослідженнях.
Висновки
Попри невелике, але значне підвищення значень PRU під час лікування, супутнє застосування ІПП, за наявності клінічних показань, у пацієнтів, які отримували DAPT на основі клопідогрелю, не було пов’язане з підвищеним ризиком несприятливих серцевих і цереброваскулярних подій через 12 місяців. Проте люди зі слабким метаболізмом, які отримували ІПП, мали вищий ризик складних ішемічних наслідків, ніж ті, хто не використовував. Потрібні майбутні дослідження з використанням більш індивідуального підходу, щоб з’ясувати ці взаємодії та оцінити вплив альтернативних антитромбоцитарних стратегій у пацієнтів з високим ризиком.
ДЖЕРЕЛО: https://https://bmcmedicine.biomedcentral.com/
На платформі Accemedin багато цікавих заходів! Аби не пропустити їх, підписуйтесь на наші сторінки! Facebook. Telegram. Viber. Instagram.
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Міжнародний день множинної мієломи

Рекомендації ESC 2024: лікування хронічних ...

Маркери системного запалення та надмірна м ...

Обсяг та інтенсивність щоденної фізичної а ...

Ультраоброблені продукти та ризик хвороби ...

Зниження ризику деменції у молодших поколі ...


.jpg)
