Запалення при серцево-судинних захворюваннях: комплексний огляд біомаркерів і терапевтичних цілей
Дата публікації: 30.10.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: запалення, інфаркт міокарда, атеросклероз, серцево-судинні захворювання, біомаркери

Серцево-судинні захворювання (ССЗ) є основною причиною захворюваності та смертності в усьому світі, особливо в розвинених країнах. Серед них такі розлади, як ішемічна хвороба серця (ІХС), застійна серцева недостатність (ЗСН), хвороба периферичних артерій (ХПА) і венозна тромбоемболія (ВТЕ). ІХС виникає через звуження кровоносних судин внаслідок атеросклерозу і може проявлятися як нестабільна стенокардія, інфаркт міокарда без підйому сегмента ST (NSTEMI) та інфаркт міокарда з підйомом сегмента ST (STEMI). Традиційно добре відомі фактори ризику ІХС включають вік, чоловічу стать, ожиріння, підвищений рівень загального холестерину в сироватці крові та ліпідів низької щільності (ЛПНЩ), куріння, гіпертензію та сімейний анамнез ІХС. Проте дослідження продемонстрували роль запальних процесів у зміцненні артеріальних стінок, що призводить до підвищеного ризику ІХС.
Рекомендуємо переглянути записи семінарів, що пройшли в межах «Ukrainian Cardiology Week»!
Подібним чином, хоча гіпертонія, цукровий діабет та ожиріння є відомими факторами ризику ХСН, також була визначена роль запальних процесів, які сприяють патогенезу шляхом прискорення процесів апоптозу та клітинної дисфункції, що призводить до фіброзу. Дослідження також показали роль запалення в артеріальному тромбозі та ВТЕ, окрім набутих факторів ризику, таких як злоякісне новоутворення, травма та хірургічне втручання. Відомо, що численні маркери запалення пов’язані зі ступенем ВТЕ.
Атеросклероз, визначений як ключова подія серцево-судинних захворювань, визнаний запальним явищем. Пошкодження ендотеліальних клітин призводить до ендотеліальної дисфункції, опосередкованої декількома запальними біомаркерами, такими як TNF-α (фактор некрозу пухлини-α), активні форми кисню, аутоантитіла та окислені ліпопротеїни низької щільності (ЛПНЩ), що зрештою призводить до утворення атеросклеротичних бляшок. Таким чином, підвищений ризик утворення бляшок пов’язаний із хронічними запальними захворюваннями, такими як системний червоний вовчак (СЧВ), запальні захворювання кишечника (ЗЗК), ревматоїдний артрит (РА), спондилоартропатії та інші. На додаток до артеріального тромбозу, роль запалення була вивчена у ВТЕ. Медіатори запалення, включаючи C-реактивний білок (CRP) та інтерлейкін (IL)-6, беруть участь у стимулюванні шляхів згортання крові, інгібуванні фібринолізу та антикоагулянтних шляхів, що можна оцінити для вивчення ступеня захворювання.
Під час епізоду гострого інфаркту міокарда (ГІМ) запальні процеси за участю фібриногену, нейтрофілів, СРБ та IL-6 відіграють значну роль в ішемічно-реперфузійному пошкодженні після реперфузії, що призводить до ремоделювання лівого шлуночка та потенційного розвитку серцевої недостатності. Перебільшена відповідь пов’язана з більшим розміром зони інфаркту та гіршим довгостроковим прогнозом. Крім того, активні форми кисню сприяють алкоголь-асоційованій кардіоміопатії та старінню. У людей з ожирінням посилене вивільнення адипокінів із жирової тканини модулює запальні шляхи, що зрештою призводить до ССЗ.
Дослідження ролі запальних процесів можуть призвести до нових методів лікування, спрямованих на ці запальні біомаркери, таким чином значно зменшуючи тягар серцево-судинних захворювань. Роль колхіцину була ретельно вивчена в лікуванні перикардиту та запобіганні фібриляції передсердь після кардіохірургічних операцій і післяабляційної терапії. Цей комплексний огляд має на меті оцінити наявні докази про роль запалення в серцево-судинних захворюваннях, а також оцінити різні біомаркери та терапевтичні цілі.
Методи проведення огляду літератури
Огляд зосереджений на клінічних дослідженнях щодо ролі запалення в серцево-судинних захворюваннях. Автори виключили дослідження на тваринах і статті, які не обговорювали ССЗ. Дослідники провели ретельний пошук за допомогою Google Scholar і PubMed (включаючи MEDLINE): шукали огляди, систематичні огляди, метааналізи, клінічні випробування та рандомізовані клінічні випробування, які відповідали критеріям включення.
Обговорення
Запальні процеси за участю високих рівнів запальних біомаркерів, зазвичай асоціюються зі старінням, що призводить до підвищеного ризику серцево-судинних захворювань, включаючи гіпертонію, атеросклероз і швидке прогресування серцевої недостатності. Вони роблять значний внесок у глобальний тягар серцево-судинних захворювань, які є однією з основних причин смертності та захворюваності в розвинених країнах і країнах, що розвиваються. Хоча відомо, що хронічні запальні розлади пов’язані з серцево-судинними захворюваннями, точні механізми, що зв’язують ці два типи розладів, детально не описані. Проте були вивчені різні шляхи, що описують роль хронічного запального стану, які включають перебільшену ендотеліальну дисфункцію. Як місцеві, так і системні запальні процеси сприяють нестабільності та розриву бляшки, таким чином викликаючи несприятливі серцево-судинні події.
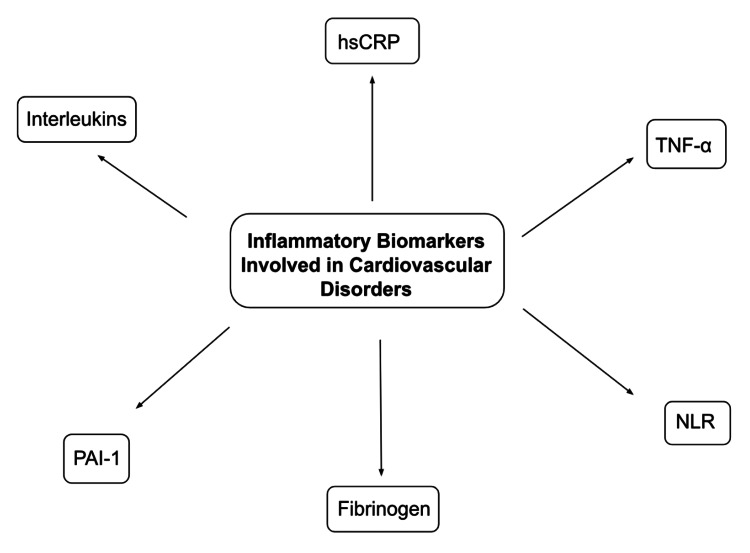
С-реактивний білок (СРБ) є одним із найкраще описаних біомаркерів при атеросклерозі. Його зазвичай описують як частину імунологічних шляхів з його властивостями набухання бактеріальної капсули, фагоцитозу та сприяння аглютинації. Однак це сильний незалежний фактор ризику ІХС і сприяє розвитку атеросклерозу за допомогою трьох механізмів:
- збільшення утворення пінистих клітин шляхом поглинання LDL макрофагами;
- активація класичного шляху системи комплементу;
- інгібування вироблення оксиду азоту (NO) епітеліальними клітинами, таким чином зменшуючи його антиатерогенну дію.
Він використовується як маркер жорсткості артерій і для визначення ризику серцево-судинних подій у здорових людей і пацієнтів із наявними серцево-судинними захворюваннями. Крім того, дослідження продемонстрували кореляцію між вищими рівнями СРБ і тяжкістю інфаркту міокарда. Дослідження Guedeney та ін. продемонстрували зв’язок між високими рівнями високочутливого СРБ (hsCRP) (>2 мг/л) і підвищеним ризиком серйозних несприятливих серцево-судинних подій у пацієнтів, які проходять черезшкірне коронарне втручання (PCI). Втручання, які, як відомо, пов’язані зі зниженням ризику серцево-судинних захворювань, такі як дієта, втрата ваги, припинення куріння, використання статинів та інших ліпідознижуючих препаратів, також були пов’язані зі зниженням значень hsCRP.
Надсімейство TNF є іншою групою біомаркерів, які беруть участь у патофізіології серцево-судинних захворювань, а саме застійної серцевої недостатності, ІХС та ішемічно-реперфузійного ушкодження. Вони діють за допомогою процесу некроптозу, який є запрограмованою формою загибелі клітин. Добре вивчена роль TNF-α, який діє шляхом пригнічення гена eNOS, що призводить до зниження виробництва NO. Це призводить до проліферації ендотелію та інгібування ендотелій-залежної вазодилатації. Дослідження Zhang et al. продемонстрували значний зв’язок між поліморфізмом гена TNF-α-308G/A та ризиком ішемічної хвороби серця (ІХС) у європеоїдних та азіатських популяціях. TNF-α був широко описаний у патофізіології РА. Використання етанерцепту та інфліксимабу, які є агентами проти TNF-α, призвело до покращення ендотеліальної функції разом із симптомами РА порівняно з іншими агентами, що модифікують захворювання, такими як пеніциламін та сульфасалазин. Застосування адалімумабу, моноклонального антитіла, яке також інгібує TNF-α, призвело до значного покращення ендотеліальної функції у пацієнтів із хронічним псоріазом. Подібний результат спостерігався при застосуванні антагоністів TNF-α при інших хронічних запальних захворюваннях, включаючи вовчак, ЗЗК та спондилоартропатії.
Інтерлейкіни (ІЛ), як правило, тригер гострофазової реакції, є іншою групою цитокінів, які беруть участь у запальних шляхах. Прозапальні цитокіни, IL-1 та IL-6, зазвичай асоціюються з підвищенням симпатичного тонусу. Вони діють за механізмом, подібним до механізму TNF-α, пригнічуючи продукцію NO та збільшуючи вивільнення ендотеліну-1, що призводить до ендотеліальної дисфункції та призводить до жорсткості артерій. У дослідженні Li et al. у групі, що складається з осіб ≥60 років, більш високі циркулюючі рівні IL-6 були значно пов’язані з вищою серцево-судинною та загальною смертністю. IL-1 та IL-6 пов’язані з більш високою частотою метаболічного синдрому (MetS), який включає численні розлади, такі як резистентність до інсуліну, центральне ожиріння, дисліпідемія та гіпертонія, причому їхні рівні в сироватці крові використовуються для моніторингу відповіді на фармакологічні лікування, як показано в дослідженні Tabrizi та ін., де терапевтичне лікування MetS за допомогою статинів призвело до зниження циркулюючих рівнів IL-1 та IL-6. Крім того, IL-18 був описаний як прогностичний фактор для оцінки ризику серцево-судинних захворювань, оскільки він може визначати стабільність бляшки та ризик її розриву. Надмірна продукція IL-6 також сприяє надмірному ремоделюванню ЛШ і серцевій недостатності у пацієнтів з STEMI.
Протягом останніх кількох років вивчали співвідношення нейтрофілів до лімфоцитів (NLR) як індикатор системного запалення, яке, викликаючи дисбаланс між прозапальними та фібринолітичними шляхами, порушує процес гемостазу. Таким чином, NLR є важливим фактором у прогнозуванні ступеня ВТЕ, причому більш високі рівні пов’язані з вищим ризиком проксимального тромбозу глибоких вен (ТГВ) і легеневої тромбоемболії (ЛТЕ). Дослідження Lin et al. продемонстрували несприятливі серцево-судинні результати у пацієнтів з STEMI з підвищеним NLR. Більш високі рівні асоціюються з дисфункцією шлуночків і позитивно корелюють з балами Глобального реєстру гострих коронарних подій (GRACE) і тромболізису при інфаркті міокарда (TIMI), таким чином показуючи зв’язок зі смертністю. Вищий показник NLR також пов’язаний з вищим ризиком гострого ішемічного інсульту (AIS) через більшу вразливість атеросклеротичних бляшок у сонних артеріях, як видно у Li et al. у їх дослідженні в китайській популяції. Ризик можна частково пояснити окислювальним пошкодженням, викликаним вивільненням активних форм кисню (АФК) циркулюючими нейтрофілами крові. Пригнічуючи ген eNOS, а також реагуючи з NO з утворенням пероксинітриту, АФК зменшує кількість доступного NO, таким чином викликаючи ендотеліальну дисфункцію.
Інші фактори, такі як інгібітор активатора плазміногену-1 (PAI-1), також пов’язані з такими компонентами MetS, як гіпертригліцеридемія, гіперінсулінемія та ожиріння, що призводить до високої частоти рецидивів гострого інфаркту міокарда серед арабського населення, як це видно з дослідження Абу-Фархи. та ін. Навпаки, адипонектин є кардіопротекторним цитокіном і, як відомо, пов’язаний із меншим ризиком множинних розладів, включаючи ІХС, ГІМ та гіпертензію. Крім того, поліморфізм одного нуклеотиду (SNP) rs1883832, який спостерігається в гені CD40, пов’язаний із підвищеним ризиком атеросклерозу в китайській популяції. Високі рівні фібриногену пов’язані з інтраміокардіальним крововиливом (IMK) і більшим розміром вогнища інфаркту у пацієнтів з STEMI.
Однак деякі дослідження не змогли продемонструвати істотного зв’язку між запаленням і серцево-судинними захворюваннями. Лікування колхіцином, протизапальним препаратом, не показало покращення функціонального стану (з точки зору класу Нью-Йоркської асоціації серця (NYHA)) або смертності у пацієнтів зі стабільною хронічною серцевою недостатністю в дослідженні Defteros et al., навіть якщо він продемонстрував ефективність у зниженні ризику ІХС і рецидиву фібриляції передсердь. Дослідження, які детально вивчають роль шляхів запалення в патогенезі різних серцево-судинних захворювань, можуть допомогти нам краще зрозуміти біомаркери, які беруть участь у цьому процесі, та їх зв’язок із системними запальними розладами, що мало б велике значення у появі нових протизапальних методів лікування в лікування серцево-судинних захворювань.
Висновки
Відомо, що деякі серцево-судинні розлади, такі як ІХС, ГІМ, ВТЕ та ін. пов’язані з хронічними запальними розладами, включаючи ревматоїдний артрит, хронічний псоріаз, спондилоартропатії, ЗЗК та вовчак тощо. Задіяно безліч запальних біомаркерів, таких як СРБ, TNF-α, інтерлейкіни, насамперед IL-1 та IL-6, NLR, PAI-1 та фібриноген. Патогенез в основному полягає в дисфункції ендотелію під час запальних процесів, що призводить до прискореної атеросклеротичної відповіді. Підвищена артеріальна жорсткість разом із пригніченою вазодилататорною реакцією, опосередкованою NO, призводить до нестабільності бляшки та високого ризику її розриву. Таким чином, сироваткові рівні та поліморфізм генів у кількох маркерах використовувалися як незалежні фактори для оцінки ризику та масштабу несприятливих серцево-судинних подій та прогнозування довгострокового прогнозу. Крім того, застосування протизапальної терапії, спрямованої на ці біомаркери при хронічних запальних захворюваннях, призвело до покращення функції судин. Майбутні дослідження шляхів запалення можуть пролити більше світла на залучені біомаркери, що призведе до використання нових протизапальних методів лікування для кращих серцево-судинних результатів.
ДЖЕРЕЛО: https://www.ncbi.nlm.nih.gov/
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Дослідження спростовує міф про швидше засв ...

Важливість профілактики йододефіциту: захи ...

Трансплантація стовбурових клітин крові та ...
Алергічний бронхолегеневий аспергільоз: ХХ ...
Моделювання взаємозв’язків біологічних мар ...
Хвороби сполучної тканини. Cистемний черво ...


