Імуногенетика розладу спектра аутизму: систематичний огляд літератури
Дата публікації: 03.01.2024
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: аутизм, генетика, РАС, мутації, імуногенетика, алелі, гаплотип

Розлад аутистичного спектра (РАС) є одним із найпоширеніших захворювань нервової системи, що вражає приблизно 1 із 59 осіб у всьому світі. РАС характеризується труднощами соціального спілкування та взаємодії, а також повторюваними моделями поведінки та інтересів (Американська психіатрична асоціація, 2013). Крім того, може бути гіпер- та/або гіпореактивність на сенсорну стимуляцію. Ці так звані основні симптоми часто зберігаються в дорослому віці та пов’язані з проблемами, які впливають на якість життя як аутистів, так і осіб, які за ними доглядають. Однак, на цей час нам не вистачає ефективних (фармакологічних) втручань, націлених на «основні» симптоми аутистів, частково через те, що патофізіологічні механізми, що їх обумовлюють, залишаються неясними.
РАС є гетерогенним, складається з різних механізмів, фенотипів і траєкторій. Попередній метааналіз досліджень близнюків продемонстрував, що РАС має сильний генетичний компонент, індексований розрахунковою спадковістю 64–91%. Деякі гени, пов’язані з РАС, є генетичними регуляторами синаптичного формування та передачі сигналів. Однак ці передбачувані генетичні локуси «ризику» не повністю охоплюють складний біологічний ландшафт РАС, і це підкреслює необхідність дослідження ролі, яку відіграють додаткові сімейства генів та їхні пов’язані шляхи розвитку РАС.
Один із потенційно відповідних механізмів містить імунну систему, включаючи її генетичні регулятори. Було висунуто гіпотезу про вплив імунітету на розлад аутичного спектра, який підтверджено нещодавніми дослідженнями як на моделях тварин, так і на людях. Попередні дослідження на мишах підтверджують зв’язок між материнською імунною активацією (MIA) під час вагітності та фенотипами розвитку нервової системи, включаючи поведінку, подібну до шизофренії та аутизму, у новонароджених; і переконливі докази підкреслюють модуляторну роль шляху інтерлейкіну (IL)-6. У людей епідеміологічні звіти описують наявність порушень імунної регуляції, таких як надмірна чутливість до алергенів, вироблення аутоантитіл і дерегульовані протиінфекційні процеси в осіб з аутизмом.
Незважаючи на те, що екологічні стресори імунного гомеостазу, ймовірно, впливатимуть на ці асоціації, дані свідчать про те, що імунорегуляторні гени важливі для РАС. Наприклад, аналізи генів-кандидатів показали зв’язок між РАС і специфічними гаплотипами антигенів лейкоцитів людини (HLA). Пангеномні аналізи, як-от загальногеномні асоційовані дослідження (GWAS) РАС і популяційних ознак, подібних до аутистів, також виявили асоціації з поширеними варіантами або однонуклеотидними поліморфізмами (SNP) у генах імунної системи. Цікаво, що метааналіз GWAS, проведений у кількох психічних розладах, включаючи РАС, підтвердив сильний сигнал асоціації в кластерній області гена HLA. Транскриптомні аналізи посмертних тканин мозку аутистів також вказали на кілька порушень регуляції імунних генів. Нарешті, непряму підтримку генетичної мінливості РАС, пов’язаної з імунною системою, пропонують обсерваційні дослідження, оскільки вони описують зв’язок між РАС та сімейною історією аутоімунних і запальних станів.
З’являється все більше доказів, що підтверджують внесок імунної системи в патофізіологію РАС. Однак механізми, за допомогою яких імунна система може впливати на індивідуальну схильність до РАС, неясні. Однією з можливостей є те, що імунні генетичні фактори опосередковують цей зв'язок. Ця гіпотеза підтверджується нещодавніми відкриттями, які свідчать про те, що імунні гени є одним із механізмів, що сприяють складній генетичній архітектурі РАС.
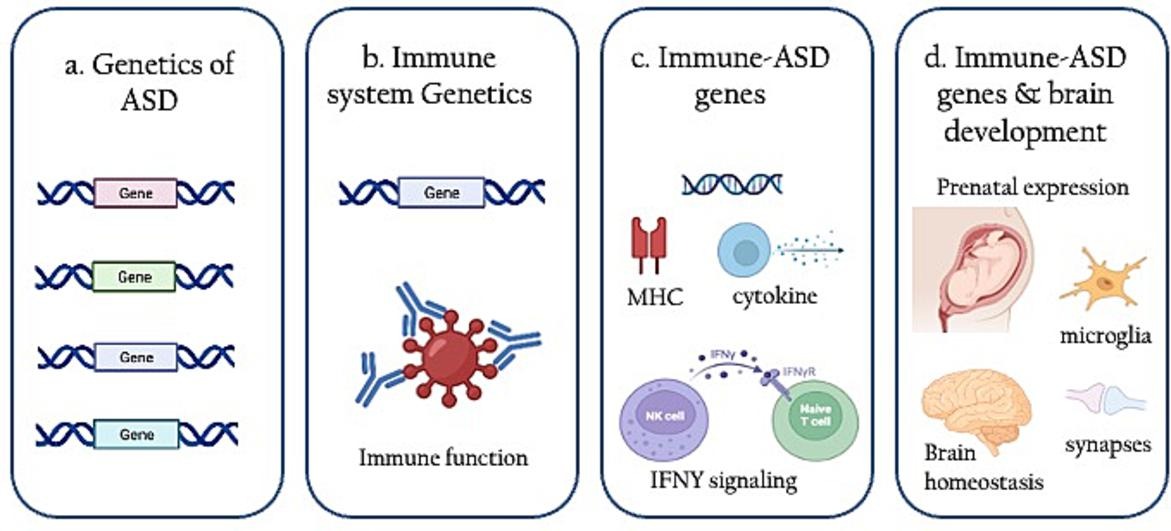
Спадковий імуногенетичний поліморфізм
Дослідження асоціацій на основі SNP пов’язують РАС з різноманітними генами імунної системи. Більшість розглянутих досліджень було зосереджено на головному комплексі гістосумісності (MHC) і розміщених у ньому людських генах HLA, включаючи ті, що належать до кластера II класу, а саме HLA-DRB1 і HLA-DQB1. Ці гени кодують молекули, які контролюють презентацію антигену CD4+ Т-хелперним клітинам, з наступною індукцією гуморальної імунної відповідіі вироблення антигенспецифічних антитіл компартментом В-лімфоцитів. Крім того, є докази ролі некласичного гена HLA класу I, HLA-G, сильного імуномодулятора, який допомагає досягти алогенної толерантності, забезпечуючи тим самим правильний розвиток плода під час вагітності. Дисфункції на рівні цих інтерфейсів можуть індукувати проходження запальних молекул через плаценту з аутоімунними наслідками.
Висновки про варіації генів HLA при РАС узгоджуються з повідомленнями про імунну дисрегуляцію в осіб з аутизмом та членів їхніх родин. Наприклад, гени HLA класу I та класу II є центральними для аутоімунних патологій (наприклад, системного червоного вовчака, ревматоїдного артриту), які часто діагностуються у матерів дітей-аутистів. Крім того, через їх вплив на материнсько-фетальний інтерфейс, варіації генів HLA класу I можуть модулювати раніше встановлений зв’язок між (над)активацією імунної системи матері та станами нервового розвитку, включаючи РАС і шизофренію.
Ідентифіковані пов’язані з РАС імунні гени включають ген CLEC7A, який кодує основні молекулярні цензори протигрибкових імунних реакцій і, отже, потенційно сприяє дисбактеріозу, що спостерігається при РАС. Інші гени імунітету до РАС включають гени факторів транскрипції, FOXP3 , VDR, які керують імунорегуляцією через передачу сигналів Т-регуляторних клітин; і гени, що регулюють трансляцію хемокінів і цитокінів і трансдукцію сигналу, що є важливим для відповіді Т-клітин і противірусної дії, реакція на запалення, IL1R, IFNy, IP-10, RANTES.
Посилення транскрипції імунних генів
Транскриптомічні дослідження описують стан підвищеної експресії або посилення імунних генів при РАС. Це підвищення регуляції свідчить про можливість надмірної активності імунної системи при РАС. Функціональна оцінка посилених імунних генів підкреслює вплив як регуляторів вродженого імунітету, таких як гени, що регулюють сигнальний шлях NK-клітин, так і медіаторів адаптивної імунної відповіді, таких як гени, що контролюють відповіді, опосередковані Т- і В-клітинами. Однак чинники змін експресії, про які повідомлялося в цих дослідженнях, неясні. Потенційні чинники включають зовнішні тригери, такі як віруси та бактерії. Наприклад, спостережувані імуногенетичні дисрегуляції подібні до змін експресії, що спостерігаються у тварин після вірусної (синтетична вірусна РНК поліінозин: поліцитидилова кислота) та/або бактеріальної (ліпополісахариди) стимуляції внутрішньоутробно. Враховуючи дані про успадковані варіації генів інфламмасом і генів факторів транскрипції при РАС, потенційні тригери навколишнього середовища можуть діяти на додачу до вже існуючої імуногенетичної вразливості в деяких випадках РАС.
Примітно, що підвищення регуляції імунних генів здається стійким протягом усього життя, про що повідомляють у дітей-аутистів, дорослих з аутизмом і за результатами аутопсії мозку аутистів. Цілком можливо, що ці зміни виявляються на дуже ранньому етапі життя. Все більше доказів свідчить про те, що вагітність є періодом підвищеної чутливості імунітету та тонкої настройки регуляції імунних генів. Під час вагітності імунна система плода формується, і вона наділена низкою імунних реакцій, які необхідно прийняти пізніше в житті. Фактори, які перешкоджають імунному середовищу на цьому етапі життя, включаючи імуногенетичний фон і інфекційні тригери навколишнього середовища, можуть підштовхнути імунну систему до прозапального стану. Це явище є так званим «фетальним програмуванням», і воно впливає на стан здоров’я та сприйнятливість до захворювань протягом усього життя. Деякі люди з аутизмом також виявляють ознаки запалення — індексовані підвищеними рівнями прозапальних цитокінів — які можуть походити від гестаційної імунної активації.
Крім того, імунна активація є широко розповсюдженою, оскільки вона відбувається як у периферичній, так і в центральній нервовій системі. Таким чином, це підтверджує гіпотезу про те, що РАС слід розглядати як системний розлад. Щодо досліджень транскриптомії на основі мозку, аналізи зосереджені на областях мозку, які функціонально і структурно пов’язані з РАС виявили активацію цитокінів і генів активації лейкоцитів у скроневій частці та лобовій корі, які, як відомо, опосередковують соціальні та когнітивні симптоми аутизму.

Розвиваюча функція імунних генів
Щоб глибше зрозуміти важливість імунних генів при РАС, ми дослідники вивчили останній список генів, пов’язаних із схильністю до РАС, підготовлений ініціативою SFARI. Серед цих генів РАС ідентифікували набір імунних генів і досліджували їх імунологічні та нейробіологічні функції. Ідентифіковані імунні гени РАС регулюють як вроджену, так і адаптовану імунну відповідь, серед іншого, через NK або Т-клітинні сигнальні шляхи. Примітно, що ці гени збагачені для цілої низки процесів нейророзвитку, від формування нейронів, передачі сигналів mTOR до керування аксонами та синаптогенезу.
Щоб дослідити вплив цих генів на розвиток нервової системи, дослідники вивчали їхню модель експресії в епохи розвитку. В результаті досліджень була продемонстрована переважна експресія цих генів в пізньому пренатальному періоді та ранньому дитинстві. Обидва ці періоди є критичними для розвитку мозку. Пізній пренатальний період свідчить про формування та організацію синапсів між нейронами і початок мієлінізації аксонів. Пізнє дитинство (до початку підліткового віку), навпаки, збігається з удосконаленням нейронних ланцюгів і синаптичним скороченням, що лежить в основі сенсорної обробки та навчання. Імунна активація — і посилення імунних генів — на цих етапах життя може мати каскадний вплив на формування нейронів і зв’язок між ними. Наприклад, відомо, що активація мікроглії та подальша циркуляція прозапальних цитокінів і молекул комплементу впливають на нормальний процес поглинання та відсікання невикористаних синапсів. Крім того, (надлишкова) активація клітин вродженого імунітету (наприклад, NK-клітин) — одного з молекулярних шляхів, активованих при РАС — пов’язана з пошкодженням мієлінової оболонки, що перешкоджає нейрональній передачі сигналу в експериментальних моделях розсіяного склерозу.
Рекомендуємо долучатись до Neurology Thursday.
Джерела міжіндивідуальної мінливості імунних генів
Хоча більшість зв’язків між імунними генами та аутизмом повторюються в різних дослідженнях, є деякі невідповідності. Варіації в деяких імунних генах спостерігаються в осіб з аутизмом європейського походження, але не відтворюються в інших етнічних групах. Наприклад, у китайській когорті РАС не було пов’язано з варіаціями в генах AIM2 та JARID2, які відповідно опосередковують активацію запалення та формування нервової трубки, тоді як JARID2ген, разом з іншими генами запалення, були пов’язані з РАС у дослідницьких європейських аналізах. Ці суперечливі генетичні ефекти можуть бути пояснені коливаннями в розподілі алелів між популяціями, які можуть виникати випадково (у разі генетичного дрейфу) та/або невипадково (через внутрішнє/нерозмноження), а також на них впливає популяційна географічне переміщення та вплив різних екологічних проблем. Гени HLA , зокрема, як відомо, є високополіморфними та дуже варіабельними між етнічними групами. Одним із потенційних підходів, який міг би подолати, навіть частково, такі упередження, є вивчення предкових гаплотипів HLA, які зберігаються в популяціях завдяки своїм імунним властивостям.
Деякі дослідження показують, що наслідки імуногенетичних варіацій є специфічними для чоловіків. Специфічні для самців ефекти відповідають результатам, отриманим у гризунів, які вказують на збурену антигенну відповідь після MIA у самців, але не у самок мишей. Однак ці статеві відмінності можуть бути обумовлені кількома факторами. По-перше, може виникнути проблема статистичної потужності. Досліджені популяції розладів аутистичного спектра мають сильний перекіс щодо чоловіків через підвищену частоту розладів аутистичного спектра у чоловіків та/або недостатню діагностику розладів аутистичного спектра у жінок. Таким чином, ці популяції можуть бути недостатніми для виявлення значних ефектів у жінок. По-друге, можливий вплив інших статевих факторів. Наприклад, визнано, що статеві гормони модулюють імунну відповідь. Андрогени — і особливо тестостерон — демонструють імуносупресивні властивості, тоді як естрогени діють як підсилювачі та регулятори імунної відповіді. Враховуючи їхню імунорегуляторну роль, естрогени можуть протидіяти впливу імуногенетичних варіацій у жінок-аутистів. Навпаки, тестостерон може посилити вплив варіацій імунних генів. Одна з основних гіпотез РАС пов’язує внутрішньоутробний тестостерон із початком аутичної поведінки. У цьому контексті наш аналіз показує, що імуногенетичні фактори можуть втручатися в потенційний зв’язок між РАС і тестостероном або статевими гормонами в цілому. Нарешті, важливо відзначити, що Х-хромосома містить найбільшу кількість імунних генів, що робить чоловіків більш чутливими до впливу варіацій, що впливають на будь-який із цих Х-зчеплених імунних генів.
Попередні дослідження також показують, що імуногенетичні варіації можуть бути пов’язані зі специфічними клінічними детермінантами, такими як регресивний аутизм. У регресивних формах аутизму центральною є дисфункція шлунково-кишкового тракту. Вивчаючи розподіл гаплотипів HLA в осіб з регресією та без неї, дослідники визначили захисний субгаплотип HLA класу II, а саме HLA DPA1-DPB4. Цікаво, що цей гаплотип також захищає від кишкових аутоімунних розладів, таких як целіакія. Відповідно до цього в попередніх роботах описано позитивний зв’язок між цими «захисними» гаплотипами HLA та когнітивними можливостями та діагностикою розладів Аспергера. Відповідно до цих захисних ефектів деякі гаплотипи HLA вважаються корисними для еволюції людини завдяки їхній конститутивній ролі в імунологічному нагляді та підтримці гомеостазу мозку та збереженню гематоенцефалічного бар'єра.
Хоча необхідні подальші дослідження для з’ясування цих ефектів, можливо, що — враховуючи клінічну гетерогенність РАС — імуногенетична варіабельність обмежується певними клінічними підгрупами. Гіпотеза імунних клінічних підтипів була розглянута раніше, і вона підтверджується доказами того, що порушення імунної регуляції спостерігаються лише у частини осіб з аутизмом. Вкрай важливо вивчити цю можливість, оскільки це може допомогти визначити осіб, які потенційно можуть отримати найбільшу користь від втручань, спрямованих на мінімізацію ймовірності імунної (надлишкової) активації та націлювання на триваючі порушення імунної регуляції.

Висновки та клінічні наслідки
Генетичні фактори, ймовірно, є одним із посередників у взаємозв’язку між імунною системою та РАС. Імунні гени впливають на фенотип аутистів через успадковані варіації та/або зміни рівнів експресії геномних продуктів. Ці імунні гени беруть участь у ключових процесах нейророзвитку та демонструють регуляцію на ключових етапах нейророзвитку, наприклад, вагітність. Ці відкриття мають важливе клінічне значення. По-перше, вони можуть підтримувати стратегії оптимізації результатів. Результати підвищеної імуногенетичної настройки/чутливості в пренатальному та перинатальному періодах підкреслюють важливість забезпечення (імуно)захищеного середовища матері та плоду протягом цих вікон розвитку. Крім того, вони підкреслюють важливість інтеграції історії хвороби та клінічної оцінки матерів для виявлення жінок, які несуть вище навантаження імуногенетичних варіацій і які, отже, можуть бути більш сприйнятливими до надмірної імунної активації під час вагітності (наприклад, впливу вірусу). Ці жінки, наприклад, можуть отримати користь від профілактичних стратегій, таких як захист від поширених алергенів або інактивована вакцина(наприклад, інактивована вакцина проти сезонного грипу). Крім того, наші результати підкреслюють важливість інтеграції клінічних спостережень у дитинстві з систематичним записом сімейної історії та епізодів імунних порушень. Ця інформація може допомогти визначити підгрупи дітей із вищим шансом імунної дисрегуляції та глибше дослідити, чи генетична схильність до імунних дисрегуляцій у цих дітей може бути передвісником поведінкових і когнітивних змін, типових для РАС. Нарешті, наші висновки можуть сформувати нові підходи до втручання. Ідентифікація специфічних імуногенетичних шляхів, пов’язаних з РАС, може стати основою для майбутніх клінічних випробувань для перевірки ефективності цих шляхів як передбачуваних цілей втручання.
ДЖЕРЕЛО: https://www.sciencedirect.com/
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу
День Святого Валентина для лікарів

Дослідження пов'язує моноклональний В-кліт ...

Другий день практичної конференції експерт ...

Лайфхаки для лікарів від професора Д. Іван ...

Як довго формується і зберігається імуніте ...
Відкрито раніше невідомий бактеріальний к ...


.jpg)
