Роль ендотоксину у разі септичного шоку
Дата публікації: 30.10.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: сепсис, фенотип, covid, септичний шок, інтерлейкіни, COVID

За оцінками, у всьому світі сепсис призводить до понад 11 мільйонів смертей на рік, а септичний шок, найважча форма, призводить до смерті майже 40% госпіталізованих пацієнтів. Таким чином, незважаючи на те, що лікування сепсису покращилося, він залишається основною проблемою в усьому світі. Сепсис також є гетерогенним і неточним синдромом, який, ймовірно, включає кілька фенотипів, деякі з яких можуть піддаватися специфічній терапії, не включеній у звичайні групи сепсису. Прогрес у розробці нових методів лікування сепсису майже напевно вимагатиме зосередження уваги на конкретних підгрупах пацієнтів, і жодна терапія не буде ефективною для всіх пацієнтів. Ретельне обстеження пацієнтів щодо захворювань, що піддаються лікуванню, що проявляються в рамках клінічної класифікації сепсису, є важливим для покращення лікування. Оскільки сепсис є поширеним станом, легко не помітити незвичайні причини органної недостатності та піддатися підтверджувальним упередженням щодо характеру хвороби пацієнта. Пильна увага до попереднього медичного та сімейного анамнезу, а також вибіркове використання низки діагностичних тестів і введення вузьких спеціальностей може допомогти ідентифікувати потенційно виліковні хвороби, які маскуються під «типовий» сепсис.
Рекомендуємо долучитись до Ukrainian Stop Infections Week. Школа інфектології.
Патофізіологія сепсису є складною з факторами сприйнятливості господаря (вік, навколишнє середовище, генетика тощо), які взаємодіють із патогенним навантаженням, вірулентністю та різними молекулярними структурами, пов’язаними з патогенами (PAMP). Найкраще охарактеризованим PAMP є ендотоксином. Хоча ендотоксин може здаватися менш «модним», ніж колись, цитування PubMed продовжують зростати, перевищивши 5000 на рік у 2022 році. Ендотоксин — це ліпополісахаридний компонент зовнішньої клітинної мембрани грамнегативних бактерій, який може викликати швидку реакцію господаря та численні види гострої органної недостатності. Homo sapiens є найбільш чутливим видом до ендотоксину в тваринному світі навіть порівняно з іншими приматами. Домінуючим джерелом ендотоксемії є не живі бактерії, а транслокація бактеріальних продуктів із кишківника, і 70% пацієнтів із септичним шоком і високою активністю ендотоксину мають негативні посіви крові.
Ендотоксичний септичний шок?
Лише близько 10–15% випадків сепсису, або приблизно від третини до половини пацієнтів із септичним шоком, демонструють високий рівень активності ендотоксинів у крові. Термін ендотоксичний септичний шок (ESS) використовувався для визначення цієї підгрупи пацієнтів, і ця група може отримати користь від антиендотоксинової терапії. Однак, хоча ризик ESS найбільший у пацієнтів із грамнегативною інфекцією, сепсис, вторинний до інфікування грампозитивними мікроорганізмами, грибами та деякими вірусами (наприклад, COVID-19), також може призвести до ESS. Таким чином, ми рекомендуємо, щоб термін ESS був зарезервований для пацієнтів з підтвердженою ендотоксемією (наприклад, активність ендотоксину > 0,6 одиниці), а не базувався на посівах крові чи передбачуваному джерелі інфекції. Щорічно у світі реєструється близько 5–7 мільйонів випадків ESS. ESS є особливо смертоносним. У обсерваційному дослідженні Адамік та його колеги повідомили про подвійне збільшення смертності у відділенні інтенсивної терапії пацієнтів із септичним шоком і високою ендотоксичною активністю, і ці відмінності зберігалися протягом принаймні 90 днів, коли смертність становила < 50% при нижчій активності ендотоксину та > 70% при ESS. Цікаво, що бали SOFA та APACHE II у 1 день були ідентичними для цих пацієнтів.
Рекомендуємо пройти курс «Сепсис та септичний шок у дорослих та дітей».
Ендотоксин та патофізіологія та клінічні прояви септичного шоку
Ендотоксин викликає запалення через Toll-подібний рецептор 4 (TLR4) у поєднанні з мієлоїдним фактором диференціювання 2 (MD-2) і кластером диференціювання 14 (CD14), для останнього також потрібен білок, що зв’язує ліпополісахариди (LBP). У людей вихідний сигнальний шлях від активації TLR4 включає три окремі напрямки та є висококонсервативним для різних видів тварин. Однак люди та інші ссавці виявляють ендотоксин за допомогою кількох додаткових механізмів, включаючи сироваткові фактори, внутрішньо- та позаклітинні білки. Трьома основними механізмами розпізнавання є рецепторний шлях TLR4-MD-2, який виявляє позаклітинний ендотоксин; механізм каспази 4/5, який виявляє ендотоксин у цитоплазмі клітини (наприклад, від внутрішньоклітинної бактеріальної інфекції); та комплемент, який зв’язується з ендотоксином у крові. Ці різні сигнальні шляхи можуть допомогти пояснити різноманітні клінічні прояви ESS. Однак знову слід підкреслити, що активність ендотоксину знаходиться в континуумі та практично всі пацієнти з септичним шоком мають певну кількість ендотоксину. Навіть у низьких дозах ендотоксин справляє глибокі ефекти в організмі людини в багатьох системах органів. Оскільки ендотоксин викликає швидку реакцію як у комплементі, так і в запаленні, високі дози призводять до типових моделей пошкодження органів, які включають шок, гостре пошкодження нирок (ГПН), дисфункцію печінки та ураження ендотелію з порушеннями коагуляції/ендотеліальною дисфункцією. Akitomi та його колеги описали профіль експресії генів цільної крові у пацієнта з ESS. Порівняльний аналіз експресії генів у цільній крові пацієнта виявив понад 2000 генів, пов’язаних із окисним стресом, дефензинами нейтрофілів, фактором некрозу пухлини α/ядерним фактором κB, сигнальними каскадами інтерлейкіну-8 і -6 та метаболізмом пірувату. У незвичайному випадку самостійної внутрішньовенної ін’єкції високої дози ендотоксину (1 мг) у пацієнта розвинувся глибокий шок, ГПН, дисфункція печінки та ендотелію з відносно збереженою легеневою та неврологічною функцією.Доведено, що такі пацієнти не тільки мають високі концентрації ендотоксину, але й мають високий тягар гострої органної дисфункції.
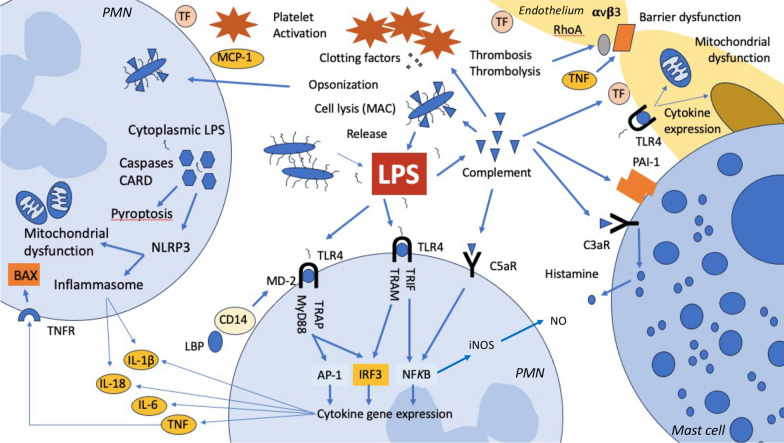
Діагностика ендотоксемії
Хоча картина пошкодження органів є характерною, вона не є специфічною для ендотоксину. Принаймні 30 лігандів TLR4 були ідентифіковані на сьогодні, включаючи численні патогенно-асоційовані молекулярні моделі (PAMP) від бактерій, а також вірусів і грибів. Крім того, було охарактеризовано численні ендогенні ліганди, особливо білок боксу 1 групи високої мобільності (HMGB1) і білки теплового шоку (HSP). Крім того, інші члени сімейства Toll-подібних рецепторів також можуть розпізнавати PAMP і використовувати багато тих самих низхідних шляхів. Таким чином, навіть ретельне клінічне фенотипування не може легко відрізнити ESS від пацієнтів із септичним шоком, але з нижчими рівнями циркулюючого ендотоксину. Однак ця відмінність є критичною, оскільки втручання, спрямовані на ендотоксин, будуть ефективними лише за наявності великої кількості ендотоксину. Швидке визначення того, чи є ендотоксин або інші збудливі молекули основними причинами септичного шоку, має важливе значення для забезпечення адекватної медичної допомоги. На жаль, виявити ендотоксин у крові непросто. Більшість ендотоксинів швидко поглинається комплементом і такими молекулами, як LBP і холестерин HDL, так що «вільний ендотоксин» є відносно дефіцитним, навіть якщо вплив високий. З усім тим, загальний тягар ендотоксину пов'язаний з виживанням. Ендотоксин можна виміряти в цільній крові за допомогою аналізу активності ендотоксину (EAA), і висока активність ендотоксину підвищує ризик смерті. ЕАА — це імунологічний аналіз, у якому використовуються моноклональні антиліпіди А і цільна кров. Ендотоксин у зразку крові зв’язується з АТ, і цей комплекс Ag–Ab також стимулює нейтрофіли у зразку. Активні форми кисню, що утворюються нейтрофілами, потім вимірюються за допомогою реакції хемілюмінесценції люмінолу. Базальний і максимально стимульований зразки вимірюються паралельно як негативний і позитивний контроль, а активність ендотоксину в зразку виражається як відносне значення (рівень ЕАА). Рівень 0,60 або вище вважається порогом для високої активності ендотоксину та пов’язаний зі збільшенням смертності у відділенні інтенсивної терапії. Важливо відзначити, що незважаючи на те, що EAA корелює з ризиком смерті, існують відмінності на рівні пацієнта щодо клінічної відповіді на ендотоксин. Незважаючи на те, що люди дуже чутливі до ендотоксину, ми маємо численні захисні механізми (наприклад, комплемент-зв’язувальні білки), які можуть швидко секвеструвати виклик ендотоксину. Такі фактори, як попередня експозиція, фізіологічний резерв і генетичні варіації, особливо в генах, що контролюють компоненти системи комплементу та функцію лейкоцитів, може вплинути на успіх цих засобів захисту. Хоча ESS можна визначити просто як наявність високої активності ендотоксину в умовах септичного шоку, пацієнти з низьким тягарем органної недостатності (наприклад, послідовна оцінка органної недостатності (SOFA) < 7) у цій ситуації мають низький ризик смерті та не отримують користь від терапії, спрямованої на ендотоксин. У дослідженні EUPHRATES 29-денна смертність від ESS у пацієнтів зі слабкою органною недостатністю становила < 20% і на неї не вплинуло видалення ендотоксину.
Фенотипічні варіації при септичному шоці
Причина того, що деякі пацієнти з високим рівнем ендотоксину мають менш важкі прояви, тоді як інші мають швидко прогресуючу органну недостатність і смерть, неясна. Одним з пояснень може бути рівень активності ендотоксину. Приблизно у 17% пацієнтів у дослідженні EUPHRATES було виявлено EAA 0,9 або більше. Цей рівень виходить за межі можливості точного вимірювання за допомогою ЕАА (еквівалентно приблизно > 4000 пг/мл стандартного препарату ендотоксину штаму E. coli O111:B4). Однак навіть на однакову кількість ендотоксину пацієнти можуть реагувати по-різному. Оскільки запалення на системному рівні є небезпечним, існують численні ендогенні регуляторні механізми, які є життєво важливими для виживання. Вивільняються як про-, так і протизапальні цитокіни, а залучення каскадів комплементу та коагуляції має вбудовані «розривні механізми», що забезпечує максимальний контроль системи. Сепсис є найпоширенішою формою нерегульованого запалення, але існують і інші. Такі синдроми, як експресія цитокінів у відповідь на терапію рецептором химерного антигену (CAR)-T, синдром активації макрофагів (MAS) і атиповий гемолітико-уремічний синдром (aHUS) також є прикладами нерегульованого запалення.
Деякі фенотипові варіації ESS можуть бути пов’язані з генетичними відмінностями. Датське дослідження показало майже шестиразове збільшення ризику смерті від інфекції до 50 років для усиновлених, чиї біологічні батьки також померли від інфекції у віці до 50 років. Однак, незважаючи на значні варіації у відповіді господаря, спроби визначити генетичні варіанти, які сприяють наслідкам сепсису, виявилися складними. Більшість геномних досліджень сепсису розглядали всіх пацієнтів як одну групу, припускаючи спільні генетичні фактори ризику. Вони також зосередилися на кореляції між поширеними поліморфізмами та результатом сепсису з обмеженими функціональними дослідженнями для підтвердження асоціацій. Останнім часом повне секвенування екзомів (WES) стало більш доступним, і були проведені дослідження сепсису. Одне з таких досліджень висунуло гіпотезу про те, що варіації в певних генах, залучених до патогенезу синдромів, таких як MAS і aHUS, будуть більш поширеними у пацієнтів із сепсисом, що проявляється сильним запаленням. Використовуючи сироватковий феритин > 7000 нг/мл як скринінг, дослідники провели WES шести пацієнтам. Усі шість демонстрували один або більше варіантів генів, пов’язаних із гіперзапаленням, а п’ять із шести мали варіанти, пов’язані з MAS та/або aHUS. Хоча всі варіанти, пов’язані з MAS та aHUS, про які повідомлялося в цьому дослідженні, були класифіковані як патогенні або ймовірно патогенні, вони могли або не були причинно-наслідковими. До того, навіть якщо генетичні варіації зіграли певну роль в екстремальних фенотипах, виявлених у цих випадках, застосування імуномодулюючої терапії до септичних індивідуумів із цими варіантами є незрозумілою користю чи шкодою. Однак ці висновки свідчать про те, що скринінг окремих пацієнтів із сепсисом може виявити недооцінену спадкову хворобу та може сприяти створенню прецизійної медицини, керованої геномом.
При дослідженні великих наборів даних пацієнтів із сепсисом можна виявити важливі відмінні клінічні підтипи, які нагадують MAS та aHUS. Сеймур та його колеги використовували машинне навчання для отримання кластерів клінічних характеристик (тобто фенотипів) від пацієнтів, які відповідають критеріям сепсису-3 протягом 6 годин після госпіталізації. Кластеризація K-means була застосована до всіх клінічних і лабораторних змінних в електронних медичних записах (всього 29) від 16 552 пацієнтів, а потім перевірена в другій базі даних (n = 31 160) і в проспективних когортах з обсерваційних досліджень і РКД (n = 5320). ). Оптимальна відповідність була отримана з чотирма похідними фенотипами (α, β, γ і δ) і біомаркерами відповіді господаря (наприклад, цитокінами); моделі органної недостатності та виживаність значно відрізнялися залежно від фенотипу. Цікаво, що в той час, як усі фенотипи включали деяку дисфункцію між органами, ті, що асоціювалися з MAS та aHUS (тобто порушеннями нирок, печінки та згортання крові), мали тенденцію групуватися в одному фенотипі (фенотип δ). δ-фенотип був присутній у 10–15% пацієнтів у різних наборах даних і був пов’язаний зі значно вищим рівнем смертності (32% внутрішньолікарняної смертності порівняно з 2% для α-фенотипу). Логічно припустити, що ендотоксемія може бути причиною цього фенотипу у багатьох пацієнтів. Оскільки кількісне визначення ендотоксину зазвичай не проводиться, а MAS і aHUS часто пропускаються, необхідні подальші дослідження, щоб підтвердити або спростувати гіпотезу про те, що ці умови зумовлюють δ-фенотип.
Лікування ендотоксичного септичного шоку
Для пацієнтів із MAS та aHUS тепер доступна імуномодулююча терапія. Однак у багатьох пацієнтів ці стани можуть виявлятися неповно, і діагноз може бути неясним. Крім того, лікування пацієнтів із сепсисом із застосуванням препаратів, які діють на цитокіни (наприклад, анакінра, антагоніст рецептора інтерлейкіну 1) або комплемент (наприклад, екулізумаб, моноклональне антитіло до C5), може бути шкідливим, якщо інфекція все ще активна.
Замість того, щоб лікувати синдром імуномодулюючою терапією, іншим підходом було б напряму націлитися на ендотоксин. Однак багаторазові спроби блокувати передачу сигналів ендотоксину зазнали невдачі в клінічних випробуваннях, незважаючи на обнадійливі доклінічні дані. Дійсно, спроби нейтралізувати ендотоксин почалися в 1970-х роках і прискорилися в міру того, як була охарактеризована молекулярна структура ендотоксину. Були досліджені різні антитіла до ендотоксину, але клінічні випробування цих методів лікування були невтішними. Проте мало досліджень вивчали ефект цих методів лікування у пацієнтів із виявленою ендотоксемією. Аналіз HA-1A виявив, що це моноклональне антитіло знизило смертність для 27 пацієнтів з ендотоксином у крові, але не для 55 пацієнтів без виявленого ендотоксину. Проте в цілому результати в ендотоксин-позитивних підгрупах пацієнтів не були позитивними. Причини розриву між сильними доклінічними даними, біологічним обґрунтуванням і негативними випробуваннями розглядалися в багатьох оглядах. Потенційні пояснення включають проблеми з самими агентами, досліджуваними популяціями та часом терапії.
Альтернативною стратегією фармакологічної нейтралізації ендотоксину є видалення молекули за допомогою екстракорпоральної терапії. Було випробувано кілька методів, але найбільш поширеним є гемоадсорбція поліміксину B (PMX). Поліміксини – це група циклічних катіонних поліпептидних антибіотиків, які мають добре охарактеризоване зв'язування ендотоксинів. У той час як токсичність обмежує клінічне використання поліміксину В як антибіотика, сполуку можна зв’язати з гемоадсорбційною колонкою, а циркулюючий ендотоксин можна ефективно видалити шляхом впливу іммобілізованого поліміксину В без системної токсичності. Цей метод був доступний в Японії з 1994 року та отримав схвалення в Європі в 1998 році. Понад 100 000 пацієнтів пройшли лікування в більш ніж десятку країн. Аналіз клінічних даних із національної бази даних Японії з використанням відповідності схильності та інших методів продемонстрував переваги в діапазоні 3–7% абсолютного зниження ризику госпітальної смертності. Жодне клінічне випробування не проводилося з достатньою потужністю для визначення розміру впливу в цьому діапазоні. З трьох найбільших досліджень на сьогодні лише дослідження EUPHAS виявило значне покращення виживаності. Первинною кінцевою точкою для EUPHAS було купірування шоку протягом 72 годин, і це було значно покращено з PMX P < 0,001. Однак вторинна кінцева точка, 28-денна смертність, становила 32% у пацієнтів, які отримували PMX, і 53% у пацієнтів з традиційною терапією. Дослідження ABDOMIX у Франції було негативним, але дослідження залучило популяцію зі значно нижчим ризиком (смертність у контрольній групі < 20%) із середнім балом SOFA 10. Крім того, коли масу ендотоксину вимірювали після завершення дослідження, середні значення були досить низькими порівняно з попередніми дослідженнями сепсису.
Дослідження EUPHRATES у США, найбільше дослідження на сьогодні, не виявило переваги виживання для PMX. Проте випробування EUPHRATES суттєво відрізнялося за дизайном від інших випробувань. У середині випробування зарахування було обмежене пацієнтами з оцінкою поліорганної дисфункції (MODS) 9 або менше, а група з MODS > 9 стала когортою первинного аналізу. Ця зміна була викликана доказами того, що будь-яка користь, здається, була обмежена пацієнтами з більшою дисфункцією органів. Подібного висновку нещодавно дійшли Фухіморі та ін. в аналізі понад 4000 пацієнтів з Японії. У цьому аналізі терапія була найефективнішою для пацієнтів зі значною недостатністю органів.
Ще однією суттєвою відмінністю між дослідженням EUPHRATES та іншими дослідженнями було використання тесту EAA, а участь у дослідженні EUPHRATES була обмежена для пацієнтів із септичним шоком, у яких було встановлено EAA 0,60 або вище. Загалом дослідження EUPHRATES показало, що навіть у протокольному аналізі, який обмежувався пацієнтами з MODS > 9, 28-денна смертність становила 33% при гемоперфузії проти 36,4% при фіктивній різниці, яка не була статистично значущою. Однак аналіз ЕАА не може точно визначити кількість циркулюючого ендотоксину, якщо рівень ЕАА становить 0,90 або більше, і значення в цьому діапазоні можуть не відображати рівні, які піддаються лікуванню. Повторний аналіз даних дослідження EUPHRATES показав, що після видалення пацієнтів з ЕАА на рівні або вище 0,9 28-денна смертність становила 26,1% для гемоперфузії поліміксином В проти 36,8% для імітації процедури.
Нарешті, навіть для пацієнтів із високим рівнем ендотоксину лікування сепсису завжди вимагатиме ряду терапій залежно від природи та тяжкості органної дисфункції. Антибіотики та контроль джерела разом із підтримуючою терапією залишаються життєво важливими. ГПН ускладнює більшість цих випадків, і багато з них потребують замісної ниркової терапії. Стратегії очищення крові, спрямовані на численні аспекти синдрому ESS, також можуть бути розглянуті, особливо враховуючи, що 28-денна смертність все ще може становити> 30%, навіть якщо застосовується видалення ендотоксину. Такі стратегії можуть бути націлені на низхідні медіатори з використанням сорбентів широкого спектра (наприклад, Cytosorb, HA380). Щоб встановити ефективність цього підходу, знадобляться майбутні випробування.
Висновки
Ендотоксичний септичний шок (ESS), який визначається високою активністю ендотоксину (наприклад, EAA > 0,6) та органною недостатністю (наприклад, SOFA > 7), є підтипом сепсису, що становить приблизно 5–7 мільйонів випадків щорічно у всьому світі. У деяких пацієнтів розвивається тяжке гіперзапалення, дисфункція печінки та дисеміноване внутрішньосудинне згортання, що нагадує синдром активації макрофагів (MAS), а інші нагадують атиповий гемолітико-уремічний синдром (aHUS); деякі пацієнти мають ознаки обох. Ці підтипи є характерними для δ-фенотипу сепсису та можуть мати генетична схильність. ESS має смертність понад 50%, а терапія обмежена. Зусилля щодо застосування імуномодулюючої терапії до ESS досліджуються, як і дослідження щодо розширення використання екстракорпорального видалення ендотоксинів, а також інших форм очищення крові.
ДЖЕРЕЛО: https://www.ncbi.nlm.nih.gov