Причини та патофізіологія дефіциту вітаміну В12 і фолієвої кислоти
Дата публікації: 01.11.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: вітамін В12, фолієва кислота, кобаламін, еритропоез, пернціозна анемія, всмоктування
Дефіцит вітаміну B12 та/або фолієвої кислоти може спричинити мегалобластну анемію (макроцитарна анемія з іншими ознаками, спричиненими порушенням поділу клітин). Дефіцит вітаміну B12 також може спричинити нервово-психічні розлади. Окрім усунення дефіциту, важливим аспектом лікування є визначення основної причини, оскільки потреба в додатковому обстеженні, тривалість терапії та шлях введення можуть відрізнятися залежно від основної причини.
У цьому тематичному огляді обговорюються основні причини дефіциту вітаміну B12 і фолієвої кислоти, а також їх патофізіологія.
Споживання та метаболізм
Дієтичні джерела та RDI — Клітини людини не можуть синтезувати вітамін B12 або фолати. У більшості випадків типова збалансована дієта міститиме достатню кількість обох вітамінів, за винятком того, що веганська дієта не містить достатньої кількості вітаміну B12.
● Вітамін B12 – Вітамін B12 (також званий кобаламіном) присутній у багатьох продуктах тваринного походження, включаючи м’ясо, молочні продукти та яйця. Найвищі концентрації спостерігаються в молюсках і печінці, що пояснює ефективність споживання великої кількості печінки для лікування перніціозної анемії (ПА) до того, як була відкрита роль вітаміну B12. Багато сухих сніданків збагачені вітаміном B12. Навпаки, вітамін B12 відсутній у продуктах рослинного походження, за винятком тих, що містять продукти тваринного походження або додають вітамін B12. Морські водорості не є джерелом вітаміну B12, хоча деякі їстівні водорості, які використовуються в японських супах, можуть містити деяку кількість вітаміну B12.
Як описано в довідці про дієти з вітаміном B12 від Національного інституту здоров’я (NIH), рекомендована добова норма (RDI) вітаміну B12 коливається від 0,4 мкг на день у маленьких немовлят до 2,4 мкг на день у дорослих, з дещо вищими потребами. під час вагітності та лактації. Типова не вегетаріанська дієта містить достатню кількість вітаміну B12, але вегетаріанська або строга вегетаріанська дієта зазвичай не містить достатньої кількості вітаміну B12, і її слід доповнювати.
Добавки вітаміну B12 доступні без рецепта в таблетках і рідинах, а також у назальних і сублінгвальних формах. Ми уникаємо назальної форми, тому що вона не ефективніша, ніж пероральна форма, коштує дорого та викликає ринорею. Ці добавки зазвичай позначаються як вітамін В12, метилкобаламін, гідроксикобаламін, аденозилкобаламін або ціанокобаламін (ціанід вводиться під час певних виробничих процесів, але не додає токсичності). Вітамін В12 також присутній у полівітамінах і комплексі вітамінів групи В. Усі ці форми вітаміну є ефективними для забезпечення вітаміном B12. Однак ми не використовуємо склади вітаміну B12 тривалої дії для лікування дефіциту вітаміну B12 або запобігання йому у людей з високим ризиком через побоювання щодо зниження біодоступності.
Також доступний парентеральне введення вітаміну B12 (вводиться шляхом внутрішньом’язової або глибокої підшкірної ін’єкції).
● Фолієва кислота – Фолієва кислота (також званий вітаміном В9 або птероїлглутаміновою кислотою) міститься в багатьох рослинних і тваринних продуктах, особливо в темно-зелених листових овочах і печінці. Фолати, що зустрічаються в природі, включають низку поліглутаматних сполук. Вони в основному знаходяться у відновленій формі, наприклад, 5-метилтетрагідрофолат (5-метил-ТГФ) або f-формілтетрагідрофолат (також званий фолієвою кислотою, яка є агентом у лейкотворині). Фолієва кислота — це термін, який використовується для позначення хімічно синтезованої форми вітаміну, який використовується в дієтичних добавках і збагачених харчових продуктах; Фолієва кислота є окисленим моноглутаматом, який є більш хімічно стабільним, ніж харчові фолати.
RDI фолієвої кислоти виражається в еквівалентах харчової фолієвої кислоти, оскільки фолієва кислота приблизно вдвічі більша біодоступність, ніж природні фолати з харчових продуктів. Як описано в інформаційному довіднику про фолієву кислоту від NIH, рекомендоване добове споживання фолієвої кислоти коливається від 65 мкг харчового еквівалента фолієвої кислоти для немовлят до 400 мкг харчового еквівалента фолієвої кислоти для дорослих, з вищими потребами під час вагітності та лактації (600 і 500 мкг відповідно). З кінця 1990-х або початку 2000-х років у багатьох країнах було запроваджено добавки до злаків, борошна та зерна, головним чином спрямовані на зниження ризику дефектів нервової трубки під час ембріогенезу, сюди входять Сполучені Штати, Канада, Австралія, Сполучене Королівство та інші країни, перелічені в рамках.
Засвоєння та запаси вітаміну B12 — Вітамін B12 є хімічно складною молекулою. Низка механізмів забезпечує його стабільність і поглинання:
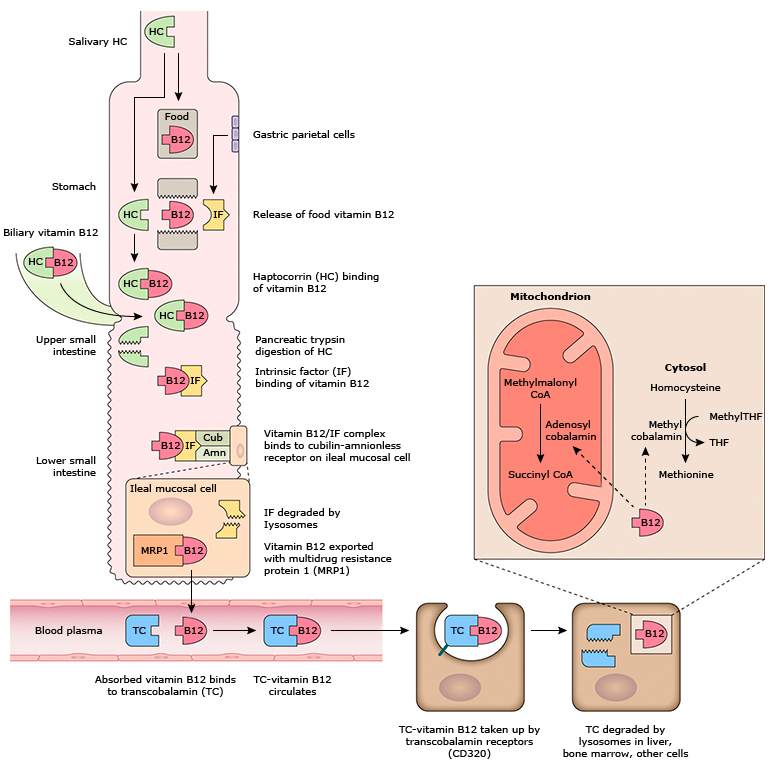
● Вітамін B12, що міститься в харчових продуктах, пов’язаний з білками, і він розщеплюється в кислотному середовищі шлунка за допомогою пепсину.
● Додаткові білки, що зв’язують вітамін B12, відомі як R-зв’язуючі речовини або гаптокорини, виділяються в слині та зв’язуються з вітаміном B12 у шлунку.
● Парієтальні клітини шлунка виробляють внутрішній фактор. Панкреатичні протеази, що виділяються в дванадцятипалу кишку з вищим pH, відщеплюють R-зв’язувальні речовини, дозволяючи вітаміну B12 зв’язувати внутрішній фактор.
● Комплекс вітаміну В12 і внутрішнього фактора поглинається рецепторами слизової оболонки клубової кишки. Точна природа рецептора досліджується; вважається, що він складається з білків cubilin і amnionless і був названий "cubam", щоб відобразити ці компоненти.
● Невелика кількість вітаміну B12 (<1 відсотка) може бути поглинена шляхом пасивної дифузії. Це є основою для використання високих доз перорального вітаміну В12 при перніціозній анемії та інших станах, які перешкоджають нормальному шляху всмоктування.
● Вітамін B12 експортується в кров за допомогою АТФ-зв'язуючого касетного білка. Вітамін B12 пов'язаний із сімейством транскобаламінів, які іноді називають кобалофілінами.
● Вітамін B12, зв’язаний з транскобаламіном, поглинається іншими клітинами організму шляхом опосередкованого рецепторами ендоцитозу.
● Внутрішньоклітинний вітамін B12 метаболізується в аденозилкобаламін або метилкобаламін. Функції цих білків описані нижче.
Загальні запаси вітаміну B12 в організмі знаходяться в діапазоні від 2 до 5 мг, причому приблизно половина з них зберігається в печінці. Якщо споживання або засвоєння вітаміну B12 припиняється, дефіцит зазвичай не розвивається протягом принаймні одного-двох років, іноді довше.
Поглинання фолієвої кислоти та її запаси — поліглутамати фолієвої кислоти розщеплюються до моноглутаматів і всмоктуються в просвіті порожньої кишки. Поглинання переважно опосередковується носієм, але також має місце пасивне поглинання. Системи переносників включають рецептори фолату, що переносять відновлений фолат, і транспортер фолату, зв’язаний з протонами. Абсорбція є оптимальною при слабокислому pH.
Фолієва кислота повинна бути зменшена, щоб вона була ефективною у своїй біологічній ролі в перенесенні одного вуглецю. Він відновлюється до дигідрофолату, а потім до тетрагідрофолату (THF) за допомогою серії ферментативних етапів. ТГФ згодом перетворюється на 5,10-метилен ТГФ, який перетворюється на L-5-метил-ТГФ за допомогою ферменту метилентетрагідрофолатредуктази.
Переважною формою фолієвої кислоти в плазмі є L-5-метил-THF. Це швидко очищається гепатоцитами та іншими клітинами. Хірургічний біліарний дренаж призводить до зниження рівня фолієвої кислоти в сироватці протягом шести годин, тоді як дієтичне обмеження не призводить до порівнянного зниження протягом трьох тижнів. Це спостереження вказує на те, що існує велика кишково-печінкова циркуляція фолієвої кислоти.
Фолат проникає в клітини шляхом зв’язування з рецептором фолату. Мегалін є рецептором, пов'язаним з рецептором ліпопротеїнів низької щільності, який може приймати різні білки, включаючи фолати. Потрапляючи всередину клітини, фолат знову поліглутаматується до біологічно активної форми, яка не може дифундувати назад з клітини. Поліглутаматований тетрагідрофолат діє як одновуглецевий донор для біологічних процесів, включаючи синтез пуринів і піримідинів, які використовуються в синтезі ДНК.
Загальні запаси фолієвої кислоти в організмі оцінюються приблизно від 500 до 20 000 мкг (0,5-20 мг). Якщо споживання фолієвої кислоти припиняється, дефіцит може розвинутися протягом декількох тижнів або місяців або швидше, якщо потреба в фолієвій кислоті зростає.
Фізіологічні ролі
Синтез ДНК, синтез РНК, метилювання ДНК — Вітамін B12 і фолат відіграють вирішальну роль у синтезі ДНК і РНК. Тому дефіцит будь-якого вітаміну може погіршити синтез ДНК, що, своєю чергою, може спричинити зупинку клітини у фазі синтезу ДНК (S) клітинного циклу, викликати помилки реплікації ДНК та/або зазнати апоптотичної смерті.
Основна роль фолієвої кислоти в синтезі ДНК полягає в постачанні метильних груп, які додаються до інших молекул (тобто діяти як одновуглецевий донор). Основна роль вітаміну B12 полягає в тому, щоб діяти як кофактор у реакції, яка переробляє 5-метилтетрагідрофолат назад у тетрагідрофолат (ТГФ), який потім може бути перетворений у форми, які можуть діяти як одновуглецеві донори. Утворення ТГФ пов'язане з перетворенням гомоцистеїну в метіонін. ТГФ потім перетворюється на вуглецево-донорні форми фолату, 10-форміл-ТГФ і метилен-ТГФ (також званий 5,10-CH 2 -ТГФ або 5,10-метиленТГФ). Нестача вітаміну B12 може спричинити захоплення фолієвої кислоти у формі 5-метил-THF (гіпотеза пастки метил-THF). Крім того, нестача вітаміну B12 може призвести до дефіциту метіоніну, який використовується для отримання S-аденозилметіоніну (SAM), який також використовується як одновуглецевий донор (гіпотеза форміатного голодування).
Одновуглецевий метаболізм використовується в кількох реакціях, необхідних для створення будівельних блоків ДНК.
● Пурини – 10-формілТГФ віддає дві метильні групи для синтезу пуринів (включених у пуринове кільце).
● Піримідини – 5,10-метиленТГФ передає метильну групу для перетворення дезоксиуридинмонофосфату (dUMP) у дезокситимідинмонофосфат (dTMP). Дезоксиуридинтрифосфат (dUTP) може бути випадково включений у ДНК замість дезокситимідинтрифосфату (dTTP), і звичайні процеси репарації видалення можуть бути не в змозі виправити помилку через відсутність доступного dTTP.
Повторювані цикли дефектної репарації ДНК можуть призвести до розривів та фрагментації ланцюгів ДНК. Затримка S-фази при встановленні нормального дозрівання цитоплазми називається ядерно-цитоплазматичною диссинхронією, і це є основою для мегалобластичних змін у кістковому мозку. Апоптозна загибель клітин є основою для неефективного еритропоезу.
Метильні групи, що утворюються під час перетворення SAM на S-аденозилгомоцистеїн (SAH), також використовуються в інших процесах, включаючи метилювання ДНК, епігенетичну модифікацію, при якій метильні групи додаються до ДНК або ДНК-зв’язуючих білків, що може призвести до збільшення або зниження експресії генів, метилювання ліпідів і основного білка мієліну, що може відігравати певну роль у функції нейронів.
Гемопоез — гемопоетичні клітини-попередники є одними з клітин, що найшвидше діляться в організмі, і, отже, є одним із типів клітин, найбільш чутливих до аномального синтезу ДНК, викликаного дефіцитом вітаміну В12 і фолієвої кислоти.
Існує два основних наслідки цих недоліків для кровотворення:
● Мегалобластичні зміни – мегалобластичні зміни спричинені уповільненням циклу поділу ядра відносно циклу дозрівання цитоплазми (тобто ядерно-цитоплазматична дисинхронія). Різні мегалобластичні зміни можна спостерігати в будь-якій клітині-попереднику з ядром у кістковому мозку, включаючи незрілі або морфологічно аномальні ядра відносно зрілості цитоплазми, гігантські метамієлоцити та підвищені мітотичні показники. Ці зміни можуть спричинити ізольовану анемію та/або інші цитопенії. Нееритроїдні цитопенії (лейкопенія та тромбоцитопенія) зазвичай легкі. Макроцитарні еритроцити (або макроовалоцитарні еритроцити) і гіперсегментовані нейтрофіли є класичними знахідками в мазку периферичної крові. Тимчасово гіперсегментовані нейтрофіли часто передують макроцитозу, а макроцитоз часто передує анемії. Зміни клітинної морфології та індексів червоних кров’яних тілець не можна використовувати для визначення дефіциту вітаміну, оскільки вони ідентичні в обох випадках.
● Неефективний еритропоез – неефективний еритропоез (також званий інтрамедулярним гемолізом) виникає, коли відбувається передчасна смерть (наприклад, фагоцитоз або апоптоз) клітин-попередників еритропоезу, що розвиваються в кістковому мозку. Може спостерігатися гіперклітинність кісткового мозку та лабораторні результати гемолізу, включаючи підвищення сироваткового заліза, непрямого білірубіну та лактатдегідрогенази (ЛДГ) і низький гаптоглобін. Кількість ретикулоцитів зазвичай низька.
Функція нейронів. Відомо, що дефіцит вітаміну B12 негативно впливає на функцію нейронів, але точні механізми залишаються невідомими.
Вважається, що знижене метилювання нейронних ліпідів і нейронних білків, таких як основний білок мієліну, відіграє певну роль у деяких неврологічних дефіцитах. Основний білок мієліну становить приблизно одну третину мієліну, і демієлінізація в умовах дефіциту вітаміну B12 може пояснити багато неврологічних знахідок.
Дефекти нейронів менш ймовірно пов’язані з дефіцитом фолієвої кислоти, але про зв’язок повідомлялося. Механізм недостатньо вивчений, але може включати реакції метилювання, які впливають на функцію нейронів. Епідеміологічні дослідження свідчать про те, що статус фолієвої кислоти у матері може впливати на ризик розвитку розладів спектра аутизму, але існують численні змішують фактори та труднощі у проведенні та інтерпретації цих типів досліджень.

Підвищений рівень вітаміну B12 або фолієвої кислоти.
Вітамін B12 і фолієва кислота є водорозчинними вітамінами. Передозування не є основним фактором, оскільки надлишок будь-якого вітаміну виводиться з сечею.
Підвищений рівень вітаміну B12 у сироватці також може просто свідчити про недавній прийом або ін’єкцію додаткового вітаміну B12. Підвищений рівень вітаміну B12 в сироватці іноді спостерігався в осіб, які не отримували добавки; однак ми не виступаємо за тестування рівня вітаміну B12 як спосіб оцінки станів, відмінних від дефіциту вітаміну B12. Деякі обсерваційні дослідження повідомляли про зв’язок підвищення рівня вітаміну В12 з різними клінічними синдромами та злоякісними новоутвореннями; однак ці висновки не повідомлялися послідовно.
Механізми, які можуть пов’язувати ці стани з підвищеним рівнем вітаміну B12 у сироватці крові, не повністю вивчені та можуть бути пов’язані з вивільненням з пошкоджених клітин у кровообіг (захворювання печінки), зниженим кліренсом (ниркова недостатність, захворювання печінки), підвищенням рівня транскобаламіну II у сироватці крові або інші транскобаламіни або підвищення гаптокорину. Немає жодних доказів того, що підвищений рівень вітаміну B12 відіграє будь-яку роль у патогенезі цих станів і, ймовірно, це просто маркер печінкової дисфункції або інших системних процесів.
Якщо підвищений рівень вітаміну B12 виявлено в особи, яка нещодавно не отримувала ін’єкції вітаміну B12 або не приймала добавки з вітаміном B12, може бути доцільним переглянути історію хвороби, обстеження та лабораторні дослідження, щоб визначити, чи є одне з цих системних захворювань. Ми отримуємо повний аналіз крові (CBC) з диференціальною, повною метаболічною панеллю та проводимо подальше тестування, якщо виявлено відхилення.
Підвищення рівня фолієвої кислоти зазвичай не викликає занепокоєння у здорових людей.
Однак прийом добавок у високих дозах фолієвої кислоти може бути пов’язаний із незворотним неврологічним ушкодженням при застосуванні особам із недіагностованою перніціозною анемією.
Крім того, додавання фолієвої кислоти може вплинути на контроль судом або, можливо, перешкоджати всмоктуванню цинку в кишківнику.
Причини дефіциту вітаміну В12
Існує ряд потенційних причин дефіциту вітаміну В12, що відображають відносно складний процес всмоктування, описаний вище, і численні потенційні джерела втручання в цей процес. Найпоширенішими з них є перніціозна анемія (ПА), аутоімунне захворювання, і неімунні розлади шлунка або тонкої кишки, які перешкоджають всмоктуванню вітаміну B12 (наприклад, баріатрична або кишкова хірургія).
Люди похилого віку можуть мати комбінацію станів, що перешкоджають всмоктуванню вітаміну B12 з їжі, включаючи атрофію шлунка, ахлоргідрію через інгібітор протонної помпи, надмірний ріст кишкових бактерій через антибіотики та/або надлишок алкоголю. Ці люди можуть адекватно засвоювати кристалічний вітамін B12 з добавок; Таким чином, цей стан називають мальабсорбцією харчового кобаламіну. Подібне явище було зареєстровано в осіб, інфікованих вірусом імунодефіциту людини (ВІЛ).
Перніціозна анемія — ПА є поширеною причиною дефіциту вітаміну В12. У проспективній серії, яка перевіряла рівень вітаміну В12 та антитіла до внутрішнього фактора у 729 амбулаторних осіб віком 60 років і старше, 17 (2,3%) мали ознаки ПА. ПА частіше зустрічалася у жінок, ніж у чоловіків (2,7 проти 1,4%) і була однаково ймовірною у чорношкірих і білих жінок.
ПА є аутоімунним захворюванням, яке перешкоджає утворенню комплексу внутрішніх факторів вітаміну В12, що, своєю чергою, різко знижує всмоктування вітаміну В12.
Аутоантитіла відіграють певну роль у патогенезі ПА, а також використовуються діагностично. Зазвичай зустрічаються аутоантитіла в осіб з ПА можуть бути спрямовані проти внутрішнього фактора або проти антигенів парієтальних клітин шлунка, але тільки антитіла до внутрішнього фактора мають важливе значення в патогенезі. Деякі дослідники припускають роль CD4 Т-клітин у руйнуванні клітин шлунка. Специфічний клон Т-клітин не ідентифікований, але в принципі такий клон може пояснити клінічні прояви при ПА, особливо в осіб, у яких відсутні аутоантитіла до внутрішнього фактора.
Жодне з антитіл не має ідеальних експлуатаційних характеристик для діагностики:
● Антивнутрішній фактор – антитіла до внутрішнього фактора відносно нечутливі. Повідомляється, що вони спостерігаються приблизно у 50-70 відсотків людей з ПА. У серії 1992 року з 324 пацієнтів із задокументованою ПА, які пройшли тестування на антитіла до внутрішнього фактора, 228 (70%) мали позитивний результат. На відміну від попередніх досліджень, які припускали, що ПА була більш ймовірною у літніх білих людей, у цьому дослідженні антитіла до внутрішнього фактора частіше зустрічалися у чорношкірих, ніж у білих людей (84 і 55 відсотків відповідно) і трохи частіше у жінок, ніж у чоловіків (73 і 66 відсотків). Дослідження, проведені в Кореї та Китаї, повідомили про поширеність 78 та 73 відсотки.
● Антипарієтальні клітини – антитіла антипарієтальних клітин, більшість з яких реагують з кислотоутворюючою HK АТФазою на парієтальних клітинах, є відносно неспецифічними. Повідомляється, що вони спостерігаються приблизно у 85-90 відсотків осіб з ПА, але вони також спостерігаються при інших аутоімунних розладах і у здорових осіб без аутоімунного захворювання. Останнє спостереження було проілюстровано в серії, в якій майже 500 зразків сироватки здорової популяції в Австралії були перевірені на наявність антитіл до парієтальних клітин; З них приблизно 5 відсотків були позитивними, зі збільшенням, пов'язаним з віком. Цікавим є припущення, що антитіла проти Helicobacter pylori здатні перехресно реагувати з парієтальною клітиною H. K ATPase, припускаючи, що молекулярна мімікрія може відігравати певну роль у розвитку дефіциту вітаміну B12 у генетично чутливих осіб, які інфікуються H. pylori.
Оскільки тестування на антитіла не має ідеальної діагностичної точності, діагностика ПА зазвичай вимагає комбінації лабораторних тестів, включаючи рівень вітаміну B12, метаболіти та/або тестування на антитіла. Коли ми проводимо тестування на антитіла, ми вимірюємо антитіла до внутрішнього фактора, але не до парієтальних клітин, як це обговорюється окремо.
ПА часто пов'язана з додатковими аутоімунними станами та/або додатковими аутоантитілами. Як приклади:
● Полігландулярний аутоімунний синдром типу 2 (PAS-2) - генералізоване аутоімунне захворювання, що характеризується аутоімунним захворюванням щитоподібної залози, недостатністю надниркових залоз, цукровим діабетом 1 типу та/або аутоімунними не ендокринними симптомами, такими як вітиліго.
● Хронічний атрофічний гастрит, обумовлений антитілами антипарієтальних клітин.
ПА також пов'язана з підвищеним ризиком раку шлунково-кишкового тракту. Ахлоргідрія може призводити до компенсаторної гіпергастринемії та клітинної метаплазії, а також до посилення мікробної колонізації з утворенням генотоксичних побічних продуктів.
Недостатнє споживання їжі — Як зазначалося вище, вітамін B12 присутній у продуктах тваринного походження. Вегани, суворі вегетаріанці, а також деякі вагітні або годуючі жінки, які обмежують тваринний білок, можуть мати дефіцит вітаміну В12. Багато з цих людей знають про необхідність прийому добавок. Доцільно переглянути рекомендоване дієтичне споживання та доступні форми додаткового вітаміну B12 разом із пацієнтом, щоб переконатися, що споживання є достатнім.
Мальабсорбція харчового кобаламіну — Харчова мальабсорбція кобаламіну — це термін, який використовується для опису дефіциту вітаміну В12, попри нормальний рівень вітаміну В12 у їжі. Основною проблемою є нездатність вивільнити вітамін В12 з харчових білків. Таким чином, ці люди можуть засвоювати добавки вітаміну B12, в яких вітамін не пов'язаний з білком, але вони менш здатні засвоювати дієтичний вітамін B12, пов'язаний з харчовими білками, через умови, які перешкоджають дисоціації вітаміну від харчових білків. Вони часто мають один або кілька факторів, таких як атрофічний гастрит; шлункова хірургія; хронічна інфекція H. pylori; ахлоргідрія внаслідок хронічного застосування антацидів, блокаторів Н2-рецепторів або інгібіторів протонної помпи; хронічне надмірне вживання алкоголю; недостатність підшлункової залози; або застосування антибіотиків при надмірному бактеріальному розмноженні бактерій кишківника.
Феномен мальабсорбції харчового кобаламіну особливо часто зустрічається у осіб похилого віку. Легкий та/або субклінічний дефіцит вітаміну В12 був задокументований з відносно високою частотою у літніх людей, при цьому різні обсерваційні дослідження описували поширеність приблизно від 5 до 20 відсотків залежно від досліджуваної популяції та лабораторних критеріїв, що використовуються для визначення дефіциту.
Багато осіб з харчовою мальабсорбцією кобаламіну не страждають на анемію і не мають інших ознак мегалобластної анемії, таких як макроцитоз або гіперсегментовані нейтрофіли, які іноді називають субклінічним дефіцитом. Однак може бути розумно доповнити цих людей вітаміном B12, оскільки може бути незрозуміло, чи пов'язані незначні симптоми з дефіцитом, доки він не буде усунутий.
Повідомлялося, що інфекція, спричинена вірусом імунодефіциту людини (ВІЛ), пов'язана з високою поширеністю дефіциту вітаміну В12 (повідомлялося, що він сягав 10-39 відсотків в епоху з 1980-х до 1990-х років). Вважалося, що цей зв'язок викликаний ВІЛ-асоційованою ентеропатією з діареєю та дисфункцією клубової кишки, а також поганим харчовим статусом. Це явище зменшилося з більш ефективним лікуванням ВІЛ-інфекції й більше не вважається клінічно важливою проблемою для більшості пацієнтів, які потребують ефективного лікування.
Резекція шлунка/баріатрична хірургія та гастрит.Резекція шлунка, баріатрична хірургія та гастрит є відносно поширеними причинами дефіциту вітаміну В12. Відсутність шлункової кислоти і пепсину при цих розладах призводить до порушення вивільнення вітаміну В12 з білків їжі, а зниження вироблення внутрішнього фактора погіршує всмоктування вітаміну В12. Поширеність дефіциту вітаміну В12 після операції з приводу раку шлунка була проілюстрована в ретроспективному огляді 2013 року з Китаю та Кореї, який включав дані про 645 пацієнтів, які перенесли тотальну резекцію шлунка або дистальну субтотальну резекцію шлунка з приводу раку шлунка, і виявив, що через чотири роки після процедури у всіх пацієнтів, які перенесли тотальну резекцію шлунка, і у 16 відсотків тих, хто переніс субтотальну резекцію шлунка, розвинувся дефіцит вітаміну В12.
● Прийом добавок вітаміну B12 є рутинним (і обов'язковим) після операції на шлунку, про що говориться окремо.
● Дефіцит вітаміну В12 є досить поширеним явищем після баріатричної хірургії, що спостерігалося у 17 відсотків жінок і 10 відсотків чоловіків в одному дослідженні. Деякі хірургічні процедури можуть бути пов'язані з більшим ризиком дефіциту вітаміну В12 (відносний ризик [RR] для шлункового шунтування за методом Ру-ан-Y порівняно з рукавною резекцією шлунка, 1,86). Однак збільшення захворюваності може частково відображати вже існуючий дефіцит мікроелементів та зниження споживання калорій/поживних речовин у післяопераційному періоді.
Окремо представлений післяопераційний прийом вітаміну В12, а також прийом фолієвої кислоти та інших поживних речовин.
Роль інфекції H. pylori — роль інфекції H. pylori у виникненні дефіциту вітаміну B12 менш точно встановлена, хоча існує підтримка запропонованого механізму, за допомогою якого бактерії викликають вироблення антитіл, які перехресно реагують зі шлунковою парієтальною HK АТФазою, як обговорювалося вище.
Проспективне когортне дослідження 2000 року з Туреччини за участю 138 пацієнтів з дефіцитом вітаміну В12 та анемією, які пройшли верхню ендоскопію та гістологічне обстеження, показало, що 77 (56%) мали ознаки H. pylori. У 31 особи, для яких ерадикативна терапія H. pylori була ефективною, у всіх (100%) спостерігалося поліпшення гематокриту, середнього об'єму еритроцитарного об'єму (MCV) і рівня вітаміну B12 на чотири тижні й нормалізація цих показників на три-шість місяців без введення вітаміну B12. На противагу цьому, не спостерігалося покращення цих показників у жодного з осіб, для яких ерадикація H. pylori не була ефективною; Всі ці люди потребували введення вітаміну В12. Редактор припустив, що відповідь могла бути пов'язана з ерадикацією H. pylori або зі знищенням бактерій у тонкій кишці, які перешкоджали засвоєнню комплексу вітаміну B12-IF (тобто реакція могла бути пов'язана з механізмом, не пов'язаним з H. pylori).
Ліки/препарати (вітамін В12)
Інгібітори протонної помпи/блокатори Н2-рецепторів/антациди — Ліки, які знижують кислотність шлункового соку, можуть зменшити всмоктування вітаміну B12, оскільки шлункова кислота відіграє певну роль у дисоціації вітаміну B12 з білків їжі, що дозволяє йому зв'язувати IF. Тривале застосування частіше спричиняє клінічно значущий дефіцит вітаміну В12. Цей ефект був проілюстрований у кількох дослідженнях:
● В одному дослідженні здорові добровольці пройшли тест Шиллінга для вимірювання абсорбції вітаміну В12 до і після двох тижнів щоденної терапії інгібітором протонної помпи. Абсорбція вітаміну В12 знижувалася з 3,2 до 0,9 відсотка у тих, хто отримував омепразол у дозі 20 мг на добу, та з 3,4 до 0,4 відсотка у тих, хто отримував 40 мг на добу.
● У дослідженні випадок-контроль за участю дорослих віком 65 років і старше хронічне застосування (>1 рік) інгібітора протонної помпи або антагоніста Н2-рецепторів було пов'язане з підвищеним ризиком дефіциту вітаміну B12 (відношення шансів [OR] 4,5, 95% ДІ 1,5-13,3).
● У більш широкому дослідженні випадок-контроль дорослих, які проживають у громаді, спостерігався підвищений ризик дефіциту вітаміну В12 при хронічному застосуванні інгібітора протонної помпи або антагоніста Н2-рецепторів (ВР, 1,7 та 1,3 відповідно).
Періодичне тестування рівня вітаміну B12 є доцільним для осіб, які тривалий час приймають препарати, що пригнічують кислотність шлункового соку. Незрозумілі макроцитози та/або макроцитарна анемія у цих осіб повинні спонукати до тестування на дефіцит вітаміну В12.
Метформін — зниження всмоктування вітаміну В12 є відомим несприятливим ефектом тривалого застосування метформіну гідрохлориду (та інших бігуанідів), що вражає відносно велику частку пацієнтів (у деяких дослідженнях до 30 відсотків). Роль тривалого застосування метформіну у виникненні дефіциту вітаміну В12 була підтверджена в аналізі досліджень, в яких пацієнти з цукровим діабетом випадковим чином отримували метформін або інші препарати, а також у дослідженнях контролю випадків, в яких було показано, що ризик дефіциту вітаміну В12 корелює з більшою дозою та тривалішою тривалістю застосування метформіну. Низький рівень вітаміну В12 у сироватці крові може спостерігатися вже через 5-10 місяці після початку прийому метформіну гідрохлориду, хоча симптоматичний дефіцит частіше проявляється через 81–<> років терапії метформіном.
Механізм зниження абсорбції вітаміну В12 при застосуванні метформіну гідрохлориду пов'язаний зі зміною гомеостазу кальцію. Поглинання в кишківнику комплексу внутрішніх факторів вітаміну В12 вимагає кальцію, а добавки кальцію скасовують вплив метформіну на всмоктування вітаміну В12. Механізм полягає у зниженні всмоктування вітаміну В12 у клубовій кишці, що, як вважають, спричинене впливом метформіну на кальційзалежну дію мембран. Було висловлено припущення, що введення кальцію здатне повернути цей ефект назад. Пов'язана нейропатія викликає особливе занепокоєння, оскільки люди з діабетом вже мають підвищений ризик периферичної нейропатії через діабетичне захворювання судин.
Окремо обговорюється підхід до моніторингу та запобіганню цьому ускладненню.
Закис азоту — Закис азоту (N 2O; звеселяючий газ) може використовуватися як інгаляційний анестетик або як рекреаційний наркотик. N2O інактивує вітамін B12 і погіршує його здатність діяти як кофактор для метіонінсинтази, що, своєю чергою, призводить до зниження метаболізму одного вуглецю та впливу на синтез ДНК та реакції метилювання.
Особи, які отримували N20 може мати токсичність через інактивацію вітаміну В12, попри нормальний рівень вітаміну В12.
Використання N2O (з будь-якою метою) може спровокувати швидку появу ознак, пов'язаних з дефіцитом вітаміну В12, таких як анемія, неврологічні або психіатричні симптоми, тоді як у деяких випадках може підвищуватися рівень вітаміну В12 у сироватці крові. Найчастіше це проблема у людей з уже існуючим дефіцитом вітаміну B12 або прикордонним статусом вітаміну B12.
Цей феномен і наш підхід до запобігання несприятливим наслідкам обговорюються окремо.
Порушення, що впливають на всмоктування в тонкому кишківнику — Недостатність підшлункової залози може перешкоджати нормальному зв'язуванню вітаміну В12 з ІФ, а ряд порушень тонкої кишки може зменшувати поверхню всмоктування для комплексу вітаміну В12-ІФ; Такі організми, як бактерії або риб'ячі стрічкові черв'яки, можуть конкурувати за поглинання вітаміну B12.
Недостатність підшлункової залози — ферменти підшлункової залози необхідні для дисоціації вітаміну В12 від слинних і харчових білків і дозволу йому зв'язуватися з ІФ. Цей процес може бути порушений у осіб з недостатністю підшлункової залози або хронічним захворюванням підшлункової залози.
Запалення тонкої кишки або хірургічне втручання — ряд розладів тонкої кишки потенційно можуть перешкоджати всмоктуванню вітаміну B12 і можуть призвести до клінічно важливого дефіциту вітаміну B12, особливо якщо споживання низьке та/або якщо запаси знаходяться на межі.
До таких розладів належать:
- Надмірний бактеріальний ріст тонкої кишки.
- Запальні захворювання кишківника (ЗЗК).
- Радіаційний ентерит.
- Целіакія (особливо якщо пацієнт не дотримується безглютенової дієти).
- Лімфоми.
- Туберкульозний ілеїт.
- Амілоїдоз.
- Резекція клубової кишки з будь-якої причини (наприклад, ЗЗК, ішемія кишківник, відведення сечі).
Рівень вітаміну B12 у цих осіб контролюється періодично (наприклад, кожні шість місяців), але дані обмежені для визначення конкретного інтервалу тестування.
Риб'ячий ціп'як — зараження риб'ячим ціп'яком Dibothriocephalus latus викликає дефіцит вітаміну В12, оскільки черв'як має спорідненість до вітаміну В12 і конкурує за його всмоктування в клубовій кишці. Інфекція може виникнути в результаті вживання сирої прісноводної риби (кілька видів) або в ендемічних районах, або при завезенні ураженої риби. Діагностика, як правило, проводиться за допомогою аналізу калу.
Генетичні порушення (вітамін В12) — У рідкісних випадках дефіцит вітаміну В12 викликаний мутаціями, які впливають на один з факторів, що беруть участь в його засвоєнні або метаболізмі.
Генетичні причини дефіциту вітаміну В12 зазвичай передаються за аутосомно-рецесивним типом. Ось кілька прикладів:
● Синдром Імерслунда-Гресбека (також званий ювенільною мегалобластною анемією або спадковою мегалобластною анемією), який обумовлений біалельними мутаціями, що зачіпають один з компонентів рецептора клубової кишки до комплексу вітаміну В12-ІФ (кубілін [CUBN] або безамніонний [AMN]).
Пацієнти з синдромом Імерслунда-Гресбека, викликаним мутаціями CUBN, також мають різний ступінь протеїнурії та аномальний метаболізм вітаміну D. Вважається, що це пов'язано з тим, що кубілін відіграє важливу роль у реабсорбції відфільтрованого альбуміну з ниркових проксимальних канальців та в реабсорбції комплексу 25-гідроксивітаміну D з його зв'язуючим білком.
● Ювенільний дефіцит кобаламіну, який викликаний біалельними мутаціями, що впливають на ген IF; припущення про мутацію засновника в особин африканського походження.
● Поліморфізм генів, що кодують транскобаламіни, які транспортують вітамін В12 у кровотоці.
● Поліморфізми генів, що беруть участь у внутрішньоклітинному метаболізмі вітаміну В12.
Варто зазначити, що генетичні поліморфізми, що впливають на внутрішньоклітинний метаболізм або трафік вітаміну В12, можуть бути пов'язані з нормальним рівнем вітаміну В12 у сироватці крові та нормальним середнім об'ємом еритроцитів (MCV) у загальному аналізі крові. Уражені особи можуть мати органічну ацидемію та/або картину тромботичної мікроангіопатії з шистоцитами в мазку крові.
Причини дефіциту фолієвої кислоти
Дефіцит фолієвої кислоти став менш поширеним у Сполучених Штатах та багатьох інших країнах, багатих на ресурси, після впровадження регулярного прийому фолієвої кислоти в харчових продуктах. Однак групи населення з поганим доступом до поживної їжі або зниженим споживанням їжі все ще перебувають у групі ризику.
Недостатнє споживання з їжею — практично неможливо розвинути дефіцит фолієвої кислоти, якщо ви споживаєте різноманітну дієту, проживаючи в країні з регулярним збагаченням продуктів фолієвою кислотою. Це пов'язано з тим, що багато злаків і злаків збагачені фолієвою кислотою, і є багато інших харчових джерел.
Однак у людей, які не можуть споживати різноманітну, багату поживними речовинами дієту, може розвинутися дефіцит фолієвої кислоти. Прикладами можуть бути ті, хто дотримується обмежувальної дієти, хронічного вживання алкоголю з обмеженим харчуванням, тяжкої анорексії або зменшення перорального споживання на тлі системного захворювання. Приготування їжі руйнує більшість природних фолатів, тому люди, які споживають виключно приготовлену їжу, також можуть бути в групі ризику. Менш поширеними прикладами є ексклюзивне вигодовування немовлят козячим молоком, яке містить значно менше фолієвої кислоти, ніж коров'яче, або рідкісні генетичні дефекти.
Як зазначалося вище, запаси фолієвої кислоти в організмі відносно невеликі, і особи, які не приймають фолієву кислоту, можуть розвинути клінічні ознаки дефіциту протягом кількох місяців.
Підвищені вимоги — певні параметри, пов'язані зі швидкою проліферацією клітин, можуть викликати підвищену потребу у фолієвій кислоті. До них відносяться :
- Застосування у період вагітності або годування груддю.
- Хронічні гемолітичні анемії.
- Ексфоліативні захворювання шкіри.
- Гемодіаліз.
Ці стани пов'язані з посиленою проліферацією клітин, що призводить до підвищеної потреби у фолатах для синтезу ДНК.
Особам з хронічними гемолітичними анеміями або ексфоліативними захворюваннями шкіри, такими як важка екзема, часто щодня призначають фолієву кислоту, щоб запобігти дефіциту. Звичайна доза становить 1 мг на добу. Окремо представлений прийом фолієвої кислоти в період до зачаття, вагітності та лактації.
Порушення всмоктування в кишечнику — порушення всмоктування фолатів (або добавок фолієвої кислоти) може виникнути, якщо кишкова абсорбційна поверхня була видалена або дисфункціональна. Це може бути наслідком хірургічного втручання (наприклад, шунтування шлунка) або запальних розладів, таких як целіакія.
Ліки (фолієва кислота) — деякі ліки можуть перешкоджати метаболізму фолатів і можуть спричинити дефіцит фолатів та/або мегалобластну анемію через вплив на синтез ДНК.

Ось кілька прикладів:
● Метотрексат – метотрексат інгібує дигідрофолатредуктазу (ДГФР)
● Антибіотики – деякі антибіотики (наприклад, триметоприм, піриметамін) пригнічують DHFR
● Протисудомні засоби – деякі протисудомні препарати впливають на всмоктування фолатів та/або клітинну утилізацію
Інгібування ДГФР блокує відновлення ГЛФ до тетрагідрофолату (ТГФ), який необхідний для перетворення дезоксиуридинмонофосфату (dUMP) в дезокситимідинмонофосфат (dTMP). На додаток до інгібування DHFR, поліглутамінований метотрексат також інгібує тимідилатсинтазу (TS), таким чином впливаючи як на синтез пуринів, так і на піримідин, а також перешкоджаючи епігенетичній регуляції та клітинним реакціям на окислювальний стрес. Ці шляхи розглянуті вище.
Прийом фолієвої кислоти (або фолінієвої кислоти [лейковорин] у деяких осіб, які отримують метотрексат) обговорюється в окремих тематичних оглядах.
Генетичні порушення (фолієва кислота) — генетичні порушення, які перешкоджають всмоктуванню фолатів (наприклад, спадкова мальабсорбція фолатів) або метаболізму, зустрічаються дуже рідко. Ці аутосомно-рецесивні розлади можуть включати мутації, що впливають на протон-пов'язаний транспортер фолатів. Уражені особи можуть мати неврологічні погіршення (атаксія, судоми, когнітивний дефіцит) та імунні дефекти. Інші генетичні порушення впливають на ферменти, що беруть участь у метаболізмі фолатів, такі як дефіцит метилентетрагідрофолатредуктази та дефіцит формімінотрансферази.
Причини комбінованого дефіциту
Певні порушення всмоктування можуть бути пов'язані з комбінованим дефіцитом вітаміну В12 і фолієвої кислоти або комбінованим дефіцитом одного з цих вітамінів і заліза. Ось кілька прикладів:
- Баріатрична хірургія.
- Мальабсорбтивні стани.
- Суворо обмежені дієти.
ДЖЕРЕЛО: https://www.uptodate.com
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Середня тривалість вагітності в США менша, ...

Клінічна настанова: Рак молочної залози на ...

Генетичні асоціації ключових генів у патог ...
Роль інфекційного патогену у розвитку гіпе ...
Внутрішньоматкова рідина у жінок у постмен ...
УЗД в діагностиці та лікуванні ендометріоз ...


