Елескломол, препарат, що транспортує мідь, спрямований на мітохондрії: від відкриття до нових застосувань
Дата публікації: 31.10.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: онкологія, рак, препарат, COVID-19, мітохондрії, мідь
Мідь (Cu) відома як кофактор для кількох ферментів в аеробних організмах. Цей елемент необхідний для різноманітних біохімічних процесів, таких як ліквідація вільних радикалів, генерація мітохондріальної енергії та гомеостаз заліза. Незважаючи на свою вирішальну роль у різноманітних біохімічних процесах, дефіцит або накопичення Cu пов’язане з різними захворюваннями, включаючи рак, серцево-судинні захворювання, хворобу Вільсона (WD), хворобу Менкеса (MD) і нейродегенеративні розлади. Токсичність міді може спричинити різні проблеми, діючи через різні механізми, включаючи окисне пошкодження, модифікацію експресії генів і порушення функції мітохондрій. Надлишок міді може змінити тонкий баланс гомеостазу міді, який суворо контролюється, щоб уникнути токсичності. Примітно, що як сильне перевантаження міддю (як це спостерігається при хворобі Вільсона), так і дефіцит міді (при хворобі Менкеса) пов’язані з певними розладами. Крім того, порушення гомеостазу міді були виявлені при нейродегенеративних станах, таких як хвороба Альцгеймера, Паркінсона та Хантінгтона. Наслідки токсичності міді також поширюються на генетику, причому стійкість до токсичності міді регулюється алельними варіаціями та варіаціями експресії в багатьох генетичних сайтах. Крім того, вплив міді може викликати зміни в нейропептидах, впливаючи на сигнальні шляхи, які є вирішальними у відповіді на вплив важких металів. Таким чином, підвищений рівень міді може мати токсичний ефект через різні механізми, що призводить до різноманітних захворювань і порушень у клітинних функціях. Різні гіпотези, такі як індукція активних форм кисню (АФК), каспаза-незалежна загибель клітин, індукція апоптозу та інгібування протеасомної системи убіквітину, були запропоновані для пояснення того, чому високі рівні міді токсичні для клітин. Нещодавно купроптоз був описаний як новий шлях загибелі клітин, у якому мідь може безпосередньо зв’язуватися з білками ліпоїльованого циклу ТСА. Щоб уникнути токсичності міді, розроблено регульовану мережу білків для контролю рівня міді в клітинах шляхом транспортування, супроводу та зберігання міді. Отже, порушення мережі регулювання міді може бути фатальним. У світлі цих фактів цю стратегію можна назвати важливою стратегією боротьби з хворобами, пов’язаними з міддю.
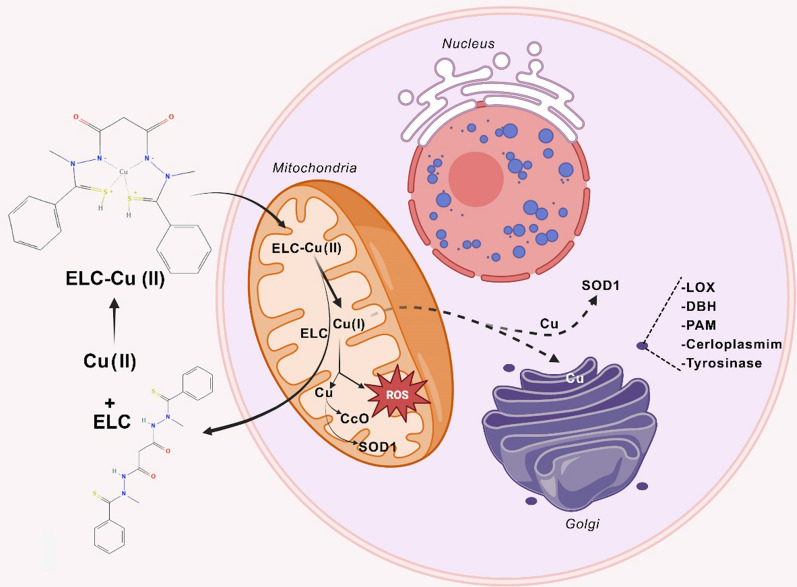
Елескломол (ELC) — це іонофор міді, націлений на мітохондрії, розроблений як хімієтерапевтичний засіб. Цей біс(тіогідразид) амід зв’язується з міддю(II) у співвідношенні 1:1 у позаклітинному середовищі, утворюючи проникний для мембрани комплекс, який може проникати та транспортувати мідь до мітохондрій. Після відновлення міді (II) мідь (I) виділяється в мітохондріях.
Відкриття ELC
Компанія Synta Pharmaceuticals представила ELC (STA-4783; N'1, N'3-methanethiol-N'1, N'3-di (phenylcarbonothioyl) malonohydrazide) 1 — як протипухлинний препарат для лікування раку молочної залози, недрібноклітинного раку легенів і саркоми. Скринінг фенотипу малих молекул використовувався, щоб виявити ELC як протираковий компонент. Відкриття ELC було розпочато скринінгом унікальної бібліотеки сполук Synta з використанням оцінки цитотоксичності та аналізів індукції HSP70 у лінії клітин раку з множинною лікарською стійкістю (MDR) (MES-SA/Dx5). Ці дослідження привели до влучної молекули, відомої як N'1, N'3-метантіол-N'1 і N'3 дифенілмалоногідразид 2. Потім сполуку 2 оптимізували на основі підходу співвідношення структура-активність (SAR) для створення ELC як нового протипухлинного агента. Сполука 2 була здатна індукувати HSP70 (EC 50 = 0,75 мкМ) і показала сильну антипроліферативну активність проти лінії ракових клітин MES-SA/Dx5 (IC 50 = 50 нМ). Однак прямий вплив повітря може легко окислити два атоми сірки сполуки 2 і, отже, інактивувати молекулу кисневими фрагментами. Метаболічно нестабільна природа сполуки 2 потребувала подальшої оптимізації.
Синтез ELC
Різні шляхи синтезу, починаючи з різних вихідних матеріалів, були запропоновані Chen та ін. для отримання похідних сполуки 2 при оптимізації свинцю.
Підбадьорені цим прогресом у синтезі ELC, Chen et al. представили зручний метод для синтезу ELC та його мідного комплексу. У порівнянні з раніше повідомленими синтетичними методами, ця процедура була придатною для поточної належної виробничої практики (cGMP) ELC. Перевагою цього шляху було споживання розчинника класу 3 (EtOAc) і легке очищення.
Механізм дії ELC: від досліджень in vitro до клінічних випробувань
ELC працює як мідний іонофор, який націлюється на мітохондрії шляхом створення комплексу з міддю (Cu) і його транспортування в мітохондрії. У мітохондріях ELC-Cu(II) відновлюється до Cu(I), що викликає утворення АФК. ELC викликає окислювальний стрес шляхом підвищення рівнів ROS за межі стійких порогів у ракових клітинах. Це досягається збільшенням продукції АФК та індукцією транскрипційного генного профілю, який відображає реакцію на окислювальний стрес. Попередні дослідження продемонстрували здатність ELC підвищувати виробництво АФК і провокувати дозозалежне інгібування активності мітохондріальної NADH-убіхіноноксидоредуктази. Підвищені рівні АФК і результуюча цитотоксичність, викликана ELC, можуть виникнути внаслідок роз’єднання мітохондріального окисного фосфорилювання та/або інгібування активності транспорту електронів. Примітно, що здатність ELC специфічно індукувати виробництво мітохондріальних АФК виділяється як відмінна властивість цієї сполуки.
Основний погляд на механізм дії ELC
Численні дослідження були проведені для з’ясування механізму протиракової дії ELC. Було виявлено, що ця молекула є стимулятором апоптозу з потужною проапоптотичною активністю. ELC також продемонстрував сильну протиракову дію проти різних пухлинних клітин, зокрема кількох ліній пухлинних клітин MDR, які були стійкі до таксолу (паклітакселу). Метали широко розповсюджені в природі і необхідні для багатьох аспектів біологічної діяльності. Вони необхідні як для структури, так і для активності деяких білків. Імпортери металу, експортери металу та магазини металу регулюють кількість металу, доступного в цитоплазмі. Як фізіологічні, так і патологічні процеси вимагають міді, а її неправильний метаболізм пов’язують із кількома захворюваннями, зокрема раком. Оскільки торгівля міддю переважно регулюється в ракових клітинах, було продемонстровано, що блокада торгівлі міддю шляхом фармакологічного інгібування мідних шаперонів може лікувати різні види раку. Однак через його потенційну цитотоксичність необхідно ретельно контролювати концентрацію та транспортування внутрішньоклітинної міді. Вже практикується монотерапія ELC та її поєднання з іншими протипухлинними засобами. Вільна кислотна форма ELC діє як активна речовина і зв'язується з іонами міді (Cu 2+), які присутні в сироватці крові. На відміну від вільного ELC, цей комплекс ефективно адсорбується раковими клітинами. Мідь, присутня в комплексі, піддається реакції відновлення (Cu(II) до Cu(I)) всередині клітини, що призводить до порушення окисного фосфорилювання в мітохондріях, де вона може викликати окислювальний стрес через накопичення АФК.
Повідомлялося, що ELC пригнічує проліферацію пухлинних клітин у клітинах MCF-7, SK-MEL-5 і HL-60 зі значеннями IC 50 110, 24 і 9 нМ відповідно. Було також показано, що ELC може індукувати апоптоз пухлинних клітин через виробництво АФК у різних типах ракових клітин. Результати in vitro показали, що ELC може регулювати рівні експресії відповіді на стрес теплового шоку та генів металотіонеїну; наприклад, ELC (100 нМ) підвищував рівні транскриптів HSP70 В-клітин лімфоми Рамоса Беркітта залежно від часу.
Посилення метаболізму в ракових клітинах призводить до підвищення рівня супероксиду та АФК у мітохондріях. Утворений перекис водню та підвищення рівня АФК можуть призвести до агресивного росту пухлини. Порушення рівноважної концентрації АФК відоме як ефективна протипухлинна стратегія, а підвищені рівні ROS можуть знизити антиоксидантну активність ракових клітин порівняно з нормальними клітинами. Дихальні ланцюгові реакції мітохондрій вважаються основним джерелом АФК. ELC частково надає свій ефект, порушуючи мітохондріальний метаболізм ракових клітин, щоб викликати апоптоз. Мітохондрії як багатообіцяюча мішень для хімієтерапії раку значною мірою сприяють загибелі та виживанню клітин. Вони діють як критичний компонент окисно-відновного контролю в ракових клітинах і є основним виробником енергії [аденозинтрифосфату (АТФ)] і АФК у клітинах. Використання антиоксидантів N-ацетилцистеїну (NAC) і попередньої обробки може повністю блокувати ELC-опосередковане підвищення апоптозу через індукцію окисного стресу. Ця властивість є доказом проапоптотичної активності ELC через генерацію ROS.
Купроптоз, новий відкритий механізм загибелі клітин для ELC
Іони важких металів є важливими мікроелементами, і їх недостатність або надмірна кількість може спровокувати загибель клітин. Була виявлена нова форма регульованої клітинної смерті (RCD), відома як «купроптоз», яка відрізняється від клітинної смерті, пов’язаної з окислювальним стресом. У недавньому дослідженні Tsvetkov et al. представили купроптоз як залежний від міді неапоптозний шлях загибелі клітин. У цьому окремому шляху мідь безпосередньо зв’язується з ліпоїльованими компонентами циклу трикарбонової кислоти (TCA). Подальша агрегація цих зв’язаних міддю білків і руйнування білків Fe-S викликають протеотоксичний стрес і призводять до купроптозу. Іншими словами, надлишок міді може спричинити загибель клітин шляхом зв’язування з ліпоїльованими компонентами циклу ТСА, що призводить до агрегації білка та протеотоксичного стресу. Ці факти можуть пояснити потребу в стародавніх мідних гомеостатичних механізмах. Дослідження, проведене Чу та його колегами, дає часткове уявлення про подальше розуміння молекулярних механізмів купроптозу при світлоклітинному нирково-клітинному раку (ccRCC) і може бути корисним для розробки персоналізованих терапевтичних стратегій, націлених на мідь або купроптоз.
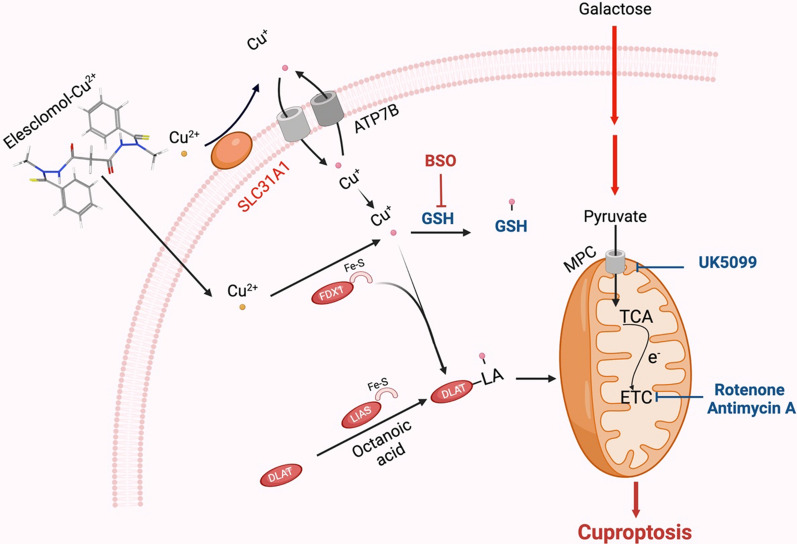
Тан та ін. досліджували, чи залежить токсичність іонофорів Cu, особливо ELC, від індукції відомих модальностей клітинної смерті. Вони виявили, що гідрофільний антиоксидант глутатіон (GSH) блокує токсичність ELC-Cu шляхом хелатування внутрішньоклітинної Cu. Було показано, що клітини, які покладаються на опосередковане галактозою мітохондріальне дихання, більш чутливі до пригнічення росту, викликаного ELC-Cu, ніж клітини, які покладаються на індукований глюкозою гліколіз. Крім того, гіпоксія (1% O2) знижувала чутливість до купроптозу. Автори ідентифікували два шляхи мітохондріального протеотоксичного стресу, які опосередковують купроптоз, використовуючи повногеномний нокаут-скринінг CRISPR/Cas9 у поєднанні з метаболічними та біохімічними аналізами. Cu посилює ліпоїлювання мітохондріального білка, що сприяє залежній від дисульфідних зв’язків агрегації ліпоїльованого DLAT і подальшій купроптотичній загибелі клітин. Автори виявили, що надмірна експресія SLC31A1 у клітинах і виснаження GSH BSO може підвищити сприйнятливість до купроптозу. Отримані результати підтверджують уявлення про те, що мітохондрії є багатогранними регуляторами загибелі клітин, включаючи загибель клітин, спричинену міддю. Це також кидає виклик загальноприйнятій точці зору, що окислювальний стрес є фундаментальним молекулярним механізмом індукованої металами токсичності. Процес і наслідки купроптозної загибелі заслуговують на подальші дослідження.
ELC і фероптоз
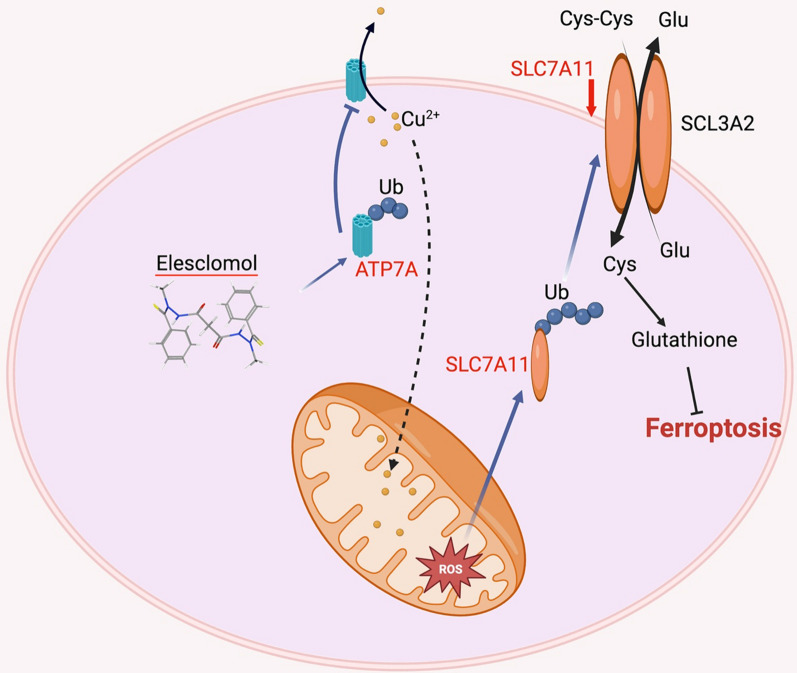
ELC перевершив деякі інші хелатори міді в боротьбі з окислювальним стресом, викликаним перекисом водню, і ефективно пригнічував ріст клітин колоректального раку. Ця цитопротекторна властивість міді може бути пов’язана з антиоксидантною роллю супероксиддисмутази 1. ELC індукує значну загибель клітин колоректального раку (CRC) у присутності екзогенної міді, яка може бути частково відновлена введенням N-ацетил-L- цистеїн. Проте жодного очевидного пошкодження ДНК або розщепленої каспази-3 не було виявлено. Це спостереження вказує на те, що загибель клітин, викликана ELC, може бути не внаслідок апоптозу. Лікування ELC не мало явної токсичності для кількох інших нормальних органів мишачої моделі з підшкірним ксенотрансплантатом і пригнічувало ріст колоректальної пухлини. ELC зменшувала концентрацію міді в середовищах, одночасно збільшуючи концентрацію в цитоплазмі та мітохондріях. Це означає, що ELC транспортує мідь із середовища в мітохондрії. Крім того, ELC знижує експресію ATP7A та ATP7B (АТФ-аза 1, що транспортує мідь), які необхідні для утримування міді та протипухлинних ефектів ELC. Декілька наборів даних показали, що ATP7A має надмірну експресію у пацієнтів з КРР і корелює з поганою загальною виживаністю та виживаністю без прогресування порівняно з нормальними тканинами.
ELC знижує регуляцію ATP7A шляхом деградації білка, про що свідчить той факт, що використання інгібіторів протеасом (таких як MG132) може запобігти ELC спричиненню падіння рівня білка ATP7A. Ймовірні важливі елементи, які, як припускали, беруть участь у деградації ATP7A, були досліджені для кращого вивчення процесів, що лежать в основі індукованої ELC деградації ATP7A. Було припущено, що Cav-1 (Caveolin-1) може не бути залученим до ELC-індукованої деградації ATP7A в клітинах CRC. SLC7A11 (сімейство носіїв розчину 7, член 11) надмірно експресується в злоякісних тканинах порівняно з нормальними тканинами, і ця надмірна експресія також пов’язана з метастатичним рецидивом КРР, згідно з аналізом різних наборів даних. ELC викликає розпад ATP7A та SLC7A11, тоді як точні механізми залишаються неясними. ELC скасував надмірну експресію екзогенних ATP7A та SLC7A11 у клітинах CRC. Повідомлялося, що ATP7A контролює окислювальний стрес, запобігаючи виходу міді з клітин. Це запобігає виробленню АФК і пригнічує деградацію SLC7A11, що збільшує окислювальний стрес, спричинений ELC. CRC також може бути пригнічений ELC-опосередкованою деградацією ATP7A, який є білком із надмірною експресією, коли ELC і мідь використовуються разом як терапія. Крім того, було досліджено вплив різних хелаторів міді на експресію ATP7A. Було виявлено, що ELC, але не інші хелатори міді, активують деградацію ATP7A, що спричиняє утримання міді в клітинах і викликає фероптоз у клітинах CRC.
ELC вперше був використаний для лікування недрібноклітинного раку легенів, меланоми та саркоми як промотор апоптозу. Було продемонстровано, що він порушує цитоскелет пухлинних клітин, підвищує цитотоксичність і затримує виживання без росту. ELC збільшує ROS, що пригнічує розвиток клітин раку легенів, стійких до цисплатину, і викликає окислювальний стрес у клітинах меланоми та лейкемії. Згідно з дослідженням Гао та ін., ELC викликає ферроптоз у клітинах колоректального раку, але не апоптоз. Хоча було встановлено, що мідь і нікель можуть захистити клітини нейронів від фероптозу, зазвичай вважають, що це пов’язана з залізом модель загибелі клітин. Завдяки взаємодії між міддю та залізом або контролюючи виробництво АФК у клітинах, мідь може контролювати фероптоз. Ферроптоз, опосередкований міддю, в основному пояснюється гідропероксидом ліпідів, який може бути індукований реакцією Фентона, що робить комплекси міді та хелатори міді потенційними протираковими агентами.
Було показано, що CTR1 не бере участі в анти-CRC функції ELC і деградація ATP7A є передумовою для накопичення АФК і фероптозу в клітинах CRC. ATP7A як транспортер міді відіграє певну роль у розвитку пухлин і стійкості раку до лікування. Порівняно з чутливою до цисплатину тканиною недрібноклітинного раку легенів ATP7A надмірно експресується в тканинах недрібноклітинного раку легені, стійких до цисплатину. ELC знижує експресію ATP7A та SLC7A11 у клітинах CRC, а також захищає SLC7A11 від деградації, що збільшує окислювальний стрес і призводить до фероптозу. Не встановлено, чи є ATP7A специфічною мішенню ELC. Було показано, що ELC розщеплює ATP7A шляхом запобігання відтоку міді, хоча це не має очевидного впливу на експресію Cav-1. Таким чином, ідентифікація лігази E3 для ATP7A сприятиме кращому розумінню цього процесу.
Клінічні випробування ELC
Було проведено кілька клінічних випробувань ELC та інтерпретовано на основі старої концепції механізму дії цього препарату. Було б вражаюче, якби результати були переглянуті та обговорені на основі купроптозу. Крім того, дизайн і проведення нових клінічних випробувань, заснованих на новій точці зору, вражають і цінуються. Однак наступні випробування вказуються на основі старої точки зору. Клінічні дослідження фази I за участю пацієнтів з рефрактерними солідними пухлинами показали, що одночасне лікування ELC і паклітакселом добре переносилося. Ця комбінована терапія показала профіль токсичності, що спостерігається при монотерапії паклітакселом. У фазі II клінічного дослідження з подвійним сліпим (рандомізованим і контрольованим) дизайном у пацієнтів з метастатичною меланомою IV стадії застосування комбінації ELC-Taxol призвело до подовженої виживаності без прогресування порівняно з лікуванням тільки таксолом. Крім того, ефекти ELC у поєднанні з паклітакселом досліджувалися у пацієнтів, які страждають від метастатичної меланоми, у рамках комплексного клінічного дослідження III фази. Отримані результати показали, що у пацієнтів з підвищеним рівнем лактатдегідрогенази (ЛДГ) смертність була підвищена, тоді як виживаність без прогресування була значно покращена у 68% населення з нормальним рівнем ЛДГ. ЛДГ перетворює піруват на лактат, який підвищується в пухлинах через гліколіз для виробництва енергії. Високий рівень ЛДГ у кровотоці виявляється, коли основний механізм енергетичного обміну змінюється з мітохондріального дихання (за допомогою ETC) на гліколіз. Відповідно до результатів фази III клінічного дослідження метастатичної меланоми спостережувана залежність від ЛДГ свідчить про те, що ELC є ефективним засобом для лікування пухлин із високим мітохондріальним диханням.
Застосування ELC
Хелатоутворювачі міді продемонстрували багатообіцяючий потенціал для лікування захворювань, пов’язаних із міддю, включаючи такі захворювання, як рак, туберкульоз та інфекція SARS-CoV-2. Ці засоби ефективно стримують накопичення міді в тканинах організму і крові. Таким чином, мідь-хелати можуть перешкоджати запаленню та зменшувати вплив опосередкованих міддю АФК. Примітно, що клінічні випробування оцінювали мідь-хелатирующую терапію для захворювань, які відзначаються надмірним підвищенням рівня міді, включаючи рак. У сфері лікування раку координаційні комплекси міді були представлені як перспективні терапевтичні засоби, хоча деякі нещодавні досягнення підкреслюють їх роль як агентів з протираковими властивостями.
Крім того, було повідомлено, що ELC може значно підвищити ефективність терапевтичних агентів при кількох захворюваннях, таких як рак, хвороба Менкеса, саркома Юінга, туберкульоз і утворення гіпертрофічного рубця.
Раки
ELC продемонстрував багатообіцяючі результати проти раку в деяких клінічних випробуваннях, тоді як в деяких інших він був не зовсім успішним. У старій точці зору, ELC був індуктором окисного стресу для придушення раку. Однак нещодавно його назвали індуктором купроптозу (нової форми загибелі клітин). Мітохондріальний метаболізм, який бере участь у стійкості до ліків і виживанні ракових клітин, може бути спонтанно посилений при різних видах раку, включаючи лейкемію, рак молочної залози та меланому. Характеристика посиленого метаболізму є підходящою умовою для ELC для зменшення резервної місткості дихання шляхом інгібування компонентів циклу TCA. Хоча не всі ракові клітини та пацієнти є чутливими, стовбурові ракові клітини, стійкі до ліків ракові клітини, ракові клітини з нижчою гліколітичною активністю та онкологічні пацієнти з низьким рівнем ЛДГ у сироватці чутливі до ELC. У цих ракових клітинах і пацієнтів спостерігався посилений мітохондріальний метаболізм. ELC показав вищу ефективність порівняно з традиційними хімієтерапевтичними препаратами в певних контекстах. У контексті колоректального раку (CRC) хелатування міді, викликане ELC, пригнічує CRC, націлюючись на ATP7A та регулюючи фероптоз. У контексті раку молочної залози та яєчників із мутацією BRCA1 ELC продемонстрував селективну чутливість до ракових клітин із мутантним BRCA1 та продемонстрував синергічний ефект у поєднанні з агентами, що пошкоджують ДНК, або інгібіторами PARP. У контексті захворювань метаболізму міді ELC може відновити внутрішньоклітинний гомеостаз міді та може мати потенціал для лікування захворювань людини, пов’язаних з метаболізмом міді. Однак важливо зазначити, що ефективність ELC може відрізнятися залежно від конкретного типу раку та генетичних мутаці
Рак легенів
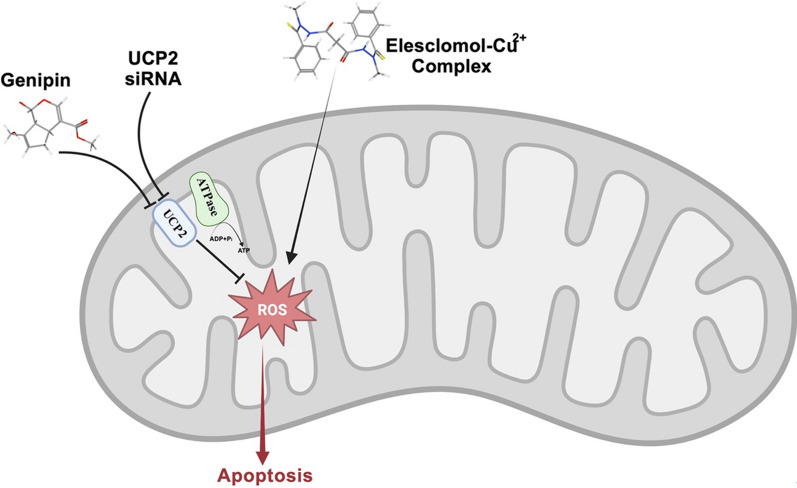
Рак легенів є найпоширенішим видом раку в усьому світі, який виникає через численні генетичні мутації. Найбільш поширені генетичні зміни у пацієнтів з аденокарциномою відбуваються в KRAS. Для лікування цих випадків все ще потрібні індивідуальна медицина та цільова терапія. Албайрак та ін. досліджували вплив ELC на Calu-1 і A549 (як лінії мутантних клітин KRAS) шляхом оцінки клітинного апоптозу, виживання та метастазування. Їх результати показали, що ELC може змінювати експресію пов’язаних з апоптозом білків (CASP-3, CASP-9, BCLXL і BCL2) і пригнічувати метастатичні білки (віментин, Е-кадгерин, MMP-2 і MMP-9) в обох типах клітин. Результати аналізу загоєння ран показали, що ELC також був ефективним щодо міграції клітин. Було показано, що він індукує загальний окислювальний статус (TOS) і малоновий діальдегід (MDA) у клітинах Calu-1. Вже повідомлялося про резистентність клітин раку легенів до цисплатину, в якій діють метаболічне перепрограмування та трансформація метаболізму гліколізу в мітохондріальний. Wangpaichitr та ін. використовували ELC для вибіркового подолання клітин раку легенів, стійких до цисплатину. Вони мали на меті підвищити рівні ROS для лікування пацієнтів, у яких терапія цисплатином виявилася невдалою. Ця стратегія була корисною завдяки високим базальним рівням АФК у резистентних клітинах порівняно з нормальними клітинами. Таким чином, збільшення ROS мало токсичний вплив на клітини, стійкі до цисплатину, зберігаючи нормальні клітини. Застосування N-ацетилцистеїну (NAC) (нейтралізатора АФК) усунуло цитотоксичну дію ELC. Це дослідження підтверджує, що спостережувана токсичність пояснюється збільшенням АФК. Роз’єднуючий білок-2 (UCP2) може обмежити цитотоксичність, спричинену ELC, шляхом ослаблення відповідей ROS. Після впливу ELC поглинання глюкози, виробництво АФК і виживання клітин раку легенів A549 з високою експресією UCP2 були частковими. Однак, використовуючи нокдаун UCP2 або геніпін (блокуючий агент UCP2), поглинання глюкози та виробництво АФК були підвищені. Таким чином, можна зробити висновок, що спільне лікування ELC з геніпіном при раку з високим рівнем експресії UCP2 можна вважати ефективною терапевтичною стратегією. У цьому контексті Lee et al. оцінили наслідки цієї спільної обробки для клітин A549. Їхні результати показали зниження поглинання глюкози та підвищену клітинну та мітохондріальну генерацію ROS. Вони також виявили знижену колонієутворюючу здатність, виживання клітин і потенціал мітохондріальної мембрани. Крім того, індукція апоптозу була підтверджена аналізом аннексину V, і спостерігалося підвищене розщеплення білка PARP і каспазою-3. Дослідження in vivo з використанням мишачої моделі ксенотрансплантата A549 показало помітне пригнічення росту пухлини в групі спільного лікування ELC і геніпіну порівняно з контрольною групою та групами монотерапії (з ELC або геніпіном).
Нещодавнє дослідження показало, що ABC1 (клітина аденокарциноми раку легенів людини) є чутливою до ELC клітиною, в якій ELC індукує купроптоз і посилює метаболіти, пов’язані з TCA (глутамін, α-кетоглутарат, сукцинат, лимонна кислота, цис-аконітат і седогептулоза 7). -фосфат). Однак обробка клітин A549 ELC не призвела до змін метаболітів, пов'язаних з TCA. Базальне дихання та виробництво АТФ не зазнавали впливу ELC. Таким чином, можна зробити висновок, що хоча ланцюг транспортування електронів безпосередньо не інгібується ELC, білки циклу ТСА беруть участь у цьому нещодавно відкритому механізмі загибелі клітини.
Рак молочної залози
Рак молочної залози є одним з тих видів раку, які сильно залежать від мітохондріального метаболізму та демонструють спонтанне посилення мітохондріального метаболізму. Аллі та Форд показали, що лікування ELC може бути корисним для BRCA1-мутованого та/або базальноподібного раку молочної залози. Ці види раку молочної залози частково нечутливі до існуючих схем «цільової» терапії. ELC підвищує рівень ROS до рівня життєздатності, що, своєю чергою, антагонізує клітинну відповідь на окислювальний стрес і запускає апоптоз. Крім того, ELC пригнічує ріст епітеліальних клітин раку молочної залози людини, не впливаючи на нормальні клітини молочної залози, і покращує апоптотичні ефекти хімієтерапевтичних препаратів, таких як доксорубіцин або паклітаксел. Ці функції були результатом підвищених рівнів розщепленої каспази-3, P27Kip1 і P21Cip1 і зниження рівня активності NF-κB. ELC активує мітоген-активовану протеїнкіназу P38 і N-кінцеву кіназу c-Jun (JNK). Активований JNK1 відповідає за індукцію апоптозу. ELC також індукує передачу сигналів виживання AKT/HSP70. Пригнічення активації AKT за допомогою інгібітора малої молекули посилює апоптоз, викликаний ELC, через клітинний механізм зворотного зв’язку. Ці спостереження показують, що одночасне лікування ELC з хімієтерапевтичнми та AKT-таргетними агентами може індукувати апоптоз у клітинах раку молочної залози та може бути виправданим.
Рак яєчників
Рак яєчників також належить до тих видів раку, які сильно залежать від мітохондріального метаболізму та демонструють спонтанне посилення мітохондріального метаболізму. Отже, він може бути чутливим до ELC. Рецидиви захворювання та хімієрезистентність при раку яєчників (РЯ) є основною причиною смертності, яка пояснюється популяцією стовбурових клітин, що ініціюють пухлину (TIC). Харрінгтон та ін. проаналізували результати секвенування РНК клітин ОК, вирощених в умовах ТІЦ. Вони виявили значне збагачення генів, які сприяють АФК та шляхам окисного фосфорилювання. Для виявлення препаратів, націлених на ТІЦ, використовувалися підходи до високопродуктивного скринінгу препаратів. Відповідно до отриманих результатів для біологічної оцінки in vitro відібрано дисульфірам, ELC, бардоксолон метил і саліноміцин. ELC вдалося індукувати накопичення АФК і посилити загибель клітин. Крім того, у пацієнтів з раком маткових труб, платинорезистентним рецидивуючим раком яєчників або перитонеальним раком комбінація ELC із щотижневим застосуванням паклітакселу призвела до медіани загального виживання та виживаності без прогресування 13,3 і 3,6 місяця відповідно.
Меланома
Меланома також сильно залежить від мітохондріального метаболізму та показує спонтанне посилення мітохондріального метаболізму. Як згадувалося раніше, ELC використовувався для лікування меланоми у фазі II клінічних досліджень. Виходячи з накопичених даних, ахілловою п’ятою меланоми є генерація АФК. Внутрішня лікарська резистентність субпопуляцій клітин меланоми виникає внаслідок виживання клітин меланоми з повільним циклом. Cierlitza та ін. припустили, що ELC може подолати мультирезистентність шляхом знищення повільно циклічних субпопуляцій. Corazao-Rozas та ін. також вивчали можливі ефекти мітохондріального окислювального стресу на клітини меланоми, які були стійкі до BRAF-мутантних інгібіторів. Отримані результати показали, що ELC може вбивати клітини меланоми, резистентні до вемурафенібу, шляхом підвищення рівня АФК. Отже, комбінацію інгібування BRAF V600E та ELC можна вважати раціональною стратегією подолання лікарської резистентності при метастатичній меланомі. Порушення регуляції генерації АФК за допомогою індукторів АФК має значні переваги в лікуванні метастатичної меланоми. Тому Wong et al. оцінювали вплив одночасного лікування окислювальними препаратами (такими як аміноартемізинін артемізон) і новими пренільованими похідними піперазину з окисно-відновними або прооксидантними препаратами, такими як ELC-Cu(II) (як окисно-відновний компонент) на клітини злоякісної меланоми людини A375. Результати цієї комбінованої терапії показали зниження кількості клітин і збільшення апоптозу.
Інфекційні захворювання
Туберкульоз
Туберкульоз (ТБ) — повітряно-крапельне інфекційне захворювання, спричинене Mycobacterium tuberculosis (Mtb). Відповідно до доповіді ВООЗ, туберкульоз є другою за популярністю причиною смерті від інфекційних захворювань після COVID-19 і 13-ю причиною смерті в усьому світі, відповідальною за 1,6 мільйона смертей у 2021 році. Хоча ведуться розробки вакцини для запобігання туберкульозу ведуться, туберкульоз, встановлений мультирезистентними штамами, потребує ефективного лікування. В організмі людини Mtb живе в окислювально несприятливих умовах. Отже, окислювачі або окисно-відновні агенти можуть перешкоджати гомеостатичній регуляції. Здатність ELC утворювати окисно-відновний хелат міді спонукала Ngwane et al., щоб вивчити вплив цього протиракового препарату на Mtb. Це дослідження було вражаючим завдяки важливій ролі міді в усуненні бактеріальної інфекції у вродженій імунній системі. Вони показали, що комплекс мідь-ELC може значно збільшити окислювальний стрес у пухлинних клітинах і надавати потужний інгібуючий вплив на Mtb H37Rv при мінімальній концентрації 10 мкМ (4 мг/л). Це вказує на синергетичну взаємодію з рифампіцином і відомими протитуберкульозними препаратами (такими як ізоніазид і етамбутол) проти клінічних ізолятів MRT Mtb. Крім того, контрольоване додавання ELC міді підвищувало чутливість Mtb більш ніж у 65 разів. Отримані результати привели до перепрофілювання ELC як потенційного препарату проти Mtb.
COVID-19
Нещодавня пандемія почалася наприкінці 2019 року та запровадила провідну смертельну інфекційну хворобу (COVID-19), спричинену новим коронавірусом, тобто респіраторним синдромом коронавірус 2 (SARS-CoV-2). До 16 серпня 2023 року було зареєстровано 769 806 130 підтверджених випадків зараження людей і 6 955 497 підтверджених смертей. Ця пандемія триває, незважаючи на широкі програми вакцинації різними доступними вакцинами. Мутації та поява нових варіантів, а також проблеми з безпекою є одними з проблем, які стоять перед доступними вакцинами. Таким чином, тривають спроби створити більш ефективну вакцину і терапевтичні засоби. Ремдесивір є схваленим FDA противірусним препаратом, який, як очікується, буде активним проти нових варіантів; однак доступні обмежені дані. Нещодавно картування взаємодії між хазяїном і вірусом виявило, що ELC виявляє противірусну активність проти SARS-CoV-2. У цьому дослідженні ELC зменшив інфекцію поблизу клітин, які отримували лікування ремдесивіром, або неінфікованих клітин. Це було пов’язано з націлюванням на HSPA1A та підвищеною експресією HSP70 при інфекції SARS-CoV-2.
Інші розлади, пов'язані з міддю
Мідь є важливим мікроелементом, необхідним для функціонування багатьох ферментів. Серед цих ферментів є цитохром-с-оксидаза (CcO), яка є останнім ферментом дихального ланцюга мітохондрій. Успадковані мутації втрати функції можуть виникати в багатьох генах, включаючи ті, які кодують білки, такі як COA6 і SCO2, які відповідають за доставку міді до CcO. Ці мутації можуть призвести до зниження активності CcO та важких патологічних станів. З іншого боку, мідь має властиву токсичність через її здатність виробляти гідроксильні радикали в біологічних системах, що обмежує безпосереднє застосування міді для пацієнтів. Отже, виявлення ефективних фармакологічних агентів, що транспортують мідь, здається неминучим. Сома та ін. використовували підхід, заснований на кандидатах, для дослідження застосування ELC для лікування порушень метаболізму міді у людини. Отримані результати показали, що ELC може збільшити концентрацію міді в мітохондріях і відновити активність CcO. Цей підхід може подолати респіраторні дефекти дріжджових клітин з дефіцитом COA6. ELC відновив мідьвмісні субодиниці CcO в моделі рибок даніо з дефіцитом міді та кількох клітинах ссавців з дефіцитом міді, таких як клітини пацієнта з мутаціями SCO2. ELC може імітувати відсутні транспортери та шаперони міді для відновлення внутрішньоклітинного гомеостазу міді.
Утворення гіпертрофічного рубця
Гіпертрофічні рубці (ГР) посилюють проліферацію та зменшують апоптоз у міофібробластах. Ці клітини є основними ефекторними клітинами дермального фіброзу. ELC використовувався для стимуляції апоптозу міофібробластів як потенційні ліки проти ГР. Дослідження in vitro показали, що ELC вдалося націлити на міофібробласти та пригнічувати їх скорочувальну здатність, як виявлено за допомогою фарбування 4',6-діамідіно-2-феніліндолу та аналізу скорочення колагенового гелю відповідно. Крім того, екстремальні внутрішньоклітинні рівні білків каспази-3, АФК і цитохрому с були визначені за допомогою вестерн-блот аналізу та проточної цитометрії. Збільшення кількості апоптичних міофібробластів після лікування ELC спостерігалося за допомогою імунофлюоресцентних аналізів для α-актину гладких м’язів і TUNEL. Попереднє дослідження продемонструвало значно нижчий індекс висоти рубця в групі ELC порівняно з контрольною групою. У світлі цих спостережень ELC можна вважати кандидатом на терапевтичний підхід до захворювань, пов’язаних з міофібробластами, включаючи HS через посилення окисного стресу.
Хвороба Менкеса
У патології Менкеса, як смертельному спадковому розладі дефіциту міді, ELC супроводжував Cu до купроферментів. Мутації з втратою функції транспортера міді ATP7A призвели до багатьох патологій при хворобі Менкеса, таких як порушення виробництва енергії через порушення цитохром- с- оксидази в мітохондріях. Гатрі та ін. запропонували ELC для лікування Менкеса та пов’язаних із спадковим дефіцитом міді розладів шляхом супроводу міді до мітохондрій та підвищення рівня цитохром-с-оксидази в мозку. Їх результати показали, що ELC може запобігти пошкодженню нейродегенеративних змін і підвищити рівень виживання плямистої миші, мишачої моделі важкої хвороби Менкеса. Таким чином, ELC можна перепрофілювати як препарат для лікування цього метаболічного розладу, пов’язаного з міддю.
Виклики та обмеження
ELC показав перспективу як хімієтерапевтичний засіб, націлений на мітохондрії, для лікування раку. Однак існує кілька ключових проблем у використанні ELC як єдиного агента для терапії раку. Високі концентрації ELC можуть викликати мітохондріальну токсичність шляхом підвищення рівнів мітохондріального супероксиду та розсіювання потенціалу мітохондріальної мембрани. Крім того, ELC діє як прямий роз’єднувач окисного фосфорилювання та узагальнений інгібітор активності транспорту електронів в ізольованих мітохондріях, що може пригнічувати біоенергетичні функції. Крім того, протипухлинна активність ELC залежить від його комплексів міді, і синтез і характеристика цих комплексів можуть бути складними. Ці обмеження підкреслюють необхідність подальших досліджень та оптимізації, щоб повністю зрозуміти та подолати проблеми, пов’язані з ELC як єдиним агентом для лікування раку.
Ефективність ELC можна підвищити, поєднуючи його з іншими протираковими засобами. Крім того, ELC можна завантажувати міддю для утворення комплексів ELC-Cu, які виявляють вищу цитотоксичність порівняно з вільним препаратом. Ще одним вражаючим підходом є підвищення чутливості ракових клітин до ELC. Комбінацію препаратів можна вважати багатообіцяючою стратегією для підвищення чутливості ракових клітин до ELC. Зниження гліколітичної активності може підвищити чутливість ракових клітин до ELC. Активація або інтенсифікація мітохондріального метаболізму ракових клітин за допомогою індукованого гіпоксією фактора-1 α (HIF-1 α) і піруватдегідрогенази кінази-3 (PDK) (ядерними прилеглими клітинами-1 і дихлорацетатом (DCA)) зменшують гліколіз раку клітини. При використанні в поєднанні з DCA, ELC має синергетичну інгібіторну дію на пухлини, таким чином підвищуючи чутливість ракових клітин до ELC. Крім того, ця комбінація дає нові клінічні ідеї для використання ELC. Проте безпека та ефективність цієї комбінації потребують подальшої перевірки шляхом додаткових експериментів. Дослідження селективності ELC щодо ракових клітин є багатообіцяючим напрямком для майбутніх досліджень. Використання молекул, які потребують активації для вивільнення ELC, має значну цінність у цьому відношенні. Слід зазначити, що ракові клітини виявляють чіткий профіль у виробництві АФК порівняно з нормальними клітинами. Сприйнятливість ракових клітин до АФК підвищується при перевищенні клітинного порогового рівня. Щоб підвищити селективність ELC щодо ракових клітин, можна використовувати молекули, активовані чутливістю ракових клітин до ROS. Цей підхід може призвести до більш розбірливої стратегії, яка пом’якшує типові побічні ефекти, пов’язані зі сполуками, що зв’язують метали. Крім того, використання цільових систем доставки в поєднанні з вищезгаданим підходом має великі перспективи. Цитотоксичність ELC у різних клітинах ссавців вимагає подальших досліджень. Певні дослідження показують, що цитотоксичність ELC є вибірковою щодо ракових клітин. Мононуклеари периферичної крові (PBMC) у людини залишаються незмінними при концентраціях, які мають значний ефект знищення ракових клітин. Крім того, було виявлено, що ELC не здатний індукувати збагачення іонами міді в PBMC. З усім тим, деякі дослідження показали, що нормальні клітини ссавців відчувають певний вплив на функцію мітохондрій в результаті впливу ELC. Наприклад, виявлено, що обробка клітин CV-1 понад 40 мкМ ELC збільшує виробництво АФК у мітохондріях, одночасно значно знижуючи потенціал мітохондріальної мембрани. Згідно з наявними звітами, майже тисяча пацієнтів отримували високі дози ELC у клінічних випробуваннях. Сприятлива переносимість ELC пацієнтами є спільною ознакою цих клінічних випробувань. Наприклад, фаза I дослідження показала, що пацієнти з солідними пухлинами можуть переносити до 438 мг/м 2ELC. Не було задокументовано випадків, коли пацієнти мали органічні або функціональні порушення, пов’язані з ELC. Таким чином, лікування ELC має похвальний профіль безпеки, однак безпека ELC заслуговує додаткового вивчення.
Враховуючи проблеми, висвітлені вище, конвергенція штучного інтелекту (ШІ) і наноонкології постає як перспективний підхід наступного покоління. Це пов’язано зі значною здатністю штучного інтелекту швидко аналізувати різноманітні фактори, пов’язані як з пацієнтами, так і з платформами нанокандидатів. Більш детально, алгоритми штучного інтелекту можуть допомогти в оптимізації характеристик наночастинок відповідно до мікрооточення пухлини (TME). Крім того, вони можуть передбачати взаємодію між наночастинками та імунною системою, долаючи таким чином біологічні перешкоди, прогнозуючи прогресування раку, оцінюючи фармакологічні профілі та підвищуючи чутливість до точної медичної терапії.
Хоча шлях подолання обмеженого трансляційного успіху наночастинок у клінічній терапії може бути тривалим, очікується, що траєкторія наноонкології революціонізує ландшафт лікування раку. Це трансформаційне зусилля ґрунтується на головній меті наномедицини раку: підвищити виживаність пацієнтів. Очікується, що незабаром це оптимістичне прагнення здійсниться.
Обнадійливий профіль безпеки ELC, який спостерігається під час клінічних випробувань, підкреслює його потенціал як терапевтичного засобу. Однак продовження досліджень має вирішальне значення для повного розуміння його безпеки, особливо при тривалих схемах лікування. Крім того, інтеграція передових технологій, таких як штучний інтелект і наноонкологія, відкриває чудові можливості. ШІ може керувати розробкою терапії на основі ELC, прогнозувати взаємодію в мікрооточенні пухлини та оптимізувати стратегії лікування для персоналізованої медицини.
Зрештою, подолання обмежень ELC як окремого агента вимагає цілісного підходу, який поєднує в собі терапевтичні інновації, передові технології та глибоке розуміння біології раку. Використовуючи ці стратегії, можна вдосконалити перетворення ELC в ефективну клінічну терапію, сприяючи майбутньому лікування раку. На завершення, використання передових методологій, включаючи обчислювальні методи, інструменти біоінформатики, відповідні моделі тварин і точно налаштовані стратегії лікування, обіцяє створення ефективної моделі, зосередженої навколо наноносіїв для перспективної терапії раку з використанням ELC.
Висновок і перспектива
ELC є унікальним агентом, націленим на мітохондрії, який індукує окислювальний стрес і генерує АФК понад стійкі рівні в ракових клітинах. Таким чином, це може викликати селективну смерть клітин. У недавньому дослідженні купроптоз був виявлений і названий новим механізмом загибелі клітин для ELC. У цьому огляді було підсумовано відкриття, синтез, механізм дії та клінічне застосування ELC та його комплексів. Основні клінічні застосування, представлені для ELC, такі: (I) використовується як модний спосіб доставки «троянського коня», він транспортує молекули міді в умовах дефіциту міді; (II) він ефективно застосовувався при різних ракових захворюваннях, стійких до багатьох лікарських засобів; і (III) він використовувався в шляхах, пов'язаних з утворенням АФК. Незважаючи на повідомлення про значні досягнення ELC, варто відзначити, що на ефективність ELC для ліквідації пухлин впливають різні фактори, якщо використовувати як один агент. Здається, що купроптоз може розв'язати питання, які залишилися з попередніх досліджень. Поєднання ELC з терапевтичними агентами також є альтернативним способом посилення його протипухлинної дії. Загалом, враховуючи селективність і ключову роль ELC, його можна вважати ефективним протираковим засобом; однак перед його належним клінічним застосуванням необхідні подальші дослідження.
ДЖЕРЕЛО: https://www.ncbi.nlm.nih.gov/
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу
Особливості перебігу гестації, пологів та ...

За даними нового дослідження, після пандем ...

Розгляньте екстрену контрацепцію для підлі ...

Гормональні контрацептиви збільшують ризик ...

Медична допомога ВІЛ-позитивним жінкам під ...

Середня тривалість вагітності в США менша, ...


