Рекомендації належної практики ESHRE щодо повторної невдачі імплантації
Дата публікації: 11.07.2023
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: Безпліддя, невиношування, ЕКЗ, ембріон, імплантація, безпліддя


Невдача імплантації — це термін, який зазвичай використовується для опису ситуації, коли ембріон хорошої якості було перенесено в порожнину матки, але не вдалося встановити вагітність, підтверджену ультразвуковою візуалізацією внутрішньоматкового гестаційного мішка (Zegers-Hochschild та ін., 2017). Оскільки це може статися у жінки більше одного разу, було додано слово «рецидивний», що призвело до появи терміну, схожого на той, який використовується для жінок, у яких було більше одного викидня. Як і у випадку з повторною втратою вагітності (ПВВ), існує відсутність узгодженості в клінічному визначенні. Більшість визначень, які зараз використовуються, базуються на кількості ембріонів, перенесених без вагітності. Однак зі зміною практики ембріотрансферу (ЕТ), а саме, від кількох до окремих ембріонів, від розщеплення до стадії бластоцисти та від неперевірених до хромосомно протестованих ембріонів, наслідки однієї невдалої процедури ЕТ змінилися (Cimadomo та ін., 2021). Однак з таким фіксованим і точним визначенням виникає кілька проблем. По-перше, визначення не враховує змінні, які впливають на індивідуальний прогноз успішного лікування на основі факторів, пов’язаних як з пацієнтом, так і з клінікою ДРТ. По-друге, концепція ПНІ як синдрому або захворювання, яке можна діагностувати та лікувати, є відкритою для оскарження. Це проілюстровано труднощами, з якими стикаються ті, хто прагне надати клінічні рекомендації в цій галузі, оскільки наявна доказова база не дозволяє зробити надійні висновки.
Робоча група ESHRE з рецидивуючої невдачі імплантації визнала, що існує потреба заново поглянути на те, як ідентифікувати, визначати та коригувати даний стан. Хоча існує доказова база для ретельного вивчення, робоча група (РГ) вважає, що в доступній літературі немає клінічних даних достатньої якості навколо узгодженого та послідовного визначення, щоб дозволити розробити дидактичні рекомендації. Проте все ще існує потреба в підтвердженому доказами документі, який би описував, що таке «належна практика» в цій складній галузі репродуктивної медицини. Цей документ має на меті задовольнити цю потребу шляхом систематичного пошуку та синтезу опублікованих досліджень на цю тему, опитування серед професіоналів щодо поточної клінічної практики в та врахування практичного досвіду обраних клініцистів та ембріологів.

Матеріали та методи
Сучасні рекомендації належної практики щодо термінології, досліджень і лікування були розроблені відповідно до посібника з розробки рекомендацій ESHRE щодо належної практики (Vermeulen та ін., 2019).
Робоча група, якій доручено розробити документ для перегляду, складалася з представників відповідних груп спеціальних інтересів (ГСІ) ESHRE, зокрема ГСІ з імплантації та ранньої вагітності, репродуктивної ендокринології та ембріології, і доповнювалася незалежним головою (НГ), експерт зі статистики (ЕзС) та підтримки пошуку літератури та управління проєктами. На перших зустрічах робоча група ESHRE з рецидивуючої невдачі імплантації обговорила теми, які необхідно розглянути, і розділила їх на підгрупи з визначеними завданнями. Прогрес у виконанні різних завдань і проблем, що виникають, обговорювали на регулярних онлайн-зустрічах.
Пошук літератури в базах даних PUBMED і Cochrane проводився за ключовими термінами «повторна репродуктивна недостатність» АБО «повторна невдача імплантації» АБО «повторна невдача імплантації». Дослідження були включені від початку до серпня 2022 року з додаванням новіших посилань, якщо вони були доступі. Усі заголовки та тези були перевірені, щоб визначити відповідні дослідження, для яких були зібрані та узагальнені повні тексти статей. У той час як пошук літератури був зосереджений на конкретних дослідженнях пацієнтів з ПНІ (визначених як такими авторами) та основних результатах живонароджуваності (ЖН), частоти вагітності (ЧВ) і побічних ефектів, розглянуто вплив на імплантацію після ДРТ у цілому.
Рекомендації щодо клінічної практики були викладені на основі досліджень, зібраних шляхом систематичного пошуку літератури, та рекомендацій в інших настановах (Coughlan та ін., 2014a; Шаулов та ін., 2020; Mascarenhas та ін., 2022; Sociedad Española de Fertilidad; Grupo de Trabajo de Fracaso ReBBoductivo), раніше проведених опитуваннях, які надають детальну інформацію про поточну клінічну практику (Cimadomo та ін., 2021), оцінках біологічного обґрунтування та експертних висновках РГ. Незважаючи на те, що робоча група знала, що для більшості досліджень або втручань можуть існувати певні групи пацієнтів, які можуть принести користь, або навіть навпаки, щоб допомогти прийняти клінічне рішення, рекомендації були позначені кольором, щоб вказати три рівні рекомендацій: зелений — рекомендовано всім пацієнтам із підозрою на ПНІ; помаранчевий — можна розглядати у пацієнтів з ПНІ; червоний — не рекомендується. Коли надається порада «не рекомендовано», це означає, що дослідження/втручання не можна пропонувати регулярно, але це не означає, що його не рекомендується використовувати за будь-яких обставин, оскільки в більшості випадків доказова база не може підтримати таке дидактичне твердження.
Хоча ключові докази були узагальнені для всіх розслідувань і втручань, виключно доказовий підхід вважався неможливим для поточної теми через відсутність узгодженості у визначенні і рідкісні прямі та високоякісні докази, доступні для більшості втручань, в тому числі ті, що вже впроваджені в клінічній практиці. Таким чином, рекомендації випливають із експертної інтерпретації наявних даних, їх біологічного обґрунтування та думки, а не лише з даних.
Зокрема, щодо визначення порогу для розгляду, було проведено вправу серед 10 членів ГСІ, які беруть участь. У вправі було представлено три випадки і слід було розглянути наслідки трьох різних порогів (70%, 60% і 50%) для сукупного успіху імплантації, що призводить до вагітності. Після отримання відгуків під час цього дослідження поріг у 60% було запропоновано та представлено як частину першого проєкту рекомендацій щодо розслідувань та втручань у ДРТ.
Перший проєкту рекомендацій щодо належної практики було надіслано на розгляд 14 ГСІ ESHRE. Було зібрано відгуки про запропоноване визначення ПНІ, критерії його ідентифікації в окремого пацієнта та про релевантність діагностичних та лікувальних варіантів. Відгуки обговорювалися на особистій зустрічі робочої групи та були прийняті за згодою в остаточний проєкт документа, який було опубліковано на вебсайт ESHRE в 2022 році для перегляду зацікавленими сторонами серед членів ESHRE. Всього було отримано 204 коментарі, які були розглянуті робочою групою та включені за погодженням. Звіт про перевірку зацікавлених сторін доступний на www.eshre.eu/guidelines.
Поточний документ дотримується раніше опублікованих визначень ДРТ, ЕКЗ, безпліддя, вагітності та живонародження (Zegers-Hochschild та ін., 2017). Швидкість імплантації визначається як кількість спостережених гестаційних мішків, поділена на кількість перенесених ембріонів (зазвичай виражається у відсотках) і переважно розраховується для процедури ET (Griesinger, 2016). Імплантація розглядається як опис прикріплення та подальшого проникнення бластоцисти в ендометрій (Zegers-Hochschild та ін., 2017). Для цілей цього документа успішна імплантація вважається досягненням ранньої вагітності (тобто виявлення бета-ХГЧ у сироватці крові або сечі, що свідчить про позитивний тест на вагітність (точні рівні будуть відрізнятися залежно від використовуваного тесту)) після процедури ET.
Визнається, що багато досліджень, які вивчають втручання, в основному розглядали ЧВ та/або ЖН. Оскільки ці результати залежать від багатьох інших факторів, які можуть виникнути після успішної імплантації, увага в цьому документі зосереджена на детермінантах імплантації, визначених вище, а не на таких, що проявляються під час живонародження. Для розгляду факторів, що спричиняють ЖН, читач може звернутися до рекомендацій ESHRE щодо повторної втрати вагітності (Група рекомендацій ESHRE щодо ЖН та ін., 2023).
У цьому документі, відповідно до опублікованих досліджень, термінологія та обговорення зосереджені на чоловіках і жінках. Робоча група ESHRE з повторної невдачі імплантації визнає, що є особи, які стикаються з непліддям, які не ідентифікують себе з термінами, що використовуються в літературі. Термінологія, яка використовується в цьому документі, не призначена для ізоляції, виключення або применшення досвіду будь-якої особи чи для дискримінації будь-якої групи.
Визначення в ДРТ: від популяції до індивіда
Робоча група ESHRE з рецидивуючої невдачі імплантації рекомендує розглядати ПНІ як вторинний феномен ДРТ, оскільки він може спостерігатися лише у пацієнтів, які проходять ЕКЗ. Щоб усунути неоднозначність у визначенні на сьогодні, рекомендується прийняти такий опис:
Описує сценарій, за якого перенесення ембріонів, які вважаються життєздатними, не призводить до позитивного тесту на вагітність у конкретної пацієнтки досить часто, щоб вимагати розгляду подальших досліджень та/або втручань.
Розгляд як окремого сценарію, обмеженого пацієнтками ICSI/ЕКЗ з різною причиною та прогнозом, потребує індивідуального підходу, який не залежить від критерію «єдиного розміру для всіх» (наприклад, фіксована кількість перенесених ембріонів), але враховує, принаймні декілька факторів, які, як відомо, впливають на шанси зачаття окремої пацієнтки. Ключем до цієї концепції є необхідність визначити, скільки ембріонів/ЕТ, як очікується, знадобиться конкретному пацієнту, щоб забезпечити «прийнятний» кумулятивний шанс успішної імплантації.
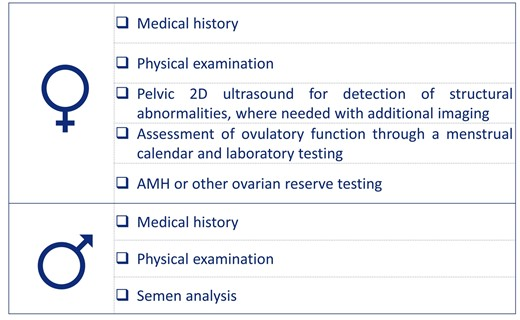
Завдання визначення як клінічної одиниці ще більше ускладнюється тим фактом, що пацієнти з ДРТ представляють гетерогенну когорту щодо показань до лікування та індивідуальних шансів завагітніти. Пацієнти, які отримують лікування, варіюються від пар із зниженою фертильністю, які, як очікується, завагітніють без лікування, якщо вони продовжуватимуть намагатися достатньо довго, до пар та осіб, які не зможуть завагітніти без ДРТ. Подібним чином, серед тих, хто проходить ДРТ, можна очікувати успіху деяких, якщо буде проведено достатню кількість циклів, тоді як інші будуть невдалими, незалежно від кількості та типів лікування; в останній групі виявлена патологія або великий біологічний вік яєчників можуть пояснити поганий прогноз. Зосередження на парах, які могли б досягти вагітності за допомогою ДРТ, передбачає, що стандартизований ряд досліджень («дослідження фертильності») вже буде завершено до початку процесу лікування та що пацієнти вважаються придатними для ДРТ і для виношування вагітності. Рекомендовані компоненти дослідження фертильності були раніше описані ESHRE (Vlaisavljevic та ін., 2021). Поточні рекомендації щодо належної практики припускають, що базове дослідження фертильності вже було проведено до початку ДРТ, але визнають, що в різних регіонах і юрисдикціях рекомендуються інші та/або додаткові обстеження (ACOG, 2019; Toth та ін., 2019). Крім того, передбачається, що процедури ДРТ виконуються повністю навченим і кваліфікованим персоналом з використанням найсучасніших технологій і процедур.
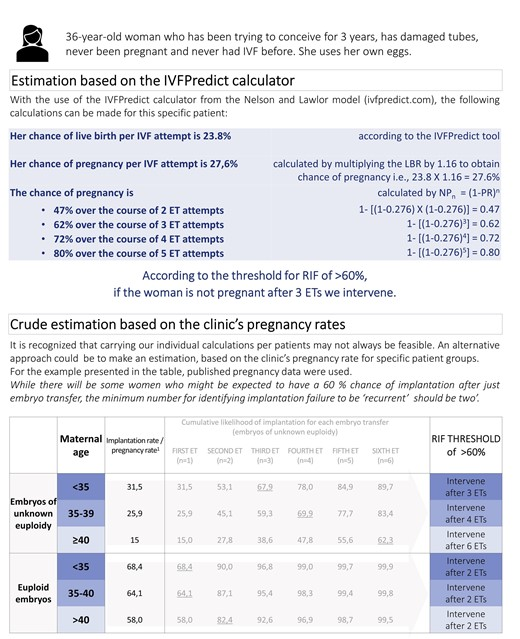
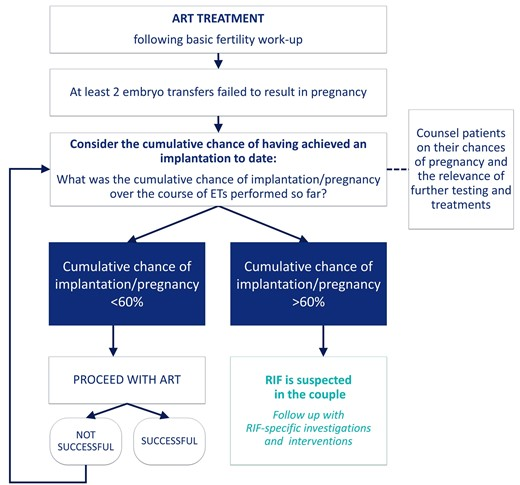
Визначення в окремої пари або пацієнта для клінічних цілей
Шанси на успішну імплантацію суттєво відрізнятимуться серед пацієнтів, які проходять ДРТ. Щоб ідентифікувати, що вказує на подальші дії у конкретної пацієнтки, необхідно визначити, який кумулятивний шанс завагітніти у неї був на цей час. Якщо він перевищує узгоджене порогове значення, але позитивного результату тесту на вагітність не було досягнуто, тоді можна вжити додаткових заходів. Пацієнткам, історія яких вказує на те, що їхні шанси завагітніти ще не досягли порогу, враховуючи їх специфічний клінічний контекст, слід порадити просто перейти до іншого циклу ДРТ. Однак у пацієнток, чия нездатність завагітніти до цього часу буде визнана як незвичайна, слід розглянути дослідження факторів, що лежать в основі. Так для ембріонів з невідомою еуплоїдією частота вагітності на перенос ембріонів (ET) для пацієнтів, які використовують власні ооцити, використовувалася з даних Європейської програми моніторингу ЕКЗ (Wyns C та ін., 2021); для еуплоїдних ембріонів частота вагітності використовувалася з опублікованих даних (Reig та ін., 2020). Заради простоти та через відсутність позитивних даних про захворюваність в існуючих дослідженнях/реєстрах імплантація та вагітність використовувалися як взаємозамінні терміни стосовно повторної невдачі імплантації.
Два фактори важливі для індивідуального підходу до ПНІ: модель, яка використовується для оцінки ймовірності імплантації/вагітності, і рівень, на якому встановлено поріг для дії.
Оцінка шансів імплантації
Імовірність успішної імплантації після ДРТ визначається багатьма факторами, включаючи, але не обмежуючись, фактори, пов’язані з жіночим організмом, такі як вік, гормональний рівень, стан ендометрія та матки та основні захворювання, пов’язані з ембріоном фактори, такі як швидкість розщеплення ембріона, еуплоїдія та попередні імплантації ембріонів-сиблінгів, чоловічих факторів, таких як генетичні розлади, і зовнішніх факторів, таких як продуктивність лабораторії та клініки, політика перенесення та правові обмеження.
В ідеалі модель прогнозування, що включає всі ці фактори, повинна використовуватися для оцінки кумулятивних шансів успішної імплантації для кількох ET, але така модель наразі недоступна. Однак опубліковані дані обсерваційних досліджень, збір даних Європейської програми моніторингу ЕКЗ (Європейський консорціум моніторингу ЕКЗ для ESHRE та ін., 2022) або власні дані центру ДРТ можуть бути використані для отримання моделі, яка може надавати вказівки. Такі моделі повинні принаймні враховувати вік матері, рівень еуплоїдії (за наявності скринінгу) та кількість перенесених ембріонів на стадії розщеплення або бластоцист.
Інший підхід полягає у використанні існуючих моделей прогнозування, розроблених для прогнозування ймовірності народження живого після першого свіжого ET (Ratna та ін., 2020; Ata та ін., 2021; Розен та ін., 2021). Як правило, у таких моделях використовується підтверджений набір факторів, які, як показано, впливають на ймовірність народження живих, і враховують вагу або важливість окремих факторів. Такі моделі прогнозування можуть забезпечити більш точні та персоналізовані оцінки успіху. Приклади включають «модель Діллона», яка враховує вік жінки, ІМТ, причину безпліддя, етнічну приналежність, попередні живонародженя, попередні викидні, кількість антральних фолікулів і тривалість безпліддя (Dhillon et al., 2016) та інструмент «IVFBBedict», отриманий на основі інформації стосовно віку жінки, тривалості безпліддя, власних ооцитів і донорських, причини безпліддя, попередніх спроб ЕКЗ, історії вагітності, ліків та ЕКЗ/ICSI (Nelson and LawlBP, 2011). Інструмент IVFBBedict пройшов зовнішню перевірку з різним успіхом (Te Velde та ін., 2014; Saha та ін., 2015; Smith та ін., 2015).
Встановлення порогу для сукупного шансу успішної імплантації, щоб сигналізувати про дію
Незалежно від моделі, яка використовується, необхідно визначити порогове значення, щоб визначити, в який момент невдача успішної імплантації вказує на «проблему», а не просто на «випадкову подію». Порогове значення керуватиме клінічним рішенням щодо того, чи слід пацієнту просто продовжити додаткову ЕТ, чи слід досліджувати фактори, що сприяють ПНІ.
Хоча деякі автори запропонували встановити цей показник на рівні 95% (Ata та ін., 2021), очевидно, що дуже небагато пацієнток матимуть такі високі шанси завагітніти після ЕКЗ, і що такий поріг буде мати обмежену користь у клінічному контексті, до якого застосовуються ці рекомендації щодо належної практики. Можливо, застосування такого суворого порогу було б корисним для дослідницьких цілей, оскільки це збагатило б групу дослідження пацієнтками, які не змогли завагітніти, незважаючи на відмінний прогноз. Хоча це справді було б так, це вимагало б від дослідницької групи серійних пересадок відомих еуплоїдних ембріонів. Оскільки метою цих рекомендацій для належної практики є надання порад щодо лікування ПНІ, ми мали на меті встановити порогове значення, яке можна застосувати до більшості клінічних ситуацій. Було погоджено, що поріг у 60% є найбільш корисним для керівництва клінічною практикою.
Обстеження для ПНІ
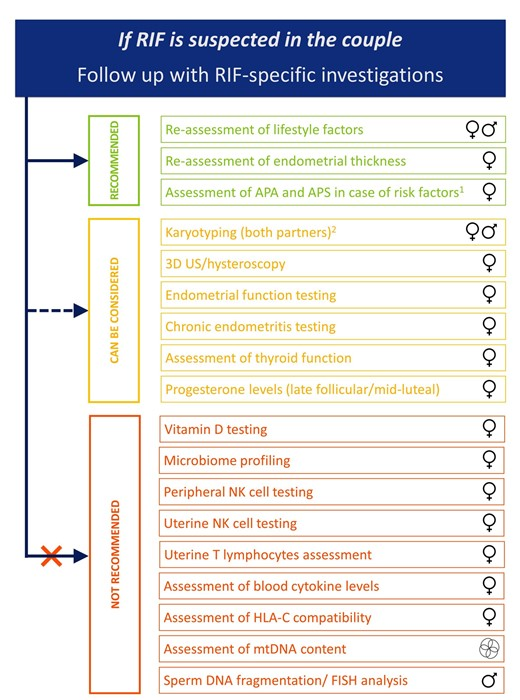
Хоча лікування ПНІ часто є емпіричним і втручання пропонуються без будь-яких спроб визначити основну причину, було запропоновано багато різних досліджень ПНІ. Визнаючи обмеження, накладені поточною доказовою базою, цей розділ має на меті забезпечити основу для допомоги клініцистам і подружнім парам у прийнятті рішень щодо обстеження.
У контексті обстеження спрямовані на виявлення сприяючих або причинних факторів. Як зазначалося раніше, передбачається, що повне обстеження фертильності перед ДРТ вже було проведено та що результати доступні для розгляду. Подібним чином припускається, що вік пацієнта, історія хвороби та лікування (наприклад, злоякісних захворювань) були враховані перед початком ДРТ.
Щоб розмістити кожне дослідження (і пов’язане з ним втручання) у контексті, надаються дані (за наявності) як про поширеність їх використання в клінічній практиці, так і про біологічне обґрунтування їх використання.
Дослідження жіночих факторів
Фактори способу життя
У великому опитуванні серед 735 клініцистів і 300 ембріологів понад дві третини клініцистів повідомили, що враховували фактори способу життя жінок, головним чином вживання ліків, куріння та ІМТ, під час лікування ПНІ (Cimadomo та ін., 2021). Дієта, стрес і споживання кофеїну були оцінені приблизно 50% клініцистів, які відповіли (Cimadomo та ін., 2021). Певні особливості способу життя, такі як куріння, вживання алкоголю або кофеїну, були пов’язані з нижчими показниками успішності ДРТ (Kinney та ін., 2007; HBPnstein, 2016; Ozbakir and Tulay, 2021). Однак, незважаючи на велику кількість досліджень, докази добре спланованих інтервенційних досліджень, які демонструють покращення результатів ДРТ після короткострокових та/або довготермінових змін способу життя, залишаються недостатніми (Freour та ін., 2018; Kermack та ін., 2020; Wang та ін., 2021).
ІМТ вважається релевантним фактором ризику невдачі ДРТ (MВРagianni та ін., 2012). Хоча більшість досліджень вказує на те, що ожиріння суттєво не впливає на якість ембріона (Bellver та ін., 2021), роль ІМТ як ооцитів не можна повністю виключити (Bellver та ін., 2010; Comstock та ін., 2015).
Незважаючи на те, що оцінка вітаміну D і його добавки широко пропонуються клініцистами (Cimadomo та ін., 2021), його роль у ДРТ залишається суперечливою: деякі дослідження виявили зв’язок сироваткових і внутрішньофолікулярних рівнів вітаміну D із частотою вагітності (Ozkan та ін., 2010; Baldini та ін., 2021), тоді як інші — не виявили (Franasiak та ін., 2015). Останні дані ставлять під сумнів точність вимірювання вітаміну D (Franasiak та ін., 2021) і, отже, здатність визначати дефіцит вітаміну D і потенційну схильність до поганих результатів ДРТ. Незважаючи на це, згідно з опублікованими настановами вимірювання та додавання вітаміну D вважається відповідним засобом і широко застосовується в клінічній практиці (Cimadomo та ін., 2021).
Виходячи з вірогідного впливу факторів способу життя на показники успішності ДРТ, робоча група розглянула можливість переоцінки цих факторів. Для вітаміну D значення вимірювання рівня крові неясно.
Хоча фактори способу життя були досліджені під час дослідження фертильності, поведінка пацієнтів може змінюватися, тому рекомендується переглянути та оптимізувати їх на момент звернення.
Скринінг на генетичні фактори: каріотипування жінки та чоловіка
Під час опитування клінічної практики 67% клініцистів повідомили, що розглядають хромосомні порушення як потенційний фактор ризику, і більшість клініцистів оцінюють як жіночий, так і чоловічий каріотипи (Cimadomo та ін., 2021). Ембріональні хромосомні порушення є основною причиною (ранньої) втрати вагітності у людей (Papas and Kutteh, 2021). Анеуплоїдні бластоцисти мають значно знижену здатність до розвитку на передімплантаційній стадії (Rubio та ін., 2007; Martín та ін., 2021) і незначний потенціал імплантації (Grati та ін., 2018; Capalbo та ін., 2022). Однак більшість ембріональних хромосомних анеуплоїдій мають мейотичне походження від матері.
Відповідно до цих спостережень дослідження типу «випадок-контроль» показали, що аномалії каріотипу частіше зустрічаються у пацієнтів із ПНІ, навіть якщо абсолютна поширеність (2,1%) є низькою (Stern та ін., 1999; Raziel та ін., 2002; De Satter та ін., 2012). Ці цифри знаходяться в діапазоні поширеності хромосомних аномалій, описаних у безплідних парах, які проходять ДРТ, коливаючись від 2,8% до 12% у чоловіків і від 3,0% до 15% у жінок (Meschede та ін., 1998). Щодо типу аномалій каріотипу в парах з ПНІ (8 жінок і 5 чоловіків), то аутосомні аномалії, аберації статевих хромосом і хромосомний мозаїцизм виявлені відповідно у 6, 2 і 1 жінки та 4, 0 і 1 чоловіки (De Sutter та ін., 2012). Внесок аномального батьківського каріотипу в схильність до хромосомних ембріональних помилок вірогідний (Insogna та ін., 2021; Юань та ін., 2021).
Анатомічні дослідження
85% клініцистів, як повідомляється, беруть до уваги анатомічні та гінекологічні дослідження при діагностиці причини ПНІ (Cimadomo та ін., 2021). Широко актуальними вважаються синдром Ашермана, гідросальпінкс, ендометріоз/аденоміоз, вади розвитку матки, атрофія ендометрію, а також міома матки. Кісти яєчників вважали актуальними 23% клініцистів. Гістероскопія є найбільш широко використовуваною технікою для анатомічних досліджень, за якою слідує 3D і 2D трансвагінальне ультразвукове дослідження (Cimadomo та ін., 2021).
Оцінка порожнини матки
Трансвагінальне УЗД вважається частиною дослідження фертильності. Враховуючи загальну діагностичну точність, яку приписують тривимірному трансвагінальному УЗД, його було запропоновано як альтернативну неінвазивну процедуру діагностики аномалій матки та підхід належної практики (Grimbizis та ін., 2016). Наразі немає досліджень, які б оцінювали, чи 3D трансвагінальне ультразвукове дослідження покращує результати у пацієнтів із ПНІ. Враховуючи обмежену вартість і неінвазивність, його можна вважати рутинним діагностичним інструментом під час дослідження фертильності, якщо він доступний. У той час як оцінка наявності аденоміозу, ендометріозу та підслизової міоми повинна бути проведена перед ДРТ, якщо є нова підозра через появу клінічних ознак або ультразвукових особливостей, помічених після ПНІ, слід розглянути можливість подальших досліджень, включаючи МРТ або діагностичну лапароскопію.
Використання гістероскопії часто пропонується, коли патологія матки була виявлена трансвагінальним УЗД і показана подальша діагностика (наприклад, підслизова міома, спайки матки). Метааналіз, зосереджений на пацієнтках з ПНІ, повідомив про значно вищий ЖН після гістероскопії порівняно з тими, хто не проходив гістероскопію (ВР 1,29; 95% ДІ 1,03–1,62; 4 дослідження; n = 2247; P = 0,046) (Cao та ін., 2018). Аналіз Cao та ін. включав велике рандомізоване контрольоване дослідження (РКД) (дослідження TROPHY), яке повідомляло про подібний рівень ЖН після ДРТ у пацієнтів з 2-4 невдачами в циклах ЕКЗ без раніше виявленої патології (n = 702) як порівняти тих, хто пройшов гістероскопію, з тими, хто перейшов до ДРТ без гістероскопії (29% проти 29%, ВР 1,0; 95% ДІ 0,79–1,25; P = 0,96) (El-Toukhy та ін., 2016). Соногістерографія є ще одним методом діагностики патології матки, але він менш добре вивчений (Negm та ін., 2012; Reda та ін., 2016).
Інші аномалії порожнини матки можна лікувати за допомогою встановлених втручань, включаючи поліпектомію ендометрію, хірургічне видалення субмукозних міом, резекцію перегородки матки або видалення внутрішньоматкових спайок. Хоча втручання встановлені для лікування симптомів, їхній вплив на вагітність або ЖН, наскільки нам відомо, не оцінювався у пацієнтів при ЕКЗ. Подібним чином не було оцінено вплив лікування аденоміозу на вагітність або ЖН у жінок при ЕКЗ.
Подібним чином не було оцінено вплив лікування аденоміозу на вагітність або ЖН у жінок при ЕКЗ.
Існує недостатня кількість досліджень, які б оцінювали гістеросальпінгографію (ГСГ) у контексті ПНІ, але ГСГ або інші засоби візуалізації фаллопієвих труб можна розглянути, якщо є сумніви щодо гідросальпінксу після УЗД.
Дослідження функції ендометрія та рецептивності
Під час анатомічних та гінекологічних досліджень для вивчення можливих причин ПНІ 59% клініцистів повідомили, що розглядають вікно імплантації (ВІ) за результатами біопсії ендометрію (Cimadomo та ін., 2021).
Однак це оцінює лише один елемент, а механізми, що лежать в основі сприйнятливості ендометрію людини, є складними. Враховуючи численні функції ендометрію, які в сукупності можна вважати «сприйнятливістю», малоймовірно, що один аналіз надасть достатню інформацію для клінічного використання. Проте з’явилися методи дослідження, які зосереджуються на конкретних аспектах функції ендометрію. Один із таких тестів передбачає аналіз панелі генів, пов’язаних зі сприйнятливістю ендометрію, з біопсії ендометрію, взятої під час передбачуваного ВІ. Транскрипцію цих генів кількісно визначають та інтерпретують, щоб повідомити про стан ендометрія як до-сприйнятливий, сприйнятливий або постсприйнятливий. Інформацію про реакцію ендометрія на вплив прогестерону можна отримати за допомогою гістологічної оцінки критеріїв Нойєса, але це виявилося занадто суб'єктивним для клінічного використання. Відтоді на ринку з’явилося кілька інших тестів на сприйнятливість ендометрія, які подібним чином зосереджені на вимірюванні дозрівання. Нещодавно комплексний поглиблений аналіз усіх транскриптомних панелей, досліджених на предмет їх зв’язку з порушенням сприйнятливості ендометрію, підтвердив гіпотезу про те, що невдача ЕТ може бути спричинена як зміщенням, так і порушенням ВІ (Koot та ін., 2016). Це означає, що тест, спрямований на оцінку лише одного аспекту, буде мати обмежену корисність (Sebastian-Leon та ін., 2018).
Метааналіз 2022 року включав 11 досліджень і повідомляв, що поширеність зміщеного ВІ, як виявлено за допомогою тестів на сприйнятливість ендометрія, становила 34% (95% ДІ 24–43%) у пацієнтів з поганим прогнозом (Liu та ін., 2022b). У пацієнток із ПНІ було виявлено порівнянну частоту триваючої вагітності (ОВВ)/ЖН між пацієнтками з діагностованим нерецептивним ендометрієм, яким проводили персоналізований ЕТ (п-ET), і пацієнтками з рецептивним ендометрієм, яким проводили рутинний ЕТ (40,7% проти 49,6%; ВР 0,94; 95% ДІ 0,70–1,26; 6 досліджень; n = 2552) (Liu та ін., 2022b). У нещодавньому багатоцентровому когортному дослідженні за участю пацієнтів з одним попереднім невдалим перенесенням ЖН та кумулятивна ЖН були вищими після неконтрольованого ET порівняно з п-ET як для аутологічної, так і для донорської підсадки (Cozzolino та ін., 2022).
Підхід зіставлення балів схильності, прийнятий для обмеження ефекту передбачуваних спотворюючих факторів, не показав значного покращення клінічних результатів після використання тесту сприйнятливості ендометрію для п-ET (Bergin та ін., 2021). Нещодавнє 5-річне багатоцентрове РКД, у якому порівнювали п-ЕТ після тестування на сприйнятливість ендометрію зі свіжим і замороженим ЕТ без тесту, показало порівняльні результати за перенесення. Лише в аналізі за протоколом повідомлялося про вищі кумулятивні ЖН у п-ET (Simón та ін., 2020).
Немає достатніх доказів на підтримку рутинного використання доступного зараз тесту на сприйнятливість ендометрія в ДРТ, і необхідні додаткові дослідження, щоб зрозуміти його цінність у виявленні та уможливленні лікування дефектів дозрівання ендометрію у жінок, які звертаються з ПНІ. Цілком можливо, що в майбутньому більш комплексна оцінка сприйнятливості ендометрію за допомогою комбінації тестів може стати в нагоді в контексті (Hernández-Vargas та ін., 2020). Тести на сприйнятливість ендометрія все більше оцінюють інші аспекти. Одним із прикладів є тест на «імунологічну активацію матки», заснований на RT-PCR аналізі ряду факторів, які вважаються залученими до диференціації секреторного ендометрію до сприйнятливого стану (Lédée та ін., 2017). Хоча цей тест ще підлягає оцінці в РКД, когортні дослідження (Lédée та ін., 2020) припустили, що він може відігравати роль у діагностичному дослідженні ендометрію при ПНІ, як і інші нові тести. На додаток, з’являється все більше доказів ролі децидуалізованого ендометрію, який діє як воротар для імплантації після порушення епітеліального шару. Розробляються нові маркери цієї функції (Muter та ін., 2021).
Дослідження хронічного ендометриту
Хронічний ендометрит (ХЕ) був описаний у пацієнтів із ПНІ із бактеріальною колонізацією, а також у жінок без клінічних ознак інфекції та може знизити частоту настання вагітності (Johnston-MacAnanny та ін., 2010; Kitaya та ін., 2014, 2019; Cicinelli та ін., 2015; Bouet та ін., 2016; Kushnir та ін., 2016; Song та ін., 2018; Li та ін., 2020; SaxtBPph та ін., 2020; Zargarta ін., 2020). Його можна діагностувати за допомогою гістероскопії, фарбування гематоксиліном і еозином і мічення CD138 (Kitaya та ін., 2014, 2019). Інші діагностичні тести на ендометрит включають хромогістероскопію (відмирання метиленового синього ендометрію під час гістероскопії), бактеріальну культуру та молекулярні методи, такі як ПЛР, ЗТ-ПЛР та секвенування наступного покоління (NGS) (Küçük and Safali, 2008; МВРеnо та ін., 2018). Нині ХЕ (та вагінальна інфекція), здається, регулярно досліджується в клінічній практиці (85% клініцистів) (Cimadomo та ін., 2021 р.), навіть якщо існують обмеження щодо гістології в цілому, відсутність стандартизації концентрації плазматичних клітин, яку слід розглядати як порогове значення (наприклад, >1 або >5 плазматичних клітин на поле високої потужності), а доступні дослідження часто включають лише невелика кількість пацієнтів або відсутність контролю.
Антибіотики можна розглянути для лікування ХЕ. Нещодавні огляди на цю тему з різними критеріями включення та збігами у включених дослідженнях повідомляли про суперечливі результати. Базуючись на даних чотирьох досліджень, один систематичний огляд повідомив про значно вищі рівні ЖН/ОВВ (ВР 5,33; 95% ДІ 2,41–11,79; I 2 = 0%) у пацієнтів із вилікуваним ХЕ (лікувалися антибіотиками) порівняно з пацієнтами з персистуючим ХЕ (Vitaliano та ін., 2022). В іншому огляді підраховано, що ЖН/ОВВ не було значно вищим у пацієнтів з із вилікуваним ХЕ (після прийому пероральних антибіотиків) порівняно з пацієнтами з персистуючим ХЕ (ВР 2,90; 95% ДІ 0,65–12,98; I 2 = 77%; 4 дослідження) (Cheng та ін., 2022). Третій огляд дійшов висновку, що пероральне лікування антибіотиками для ХЕ не покращило ВВ або ЖН (Kato та ін., 2022).
Зараз висновки щодо цінності діагностики та лікування ендометриту значно ускладнені відсутністю стандартизації. Проте обстеження та лікування ХЕ можна розглядати в ПНІ. Перегляд цієї рекомендації може знадобитися, якщо дослідження з використанням більш стандартизованих діагностичних методів, включаючи нові тести на основі ДНК, виявлять більш очевидну користь.
Повторна оцінка товщини ендометрію
У клінічній практиці 90% клініцистів вважали оцінку товщини ендометрія (ТЕМ) актуальною в дослідженнях (Cimadomo та ін., 2021). Це частково відображає легкість оцінки цього параметра.
У нещодавньому систематичному огляді та метааналізі, що досліджував зв’язок між товщиною ендометрія та ЖН у нових циклах, було зазначено, що жінки з тонким ендометрієм (ТEM < 7 мм) мали значно нижчий рівень ЖН порівняно з жінками з ТEM >7 мм (ВР 0,47; 95% ДІ 0,37–0,61) (Liao та ін., 2021). У результатах спостерігалася значна неоднорідність, але аналіз чутливості не змінив напрям ефекту. Також повідомлялося про зв’язок між ТЕМ та клінічними результатами для заморожених ЕТ та у стимульованих циклах (Nishihara та ін., 2020; Шалом-Паз та ін., 2021). У метааналізі однофакторних агрегованих даних було виявлено, що ймовірність клінічної вагітності в наступному циклі у жінок з тонким ендометрієм була значно нижчою порівняно з жінками з ТЕМ >7 мм, з позитивним і негативним прогностичним значенням 77% і 48 %, відповідно (Kasius та ін., 2014). Однак, після контролю за спотворюючими факторами, потенційний незалежний зв’язок ТЕМ з результатом лікування ДРТ був визнаний слабким (Yuan та ін., 2016; Griesinger та ін., 2018). Нещодавнє велике ретроспективне дослідження дійшло висновку, що ТЕМ під час ЕТ, здається, не передбачає ймовірності імплантації в разі перенесення еуплоїдної замороженої бластоцисти (Atata ін., 2023). Однак ТEM все ще може бути фактором у контексті, але він може бути особливо актуальним для нееуплоїдних ембріонів.
Якщо оцінено ТЕМ і задокументовано тонкий ендометрій, забезпечення достатнього впливу естрадіолу шляхом доповнення пероральної терапії пластирами або вагінальним введенням препаратів залишається основою лікування (Вартанян та ін., 2020). Внутрішньоматкова інфузія збагаченої тромбоцитами плазми була досліджена як терапія для збільшення ТEM, і деякі дослідження показали, що це втручання може бути ефективним у покращенні проліферації ендометрія (Mouanness та ін., 2021). Однак тепер було проведено небагато досліджень для оцінки його актуальності для пацієнтів з ПНІ із тонким ендометрієм. Подібним чином було запропоновано внутрішньоматкову інфузію гранулоцитарного колонієстимулюючого фактора (G-CSF) пацієнткам з ДРТ із тонким ендометрієм, і обмежені опубліковані дослідження показують суперечливі результати (Rocha та ін., 2020). Подальші дослідження повинні з’ясувати цінність цих та інших втручань після виявлення тонкого ендометрію у пацієнток з ПНІ.
Якщо ендометрій залишається тонким, незважаючи на коригування режиму підготовки ендометрію, можна розглянути можливість проведення гістероскопії, щоб виключити спайки або синдром Ашермана.
Профілювання мікробіому
Останніми роками проєкт «Мікробіом людини» підкреслив важливість мікроорганізмів та їх геномів для здоров’я та захворювань людини (Консорціум проєкт «Мікробіом людини», 2012). Майже 10% популяції бактерій, присутніх в організмі, проживає в жіночих статевих шляхах, а види Lactobacillus є частиною фізіологічної флори (MBPeno and Simon, 2019). Чи є мікробний дисбактеріоз одним із визначальних факторів невдачі імплантації, ще вивчається, але в клінічній практиці 47% клініцистів вважають його важливим фактором (Cimadomo та ін., 2021). Дослідження мікробіома в контексті лікування фертильності привертає велику увагу, і було зазначено, що воно є перспективним фактором, який потенційно піддається лікуванню, при імплантації ембріона. Невелике дослідження не продемонструвало кореляції між наявністю штамів Lactobacillus і триваючою вагітністю після аналізу наконечників ембріонального катетера (Franasiak та ін., 2016). Однак нещодавній метааналіз 6 когортних досліджень, включаючи загалом 1095 жінок, і кілька інших досліджень повідомили про зв’язок між дисбіотичною мікробіотою та погіршенням репродуктивних результатів (МВРеnо та ін., 2016, 2022; Koedooder та ін., 2019); Kyono та ін., 2019; Зінгер та ін., 2019). У дослідженні типу «випадок-контроль», у якому порівнювали конфігурацію мікроорганізмів піхви та ендометрію за допомогою секвенування гена 16S рРНК у 145 жінок з ПНІ і 21 здорової жінки з чоловічим фактором безпліддя, було виявлено нижчі рівні Lactobacillus у вагінальних зразках, але не в ендометрії пацієнток з ПНІ.
Це динамічна область дослідження, і ще потрібно вирішити кілька питань, перш ніж можна буде визначити правильне місце тестування мікробіома в контексті. До них належать оптимальні засоби оцінки мікробіому (Sola-Leyva та ін., 2021), стабільність і швидкість спонтанного вирішення несприятливого мікробіому, зміни, які можуть відбутися під час менструального циклу та лікування ЕКЗ, а також ефективність втручань, спрямованих на покращення мікробіому. Нарешті, залишається незрозумілим, чи може субоптимальний мікробіом сам по собі порушити імплантацію, чи він є маркером для якогось іншого причинного фактора.
Базуючись на наявних на цей час даних і враховуючи наявність кількох питань без відповіді щодо актуальності тестування мікробіома в контексті, профілювання мікробіома матки та вагіни наразі не рекомендується.
Метаболічні та ендокринні фактори
В опитуванні клінічної практики 82% клініцистів вважали ендокринні аспекти значущими, при цьому головна увага приділялася функції щитовидної залози (98%), гіперпролактинемії (84%), цукровому діабету (82%) та СПКЯ (60%) (Cimadomo та ін., 2021).
Функція щитовидної залози
У той час як функцію щитовидної залози можна розглядати як діагностичний тест, інші ендокринні фактори, такі як аутоімунні захворювання щитовидної залози, пролактин, рівень вільних андрогенів або діабет (HBA1C), або не розглядаються, або вважаються такими, що не мають значення в інших рекомендаціях. Однак, як видно з опитування, використання функції щитовидної залози в діагностиці ПНІ добре зарекомендувало себе в клінічній практиці (Cimadomo та ін., 2021). Нещодавні рекомендації Європейської тиреоїдної асоціації припустили, що в контексті ДРТ рівень тиреотропного гормону в сироватці крові >4 мМО/л (субклінічний гіпотиреоз) або <0,4 мМО/л (субклінічний гіпертиреоз) може розглядатися як дисфункція щитовидної залози та потребувати подальшого спостереження та лікування (Biondi та ін., 2015; Poppe та ін., 2021). Оцінку функції щитовидної залози можна розглянути під час дослідження фертильності за допомогою ДРТ або при виявленні ПНІ, але оскільки не повідомлялося про конкретну зв’язок із невдачею імплантації, оцінку зазвичай не рекомендують як дослідження для ПНІ.
Прогестерон
Останніми роками зростає інтерес до повідомлення про зв’язок між передчасним підвищенням рівня прогестерону, виміряним приблизно під час ініціювання дозрівання ооцитів, і клінічними наслідками після нового ЕТ (Venetis та ін., 2013). Хоча все ще є предметом дискусій, існує широко поширена думка, що це може призвести до асинхронності ендометрію/ембріона, що заслуговує на затримку ET до наступного циклу заморожування-розморожування (Bosch та ін., 2010; Venetis та ін., 2013). У когортному дослідженні було показано, що відкладений ЕТ у випадках передчасного підвищення рівня прогестерону відновлює рівень імплантації (Lawrenz та ін., 2018).
Іншою темою є оцінка середньо-лютеїнового рівня прогестерону для оцінки терапії екзогенним прогестероном. Кокранівський метааналіз повідомив про вищий рівень ЖН/ОВВ при застосуванні прогестерону порівняно з плацебо/без лікування для підтримки лютеїнової фази у жінок, які проходять ДРТ (ВР 1,77; 95% ДІ 1,09–2,86; I 2 = 5%; 5 РКД; n = 642) (van der Linden та ін., 2015). Відповідно до ймовірності того, що всмоктування з піхви може бути різним у жінок, з’являється все більше доказів зв’язку низького рівня прогестерону в крові в день ЕТ з гіршими результатами після свіжого ЕТ (Thomsen та ін., 2018) і після кріопереносу (Alsbjerg та ін., 2018; Лоуренц та ін., 2018). Недавнє відповідне когортне дослідження показало, що низькі рівні середнього лютеїнового прогестерону більш поширені у жінок з анамнезом ПНІ порівняно з контрольною групою (SaxtBPph та ін., 2020). У когортних дослідженнях було показано, що індивідуальне введення прогестерону відновлює частоту успішної імплантації (Álvarez та ін., 2021; Labarta та ін., 2021).
Що стосується оцінки рівня пізнього фолікулярного та середнього лютеїнового прогестерону, залишаються питання щодо достовірності опублікованих граничних рівнів для окремих центрів, оскільки аналізи можуть відрізнятися. Рекомендується місцева перевірка граничних рівнів прогестерону.
Імунологічний скринінг
Уявлення про те, що надмірна імунна відповідь матері на імплантований ембріон руйнує імплантацію, стало широко визнаним. У дослідженні клінічних практик лікування ПНІ 69% клініцистів застосовували певний імунологічний скринінг. Найбільш часто використовувані тести включали антитиреоїдні антитіла (80%) і антинуклеарні аутоантитіла (ANA) (>60%) (Cimadomo та ін., 2021). Не вистачає доказів щодо впливу ANA на результати вагітності у безплідних жінок, які проходять лікування ЕКЗ/ICSI та, відповідно, для скринінгу ANA в (Zeng та ін., 2019).
Повна оцінка біологічних основ імунологічного скринінгу при ПНІ виходить за рамки цієї статті, але нижче розглядаються підходи, які найчастіше використовуються.
Природні клітини-кілери матки та пеПНІерії
Відомо, що природні клітини-кілери матки (uNK-клітини) є ключовими гравцями на фето-материнському інтерфейсі, де вони представляють близько 70% імунних клітин (Lédée-Bataille та ін., 2004; Tuckerman та ін., 2010; Lash і Bulmer, 2011; Moffett і Colucci, 2014; Seshadri і Sunkara, 2014; Vomstein та ін., 2020). Однак, порівняно з пеПНІеричними NK-клітинами (pNK-клітинами), uNK-клітини не є цитотоксичними. Обидва типи NK-клітин діють як імуномодулятори, але демонструють різний профіль секретованих цитокінів і експресії рецепторів/генів (Tang та ін., 2011; Seshadri and Sunkara, 2014; Womstein та ін., 2020). Крім функціональних відмінностей, виміряна кількість клітин pNK і uNK не корелює в індивіда, і тому їх слід розглядати як два індивідуальних маркери (Kuon та ін., 2017; Woon та ін., 2022). Концентрації uNK-клітин зазнають величезних змін протягом менструального циклу, демонструючи гормонозалежні зміни у фенотипі та високі рівні в лютеїновій фазі, що підкреслює необхідність визначення суворих критеріїв при аналізі кількості та функцій uNK-клітин (Fraser and Zenclussen, 2022). Деякі дослідження повідомляють, що виявлення кількості uNK-клітин, що перевищує норму, пов’язане з менш сприятливим середовищем імплантації (Chen та ін., 2017; Kuon та ін., 2017; Odendaal і Quenby, 2021), а в нещодавньому систематичному огляді, включаючи вісім досліджень за участю пацієнтів із ПНІ була продемонстрована значна різниця в загальній кількості CD56+ uNK-клітин у жінок із ПНІ порівняно з контрольною групою (стандартизована середня різниця 0,49; 95% ДІ −0,01–0,98; P = 0,046; 604 жінки) (Woon та ін., 2022). Однак інші дослідження не показали асоціації клітин uNK (Donoghue та ін., 2019).) або клітин pNK (Seshadri and Sunkara, 2014; Salazar та ін., 2022).
Це може, зокрема, відображати відсутність консенсусу щодо найбільш надійних засобів кількісного визначення або оцінки розподілу uNK-клітин (наприклад, за допомогою імуногістохімії або аналізу FACS), а референсні діапазони суттєво відрізняються між дослідженнями (Lash та ін., 2016; Chen та ін., 2017; Куон та ін., 2017; Woon та ін., 2022). Також невідомо, якою мірою проста оцінка кількості uNK-клітин відображає їхню функцію в ендометрії. Функціональні тести, включаючи конституцію рецепторів (наприклад, рецептори, подібні до імуноглобуліну-кілера: KIR), можуть мати більшу клінічну цінність (Woon та ін., 2022).
Недавні дослідження додатково з’ясували роль uNK-клітин в ендометрії, в тому числі у функції біосенсора децидуалізованого ендометрію (Kong та ін., 2021). Також було припущено, що неадекватна активація uNK-клітин може бути причиною (Donoghue та ін., 2019; Alecsandru та ін., 2020), і те саме стосується pNK-клітин (Seshadri and Sunkara, 2014; Salazar та ін., 2022).
Для пацієнтів із підвищеним рівнем uNK-клітин або ознаками порушення функції були запропоновані підходи до лікування, включаючи інфузії ліпідів (Lédée та ін., 2018) і введення глюкокортикоїдів (Квенбі та ін., 2005). Незважаючи на те, що деякі когортні дослідження свідчать про вплив uNK-клітин на клінічні результати, все ще потрібні відповідні РКД цільових втручань при ПНІ. Хоча нова роль uNK-клітин свідчить про те, що вони залишаються потенційною мішенню для ефективних втручань, поки не будуть досту краще перевірені тести функції uNK-клітин і стратегії лікування, тестування NK-клітин не рекомендується.
Т-лімфоцити
Вважається, що дисбаланс CD4+ Т-лімфоцитів-хелперів, тобто Th1, Th2, Th17 і регуляторних Т-клітин (Treg), сприяє ПНІ(Ali та ін., 2018).
У невеликому дослідженні «випадок — контроль» пацієнти з ПНІ продемонстрували значне зниження в крові поліморфноядерних мієлоїдних супресорних клітин (PMN-MDSCs), мієлоїдних супресорних клітин, Tregs і продукції закису азоту PMN-MDSCs, тоді як експресія ζ-ланцюга на CD4+ T-клітинному рецепторі та CD8+ T-клітинному рецепторі була посилена (Jiang та ін., 2017). Крім того, ретроспективне дослідження повідомило про знижену ефективність блокування CD3, CD4 і CD8 у пацієнтів з ПНІ (Gao та ін., 2021). Хуан та ін. (2021) порівняли пацієнток, які завагітніли, з пацієнтками, які не змогли завагітніти, і виявили більший відсоток CD3+ лімфоцитів у групі невдачі. Однак у дослідженні Harrity та ін. відмінностей у CD4+ і CD8+ лімфоцитах у не спостерігалося. У ще одному дослідженні не спостерігалося істотних відмінностей у циркулюючих Т-лімфоцитах, хоча автори повідомили про більшу продукцію цитокінів Th1 і Th2 (Lashley та ін., 2015).
Рівень цитокінів пеПНІеричної крові
Було описано, що під час імплантації цитокіни в пеПНІеричній крові змінюють прозапальний (тип Th1) на протизапальний (тип Th2) профіль (Zhao та ін., 2021). Хоча це може означати надмірне спрощення, деякі дослідження з невеликими досліджуваними популяціями показали, що прозапальний стан зберігається у жінок з ПНІ, що може порушити імплантацію (Inagaki та ін., 2003; Liang та ін., 2015; Marron, 2019). Однак, оскільки оцінка рівня цитокінів займає багато часу та дорого коштує, вона не застосовується в клінічній практиці.
Сумісність HLA-C
Завдяки своїй генетичній мінливості та здатності зв’язуватися зі специфічними алотипами HLA класу I, KIR на клітинах uNK вважалися хорошими кандидатами для збалансування толерантності лейкоцитів матері до ембріона. Було припущено, що адекватна взаємодія між материнськими KIR та їх лігандами, молекулами HLA класу I, які експресуються клітинами екстраворсинчатого трофобласта, є вирішальною для стійкої імплантації (Díaz-Hernández та ін., 2021).
Підвищений ризик ПНІ спостерігається у жінок, які несуть алотип HLA-C2 й алель HLA-G із вставкою 14 bp (Lashley та ін., 2014). Однак той факт, що ні бластоцисти людини під час перенесення, ні синцитіотрофобласт не експресують HLA-C, і що HLA-C починає експресуватися пізніше під час плацентації, коли ендоваскулярний трофобласт починає замінювати спіральні ДРТерії (Blaschitz та ін., 2001), підвищує важливість подальших досліджень ролі HLA-C у. Крім того, його аналіз не має широкого застосування на практиці.
Скринінг на тромбофілію
Тромбофілія являє собою патологічну схильність до утворення тромбів, що може спричинити місцеве порушення судин, що може бути шкідливим для імплантації ембріона. Вони стали широко залученими як причина як ПНІ, так і ПВВ. В дослідженні клінічної практики 74% клініцистів вважали гемостатичні аспекти вартими дослідження при ПНІ, з яких 96% повідомили про проведення досліджень на синдром антифосфоліпідних антитіл (АФА), а 75% проводять скринінгові тести на спадкову тромбофілію (Cimadomo та ін., 2021).
Спадкова тромбофілія
Спадкова тромбофілія включає стани, при яких генетична мутація впливає на кількість або функцію білка на шляху згортання крові. Було показано, що це мутації в кількох генах: G1619A (фактор V Leiden), R2 H1299R (поліморфізм фактора V Leiden), A1298C (мутація ферменту метилентетрагідрофолатредуктази (MTHFR), C677T (поліморфізм MTHFR), V34L (поліморфізм фактора XIII), G20210A (мутація гена протромбіну), a/b L33P (рибосомний поліморфізм ферменту MTHFR) і 4G/5G (інгібітор активатора плазміногену-1 (PAI-1)) (Neamţu та ін., 2021).
Спадкова тромбофілія пов’язана з ранньою втратою вагітності та невдачею імплантації через порушення судинних змін, необхідних для успішної вагітності (Qublan та ін., 2006; Neamţu та ін., 2021).
Qublan та ін. (2006) повідомили про значно більше гомозиготних мутацій у факторі V Leiden і гені MTHR (C677T) у жінок, які зазнали кількох невдач ЕКЗ, порівняно з жінками з успішним першим циклом ЕКЗ і 25% у здорових фертильних контрольних груп. Coulam та ін. (2006) повідомили про вищу поширеність мутацій PAI-1 4G/5G у жінок з анамнезом невдалої імплантації після ЕКЗ-ET, ніж у контрольній групі. Азем та ін. (2004) повідомили про значно підвищену частоту спадкової тромбофілії у жінок з чотирма або більше невдалими ЕКЗ в анамнезі порівняно зі здоровими фертильними жінками (44,4% проти 18,2%; ВШ 3,6; 95% ДІ 1,25–10,6). Проте кілька досліджень показали, що частота вищезазначеної спадкової тромбофілії у жінок з ПНІ не відрізнялася від такої в контрольній групі (Vaquero та ін., 2006; Simur та ін., 2009).
Набута тромбофілія
Набута тромбофілія включає набутий дефіцит С-протеїну, S-протеїну, АФС, дефіцит антитромбіну III та медикаментозну тромбофілію. Набута тромбофілія була пов’язана із захворюваністю під час вагітності, зокрема, з ПНІ (Miyakis та ін., 2006).
Недавній огляд узагальнив дослідження, що оцінюють поширеність АФА у жінок з ПНІ (Papadimitriou та ін., 2022). ВР для наявності будь-якого типу APA становить 3,06 (95% ДІ 1,97–4,77; I 2 = 15%; 5 досліджень; n = 864) у жінок з порівняно з жінками, які мали принаймні один успішний ЕКЗ-ЕТ. У жінок, які зазнали щонайменше двох невдалих імплантацій, наявність лише антитіл проти кардіоліпіну або вовчакового антикоагулянту була пов’язана зі значним ВР відповідно 5,06 і 5,81 для порушення імплантації. Нещодавнє дослідження оцінювало поширеність АФС (що відповідає всім клінічним і лабораторним критеріям) у 185 пацієнтів з ПНІ і показало АФС лише у 2,88% пацієнтів, при цьому <5% мали АФА (Womstein та ін., 2020).
У той час як дослідження та лікування як спадкової, так і набутої тромбофілії були основним клінічним підходом до менеджменту ПНІ та ПВВ, їх роль в етіології обох цих станів стає все більш оскарженою. Відповідно до нещодавно опублікованих настанов ESHRE щодо ведення РПЛ (Група настанов ESHRE щодо ПВВ та ін., 2023), роль тестування, ймовірно, буде дуже обмеженою в контексті ПНІ і має зосереджуватися головним чином на жінках із клінічними або сімейними тромбоемболічними подіями в анамнезі. Однак, враховуючи серйозні наслідки, які АФС може мати як для матері, так і для плода, його слід виключити перед ДРТ, якщо є клінічна підозра (наприклад, ПНІ або клінічна історія артеріального чи венозного тромбозу).
Дослідження факторів, пов'язаних з ембріоном
Вміст мітохондріальної ДНК
Вміст мітохондріальної ДНК (мтДНК) в ембріонах людини було запропоновано як можливий показник життєздатності ембріона та потенціалу імплантації. Кілька досліджень досягли суперечливих результатів щодо вмісту мтДНК, який часто виражається як мітохондріальна оцінка або співвідношення кількості копій мітохондріальної/ядерної ДНК, відповідно до дня розвитку ембріона, якості ембріона, віку матері та здатності до імплантації. Що стосується клінічної значущості вмісту мтДНК або мітохондріальної оцінки для прогнозування здатності ембріона до імплантації, результати дослідження дуже суперечливі, виявляючи позитивну, негативну кореляцію або відсутність кореляції з частотою імплантації (Tan та ін., 2014; Diez-Juan et ін., 2015; Fragouli та ін., 2015, 2017; Клімчак та ін., 2018; Podolak та ін., 2022). Можна вважати, що лише екстремальні значення вмісту мтДНК можуть корелювати з клінічними результатами (Podolak та ін., 2022). Враховуючи експериментальний характер тесту, невеликий розмір вибірки та невелику кількість досліджень, необхідні подальші дослідження, щоб дійти висновку.
Інструменти на основі штучного інтелекту для оцінки якості ембріона/бластоцисти
Погана якість ембріона/бластоцисти та морфокінетичні аномалії пов’язані зі зниженою репродуктивною здатністю, також у контексті еуплоїдних ET (Shear та ін., 2020; Zhan та ін., 2020; BamfВРd та ін., 2022). Тим не менш, класифікація ембріонів сильно залежить від обмеженої (особливо міжцентрової) відтворюваності (Khosravi та ін., 2019; Cimadomo та ін., 2022; FВРdham та ін., 2022). Наразі досліджуються інструменти на основі штучного інтелекту (ШІ), які можуть стандартизувати оцінку ембріонів і підвищити її надійність у найближчі роки (Kragh and Karstoft, 2021; Riegler та ін., 2021). Зокрема, штучний інтелект може забезпечити об’єктивні визначення якості ембріона та узагальнені оцінки його впливу на невдачу/успіх імплантації, з очевидними наслідками також у визначенні ПНІ.
Подібним чином, omics-аналіз середовищ, використаних для ЕКЗ, наразі є предметом інтенсивних наукових, доклінічних та клінічних досліджень. Однак, дані все ще є попередніми, і вони не вивчалися в контексті, тому вони не можуть бути розглянуті на цей час.
Дослідження чоловічого фактора
Дослідження факторів, які можуть сприяти ПНІ у партнера-чоловіка, широко застосовується і вважається важливим майже 80% учасників опитування з клінічної практики ПНІ. Такі дослідження включають опитування про спосіб життя (наприклад, куріння, наркотики), аналіз сперми та тест на фрагментацію ДНК сперми (Cimadomo та ін., 2021).
Аналіз сперми, сперміограма, флуоресцентна гібридизація сперми in situ та фрагментація ДНК сперми
Аналіз сперми є частиною звичайного дослідження фертильності перед ДРТ (ASRM, 2015; Vlaisavljevic та ін., 2021). Відхилення в концентрації, рухливості та морфології сперматозоїдів, здається, пов’язані з нижчими показниками зачаття (Jouannet та ін., 1988; ВООЗ, 2021), а також із низьким рівнем запліднення та поганим розвитком ембріона. У дослідженні, у якому порівнювали пацієнтів із ПНІ та контрольну групу, було виявлено значно кращу рухливість і морфологію сперматозоїдів у пар із ПНІ, що вказує на недостатню надійність даних для зв’язку параметрів сперми з ПНІ (Ocal та ін., 2012).
Флуоресцентна гібридизація сперматозоїдів in situ (FISH) — це цитогенетичний клінічний діагностичний аналіз, який оцінює частоту хромосомних аномалій, що вважається корисним у консультуванні пацієнтів з ЖН із попередньою невдалою ДРТ (ВООЗ, 2021). Ретроспективне дослідження «випадок — контроль» не показало кореляції між анеуплоїдією сперми FISH і як незалежним фактором. Проте приблизно 24% чоловіків з, які мали аномальний результат FISH, мали нормозооспермію (Rodrigo та ін., 2019). Інші повідомили про аномальні результати FISH лише у 14,8% (4/27) пацієнтів з без впливу на частоту імплантації або вагітності (Sarrate та ін., 2019).
Існує кілька різних тестів на фрагментацію ДНК сперматозоїдів (SDF), і наразі немає стандартизованих методик і порогових значень для нормальних значень. Крім того, існують суперечливі дані щодо результатів тестування SDF та клінічної вагітності після ДРТ (Evenson та Wixon, 2006; Cissen та ін., 2016; Simon та ін., 2017). Недавнє велике ретроспективне когортне дослідження, яке включало 1339 жінок, які пройшли 2759 циклів ЕКЗ/ICSI, показало, що не було суттєвої різниці в ЖН на перший ET між групами SDF ≤15% та >15%: 38,2% (95% ДІ 34,5–41,9; n = 665) проти 41,9% (95% ДІ 34,2–49,7; n = 155; ВШ 1,2; 95% ДІ 0,8–1,7; P = 0,4). Подібним чином кумулятивна ЖН істотно не відрізнялася між групами з високим або низьким SDF (Hervás та ін., 2022). Хоча припускають, що SDF є фактором, що сприяє ПНІ і нез’ясованому безпліддю, даних щодо пацієнтів із ПНІ мало. Крім того, немає консенсусу щодо економічної ефективності тесту загалом або в парах з ПНІ (Minhas та ін., 2021; Hervás та ін., 2022).
Різні методи лікування були запропоновані як життєздатні варіанти для чоловіків-партнерів пацієнтів з ПНІ. До них належать покращення якості сперми, наприклад використання антиоксидантів, і методи відбору функціональних сперматозоїдів, такі як магнітно-активоване сортування клітин (MACS), інтрацитоплазматична морфологічно відібрана ін’єкція сперми та інші методи відбору сперми, а також хірургічне вилучення сперми (наприклад, екстракція сперми з яєчка (ТЕСЕ)). Однак поки що немає досліджень, які б оцінювали ці втручання в парах з ПНІ, які були б достатньо якісними для підтримки будь-яких рекомендацій.
Фактори способу життя
Ожиріння, особливо якщо воно супроводжується метаболічним синдромом, корелює з поганою якістю сперми (Ma та ін., 2019; McPherson and Tremellen, 2020; Tremellen and Pearce, 2020). Подібним чином звички способу життя чоловіків, такі як куріння, споживання великої кількості кофеїну або алкоголю та зловживання наркотиками, схоже, негативно змінюють не тільки звичайні параметри сперми, але й інші молекулярні аспекти, такі як цілісність ДНК сперми або окисно-відновний статус (Rahban and Nef, 2020).

Втручання у спосіб життя чоловіків можуть допомогти покращити певні параметри сперми, а також якість ембріонів (Velotti та ін., 2021), але такі втручання не були оцінені щодо їх впливу на ПНІ.
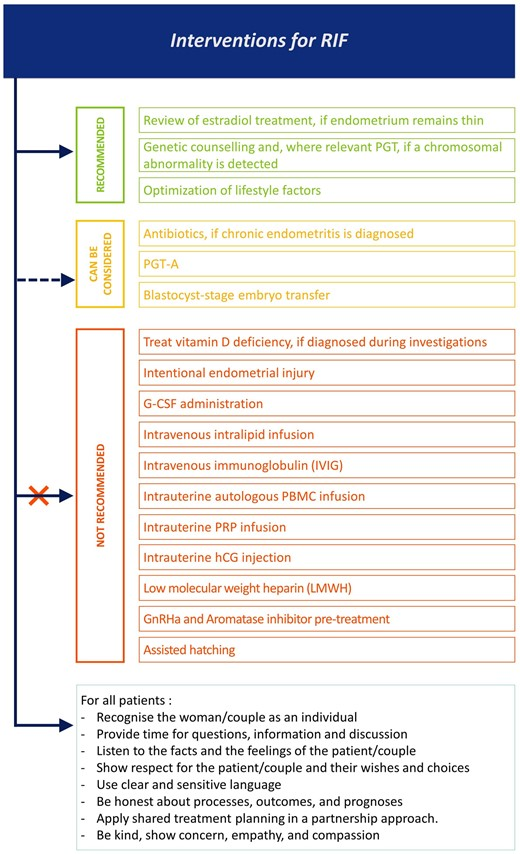
Втручання для ПНІ
Тиск на клініцистів з метою втручання у випадки ПНІ є значним і походить, частково, від очікувань від їхніх пацієнтів. Майже 80% клініцистів пропонують лікування до зачаття, а 75% пропонують додаткове лікування протягом наступного циклу ДРТ. Лікування перед зачаттям головним чином зосереджено на порадах щодо способу життя (73–97%), вітамінних добавках (83%), антиоксидантній терапії (71%) та лікуванні ендометриту (90%) та ендометріозу (80%), але скарифікацію ендометрія (57%) та імуномодулюючу терапію (46%) також пропонують. Широко практикувані втручання під час ДРТ включають персоналізовану підтримку лютеїнової фази (83%), сегментацію циклу та повне заморожування (70%) та p-ET (62%). Популярні стратегії, які застосовуються в лабораторії ДРТ, включають PGT-A (68%), допоміжний хетчинг (61%), додавання факторів росту до культуральних середовищ (27%) і сповільнену мікроскопію (40%). TESE пропонують 57% клініцистів, менше клініцистів пропонують фізіологічну ICSI (41%) або MACS (20%). Більшість втручань застосовуються емпірично і без діагностичного обґрунтування. 69% дев'ять відсотків клініцистів, які заповнили опитування, вважають донорство ооцитів або сперми цінним варіантом у менеджменті ПНІ (Cimadomo та ін., 2021).
Пропозиція значного діапазону втручань ґрунтується не на доказах ефективності, а на усвідомленій необхідності діяти. Враховуючи цю складну ситуацію, цей документ із належної практики має на меті підтримати клінічну практику, надаючи докази у підсумку найбільш релевантних досліджень. Результати цих досліджень слід інтерпретувати з обережністю з кількох причин. По-перше, застосоване визначення відрізняється, і, отже, когорта дослідження одного дослідження може суттєво відрізнятися від когорти іншого. Варіації в тому, що являло собою дослідження фертильності перед ДРТ, додають неоднорідності, як і відмінності в стратегії ET. Крім того, розмір вибірки, як правило, невеликий, і в більшості випадків втручання оцінюють без будь-яких спроб діагностувати причину ПНІ або незалежно від результатів діагностичних досліджень.
Навмисне пошкодження (скретчінг) ендометрію
Травма ендометрію або скретчінг ендометрію виконується для покращення сприйнятливості ендометрію до перенесеного ембріона. Біологічний механізм дії до кінця не вивчений.
Метааналіз Busnelli та ін. (2021) повідомили, що згідно з трьома РКД не було істотно підвищених шансів на вагітність і ЖН у жінок, які зазнали навмисного пошкодження ендометрія (модель випадкових ефектів, ВР 1,43; 95% ДІ 0,79–2,61; P = 0,24; I 2 = 52% і ВР 1,55; 95% ДІ 0,81–2,94; P = 0,18; I 2 = 46% відповідно). Постійний позитивний вплив пошкодження ендометрія на клінічну ВВ (ПВВ) було повідомлено у двох обсерваційних дослідженнях (Raziel та ін., 2007; Matsumoto та ін., 2017). Нещодавнє РКД, яке включало 211 жінок, також повідомило про відсутність суттєвої різниці в клінічній вагітності (серцебиття плода), втрати вагітності або багатоплідній вагітності між пацієнтками з ПНІ, які перенесли гістероскопію та навмисне пошкодження ендометрію, порівняно з лише гістероскопією (Zahiri та ін., 2021). Кокранівський огляд пошкодження ендометрію у жінок, які проходять ЕКЗ, надав аналогічні дані субаналізу (Lensen та ін., 2021). На сьогодні дослідження ефективності скретчінгу ендометрію були емпіричними, оскільки тести, які б визначили причину ПНІ, для якої пошкодження ендометрію могло б стати відповідним лікуванням, ще не встановлено.
Введення гранулоцитарного колонієстимулюючого фактора
G-CSF відіграє важливу роль у імплантації ембріона та продовженні вагітності шляхом тимчасового пригнічення імунної відповіді через вплив на лімфоцити, макрофаги та Т-хелпери-2 клітини (Moldenhauer та ін., 2010). Його використання може бути пов’язане з рекрутуванням дендритних клітин, сприянням секреції цитокінів Th-2, активацією Tregs, сприянням місцевим імунним реакціям, судинним ремоделюванням ендометрію та шляхів клітинної адгезії (Rahmati та ін., 2014). Повідомлялося, що при системному введенні G-CSF відіграє роль у ембріональному розвитку, імплантації та зростанні трофобласта (Würfel, 2015), тоді як місцеве внутрішньопорожнинне введення може покращити сприйнятливість ендометрія (Rahmatiта ін., 2014).
Кілька досліджень, узагальнених у двох метааналізах, включаючи деякі з тих самих РКД, оцінювали ефект підшкірного або внутрішньоматкового введення G-CSF у пацієнтів із ПНІ (Busnelli та ін., 2021; Hou та ін., 2021). Підшкірне введення G-CSF асоціювалося зі збільшенням шансів клінічної вагітності порівняно з відсутністю лікування в обох метааналізах (ВР 2,29; 95% ДІ 1,58–3,31; 4 РКД; n = 333) (Busnelli та ін., 2021) (ВР 1,73; 95% ДІ 1,33–2,23; 6 РКД; n = 497) (Hou та ін., 2021). Внутрішньопорожнинне введення не вплинуло на ПНІ в огляді Bousnelitta та ін. (2021) (ВР 1,53; 95% ДІ 1,00–2,33; 2 РКД; n = 257), тоді як в іншому огляді повідомлялося про підвищення ймовірності клінічної вагітності при внутрішньопорожнинному введенні G-CSF (ВР 1,39; 95% ДІ 1,09–1,78; 4). РКД; n = 479) (Hou та ін., 2021). Аналіз ЖН не продемонстрував користі (ОР 1,43; 95% ДІ 0,86–2,36; 3 РКД; n = 372) (Hou та ін., 2021). Ще два нещодавніх РКВ щодо внутрішньопорожнинного введення G-CSF пацієнткам із ПНІ підтвердили суперечливі результати (Karimi та ін., 2020; ТВРку та ін., 2021).
Побічні ефекти або несприятливі явища при введенні G-CSF включають мукозит, збільшення селезінки, гепатомегалію, транзиторну гіпотензію, носову кровотечу, аномалії сечовипускання, остеопороз, загострення ревматоїдного артриту, анемію та псевдоподагру (Moffett and Shreeve, 2015).
Загалом існують суперечливі дані про те, чи внутрішньпорожнинне введення G-CSF покращує ЖН у пацієнток з ПНІ. Для підшкірного введення G-CSF було прийнято рішення про те, що перед можливими рекомендаціями для клінічної практики передбачуваний позитивний вплив на частоту настання вагітності у пацієнток з ПНІ потребує подальшого підтвердження як з точки зору подальшого спостереження за живонародженими, так і з точки зору безпеки.
Внутрішньовенне інтраліпідне вливання
Було запропоновано, що внутрішньовенна інфузія інтраліпідів відіграє роль в імунній модуляції через зниження агрегації тромбоцитів, зниження продукції IL-2, фактора некрозу пухлини-α та IL-1β, а також пригнічення рівня та активності NK-клітин.
Кілька РКД оцінювали ефективність внутрішньовенного інтраліпіду під час ДРТ у пацієнтів з ПНІ. У систематичному огляді та метааналізі повідомлено про вищий відсоток настання вагітності (172/417 проти 119/426; ВР 1,55; 95% ДІ 1,16–2,07; 5 РКД; I 2 = 44,2%) і ЖН (132/417 проти 73/426; ВР 1,83; 95% ДІ 1,42–2,35; 5 РКД; I 2 = 0%) із втручанням, але дослідники дійшли висновку, що є обмежені докази на підтримку використання внутрішньовенного інтраліпіду під час ЕТ у жінок з ПНІ в анамнезі (Rimmer та ін., 2021).
У багатоцентровому дослідженні, в якому оцінювали внутрішньовенне введення інтраліпіду та преднізону у 64 пацієнтів із ПНІ, у пацієнтів, які отримували лікування, було виявлено вищі показники серцевого рецидиву (44% проти 9%; P < 0,001) із ВР 8,13 (95% ДІ 4,49–14,72; P < 0,0001) (Коланська та ін., 2021). Більшість досліджень тепер оцінювали внутрішньовенне введення інтраліпіду як емпіричне втручання без націлювання на будь-яку діагностовану основну патологію. У когортному дослідженні, у якому оцінювали інфузії ліпідів у 94 пацієнтів із ПНІ з імунним профілем надмірної імунної активації ендометрію, спостерігалося ЖН 54% після наступної ЕТ (Lédée та ін., 2018). Однак для підтвердження цього потрібні більші контрольовані дослідження.
Порівняно з можливими перевагами внутрішньоліпідних інфузій є побічні ефекти або несприятливі явища, які, як повідомляється, включають гепатомегалію, жовтяницю, холестаз, спленомегалію, тромбоцитопенію, лейкопенію та синдром перевантаження жиром (Moffett and Shreeve, 2015). Тому в сукупності внутрішньовенні інфузії ліпідів не рекомендуються.
Внутрішньовенне введення імуноглобуліну
Вважається, що внутрішньовенна ін’єкція IgG (ВВІГ) має імуномодулюючу дію шляхом нейтралізації аутоантитіл, пригнічення функції В-клітин і Т-клітин і блокування Fc-рецепторів.
Огляди Abdolmohammadi-Vahid та ін. (2019) включили два когортних дослідження та два перехресних дослідження, зосереджених на ВВІГ у жінок з ПНІ, і показали значну різницю в групі ВВІГ порівняно з контрольною групою в ЖН (когортні дослідження: ВР 2,17; 95% ДІ 1,30–3,61; P = 0,003 та перехресні дослідження: ВР 7,57; 95% ДІ 4,53–12,64; P < 0,00001) і ВВ (когортні дослідження: ВР 1,82; 95% CI 1,14–2,89; P = 0,01 і перехресні дослідження: ВР 11,12; 95% CI 6,43–19,23; P <0,00001). Ще одне нещодавнє обсерваційне дослідження повідомило про значне збільшення ЖН та CВВ у жінок, які отримували лікування (ВР 1,76; 95% CI 1,08–2,89; P = 0,02 та ВР 2,08; 95% CI 1,28–3,36; P = 0,003 відповідно) (Ho та ін., 2019; Busnelli та ін., 2021). Незважаючи на те, що дослідження повідомляють про переваги ВВІГ, досліджувані популяції невеликі, а РКД бракує.
Побічні ефекти або несприятливі явища ВВІГ включають асептичний менінгіт, ниркову недостатність, тромбоемболію, гемолітичні реакції, анафілактичні реакції, захворювання легенів, ентерит, дерматологічні захворювання та інфекційні захворювання. Додаткове етичне занепокоєння, яке було піднято, полягає в тому, що пацієнти з серйозними захворюваннями не приймають ВВІГ, що вимагає суворого розподілу обмежених доступних запасів (Moffett and Shreeve, 2015).
Внутрішньопорожнинна інфузія аутологічних мононуклеарних клітин периферичної крові
Обґрунтуванням, що підтримує це лікування, є місцеве виробництво цитокінів такими стимульованими мононуклеарними клітинами периферичної крові (МКПК), що може покращити інвазію бластоцисти в ендометрій (Yu та ін., 2014; Fan та ін., 2021).
Метааналіз досліджень із залученням пацієнтів з, які мали ≥3 невдалих ЕТ, показав сприятливий ефект внутрішньоматкової інфузії МКПК щодо ЖН та ВВ (ВР 1,93; 95% ДІ 1,35–2,76; P < 0,001; 1 РКД + 3 дослідження та ВР 1,92; 95% ДІ 1,48–2,49; P <0,001; 2 РКД і 6 квазіекспериментальних досліджень) (Maleki-Hajiagha та ін., 2019). Два останніх РКД та одне дослідження підтвердили ці висновки (Chakrabarti та ін., 2019; Nobijari та ін., 2019; Pourmoghadam та ін., 2020).). Були опубліковані інші метааналізи, що включають той самий набір даних, але в усіх дослідженнях і РКД досліджувані популяції невеликі, а визначення суперечливі. Крім того, способи отримання МКПК суттєво відрізнялися між дослідженнями (спільне культивування в присутності hCG, кортикотропін-рилізинг-гормону, HMG, суміші свіжих і спільно культивованих МКПК).
Вичерпних даних щодо побічних ефектів, ускладнень і несприятливих результатів вагітності немає (Maleki-Hajiagha та ін., 2019). У сукупності, хоча роль МКПК у конкретних пацієнтів з ПНІ може бути визначена, наразі їх емпіричне використання не рекомендується.
Внутрішньоматкова інфузія збагаченої тромбоцитами плазми
Збагачена тромбоцитами плазма (ЗТП) — це аутологічний концентрат тромбоцитів у плазмі. Вважається, що цитокіни та фактори росту, присутні в ЗТП, справляють регенеративний ефект на тканини та клітини, включаючи слизову оболонку ендометрія (Mouanness та ін., 2021).
Busnelli та ін. повідомили про значно підвищені шанси клінічної вагітності після внутрішньоутробного введення ЗТП (модель фіксованих ефектів: ВР 2,45; 95% ДІ 1,55–3,86; P = 0,0001; I 2 = 0%; 2 РКД; n = 195) (Nazari та ін., 2019; Zamaniyan та ін., 2020; Busnelli та ін., 2021). Нещодавнє РКД тієї ж групи підтвердило ці висновки (Nazari та ін., 2022). Жінки, які брали участь у дослідженнях, не були відібрані через тонкий ендометрій.
Загалом, наявні докази не вважаються достатніми для підтримки використання інфузій ВВP.
Попередній метааналіз, який не включав найновіші РКД і використовував менш суворі критерії включення, включав три РКД і чотири когортні дослідження та повідомляв про значно вищу ймовірність клінічної вагітності в групі ЗТП (ВР 1,79; 95% ДІ 1,37– 2,32; P <0,001; I 2 = 16%; n = 625) (Maleki-Hajiagha та ін., 2020). З мережевого метааналізу 16 досліджень було зроблено висновок, що серед різних імуномодулюючих терапій, оцінених у, ЗТП був найефективнішим лікуванням для покращення ЖН (Liu та ін., 2022a).). Автори додали застереження, що додаткові високоякісні дослідження необхідні для перевірки висновків їхнього аналізу через обмежену кількість включених досліджень.
Агаджанзаде та ін. (2020) повідомили за результатами дослідження 30 пацієнтів із ПНІ, що немає значного покращення імплантації або ЖН у реципієнтів із замороженими та розмороженими ембріонами, які отримували ЗТП, порівняно з попередніми циклами без ЗТП (рівень імплантації 6,7% проти 0,0%, з або без ЗТП). В іншому невеликому ретроспективному когортному дослідженні ЗТП у 15 пацієнтів з ПНІ і 39 з тонким ендометрієм (<8 мм) призвело до значного покращення ЖН (27,2% проти 9,6% відповідно), але не збільшило ЖН у циклі ЕКЗ порівняно з попереднім циклом ET (Enatsu та ін., 2022). Вичерпних даних щодо побічних ефектів, ускладнень і несприятливих результатів вагітності не було. Крім того, ЗТП характеризується абсолютною концентрацією тромбоцитів, яка є будь-якою концентрацією, що перевищує концентрацію в цільній крові, що спричиняє великі відмінності між дослідженнями. Інформації щодо приготування ЗТП в окремих дослідженнях наведено недостатньо (Maleki-Hajiagha та ін., 2020). Консенсус щодо методу виділення та концентрації тромбоцитів є обов’язковим для клінічного впровадження.
Загалом, наявні докази не вважаються достатніми для підтримки використання інфузій ВВP.
Внутрішньоматкова ін'єкція ХГЛ
Інфузія ХГЛ може допомогти ініціювати та контролювати інвазію бластоцисти та покращити імунну толерантність матері (Zenclussen та ін., 2006).
На основі двох обсерваційних досліджень було повідомлено, що вплив внутрішньоматкової ін’єкції ХГЧ у жінок з ПНІ (≥3 невдалих ЕТ) і нормальною ЕМТ (8–16 мм) значно збільшує ЖН (ВР 1,78; 95% ДІ 1,02–3,09; n = 303; P = 0,04; модель фіксованих ефектів: ВР 1,81; 95% ДІ 1,23–2,65; n = 482; P = 0,002; I 2 = 0%) (Huang та ін., 2018; Liu та ін., 2019; Busnelli та ін., 2021). Лю та ін. (2019)показали сприятливий вплив внутрішньоматкової ін’єкції ХГЛ на частоту імплантації (ВР 1,71; 95% ДІ 1,08–2,71; P = 0,02).
Менш строгий систематичний огляд щодо внутрішньоутробного введення ХГЛ у пацієнток з ПНІ (≥2 невдалих ЕТ) також показав підвищення ЖН у групі лікування порівняно з контрольною групою (27,8 проти 18,0%; ВР 1,52; 95% ДІ 1,18–1,96; 3 дослідження; n = 870 і 41,8 проти 31,2%; ВР 1,30; 95% ДІ 1,14–1,50; 6 досліджень; n = 1432 відповідно) (Hyie та ін., 2019). Нещодавнє РКД, у якому брали участь 98 жінок, порівнювало внутрішньоматкову ін’єкцію ХГЧ з плацебо та повідомляло про значно вищі показники ЖН (23/49 (46,9%) проти 11/48 (22,9%)) і частоту імплантації (28/120 (23,3%) проти 16/118 (13,6%)) з лікуванням ХГЛ (ТВРку та ін., 2021). ConfBPti та ін. (2022), не зосереджуючись на жінках з ПНІ, дійшли висновку, що можлива користь від внутрішньоматкової ін’єкції ХГЧ може бути обмежена ET на стадії розщеплення.
Хоча докази свідчать про користь, дані в основному отримані з невеликих неконтрольованих досліджень, а не з РКД. Крім того, існує значна неоднорідність між дослідженнями щодо дозування ХГЛ та часу введення, об’єму перфузійної рідини та типу циклу передачі (свіжий або заморожений). З цього зроблено висновок про недостатність доказів для підтримки рекомендацій щодо застосування внутрішньоматкової ін’єкції ХГЛ у клінічній практиці.
Низькомолекулярний гепарин
Встановлено, що низькомолекулярний гепарин (НМГ) має значний вплив на ЖН у жінок з набутою тромбофілією. Вважається, що антикоагулянтний ефект гепарину запобігає плацентарному тромбозу та інфаркту, а також сприяє встановленню та збереженню вагітності (Nelson and Greer, 2008). Враховуючи можливий зв’язок тромбофілії з ЖН та, використання НМГ було розширено на цих пацієнтів, які проходять ДРТ, навіть за відсутності набутої або успадкованої тромбофілії.
Метааналіз досліджував використання НМГ у пацієнтів із ПНІ (≥3 невдалих ЕТ), але не зміг продемонструвати вплив НМГ на ЖН (ВР 1,38; 95% ДІ 0,64–2,96; 2 РКД; n = 71) та СЛР (ВР 1,39; 95% ДІ 0,87–2,23; 2 РКД; n = 218) (Busnelli та ін., 2021). Обсерваційне дослідження Berker та ін. (2011) також не змогли показати різницю в ЖН або ВВ.
У включених дослідженнях були невеликі досліджувані популяції, включно з різними пацієнтами з ПНІ, деякі з тромбофілією та деякі, які не пройшли тестування або дали негативний результат на тромбофілію (Potdar та ін., 2013; Siristatidis та ін., 2018; Busnelli та ін., 2021). НМГ має хороший профіль безпеки під час вагітності, навіть якщо він може викликати синці та кровотечі.
Попереднє лікування агоністами ГРГ та інгібіторами ароматази
Враховуючи, що ендометріоз може бути основною та недіагностованою причиною ПНІ, було висунуто гіпотезу, що емпіричне лікування агоністами ГРГ та інгібіторами ароматази перед ET може покращити результати вагітності (Steiner та ін., 2019).
У РКД 67 жінок із принаймні двома невдалими імплантаціями були рандомізовані для прийому агоніста ГРГ (0,1 мг/добу) з 21-го дня циклу, що передує заморожено-розмороженим ЕТ. Дозу зменшили до 0,05 мг/добу з 2-го дня циклу. Контрольна група не отримувала агоніста ГРГ. Не було виявлено суттєвих відмінностей у СЛР (25,8% проти 19,4%) або частоті імплантації (13,55% проти 10,52%) у дослідженні порівняно з контрольною групою (Davar та ін., 2020). У ретроспективне когортне дослідження були включені пацієнти з безпліддям віком 36–43 роки, які проходили третю або більше ЕТ після аутологічного ЕКЗ або ICSI. Навчальна група (н = 290) отримали одноразову ін’єкцію 3,75 мг триптореліна ацетату тривалої дії на 2-й день попереднього циклу з наступною замісною гормональною терапією (ЗГТ). Контрольна група (n = 194) отримувала лише ЗГТ. Клінічна частота вагітності (49,0% проти 35,1%), ОВВ (37,6% проти 22,7%) та ЖН (36,6% проти 22,1%) були значно вищими в групі дослідження порівняно з контрольною відповідно. Рівень викиднів не відрізнявся між групами (Pan та ін., 2022).
В іншому ретроспективному когортному дослідженні безплідним жінкам, у яких двічі не вдалося пересадити бластоцисту, було проведено третю пересадку замороженої бластоцисти (Steiner та ін., 2019). До третьої ЕТ 143 жінки отримували лише агоніст ГРГ (3,75 мг внутрішньом’язово леупроліду ацетату щомісяця) протягом 2 місяців, 176 отримували агоніст ГРГ та інгібітор ароматази (5 мг перорально летрозолу щодня протягом 60 днів), а 204 не отримували попереднього лікування. ЖН була вищою серед жінок, які отримували агоністи ГРГ плюс летрозол, порівняно з жінками, які отримували лише агоністи ГРГ або жінки без попереднього лікування (СЛР: 63%, 42% і 40% відповідно; P < 0,0001; ЖН: 56) . %, 36 % і 34 % відповідно; P < 0,0001). Однак не було різниці між відсутністю попереднього лікування та попереднім лікуванням лише агоністами ГРГ.
У сукупності, хоча роль попереднього лікування агоністами ГРГ та інгібіторами ароматази у конкретних пацієнтів із ПНІ може бути визначена, наразі їх емпіричне використання не рекомендується.
Передімплантаційне генетичне тестування на анеуплоїдії
Хоча обґрунтування пропозиції передімплантаційного генетичного тестування (PGT) для структурних перебудов (PGT-SR) для пар з діагностованим хромосомним розладом здається зрозумілим, PGT для анеуплоїдій (PGT-A) також пропонується парам загалом. Вважається, що ефективність лікування полягає в скасуванні селекції ембріонів, у яких діагностовано рівномірну анеуплоїдію цілої хромосоми, а саме основну причину втрати вагітності та невдалої імплантації у людей. Зокрема, анеуплоїдні бластоцисти, перенесені в контексті сліпих неселекційних або неосліплених когортних досліджень, призвели до високого рівня летальності на перенесення та частоти викиднів на клінічну вагітність (відповідно, 98% і >86% у дослідженні Capalbo та ін. (2022 р.).)) (Tigs та ін., 2021; Capalbo та ін., 2022), таким чином підтримуючи використання PGT-A у популяціях пацієнтів із вищим рівнем анеуплоїдії ембріонів, наприклад у жінок старшого віку матері.
Busnelli та ін. проаналізували два РКД (Blockeel та ін., 2008; Rubio та ін., 2013) і три обсерваційні дослідження (Yakin та ін., 2008; Greco та ін., 2014; Sato та ін., 2020), які досліджували потенційну роль PGT-A в покращенні результатів ЕКЗ у жінок з ПНІ. Метааналіз РКД не продемонстрував покращення як клінічної вагітності, так і ЖН (модель випадкових ефектів: ВР 1,07; 95% ДІ 0,36–3,15; P = 0,90; I 2 = 89% і ВР 0,98; 95% ДІ 0,32– 2,94; P = 0,97;I 2 = 87%) у жінок, які перенесли ПГТ-А.
Порівнянні результати були отримані Yakin та ін. (2008); однак вони використали старомодний підхід FISH, аналізуючи обмежену кількість хромосом у поєднанні з біопсією 3-го дня.
На відміну від цього, ретроспективні дослідження, де тестування ембріонів проводилося або методом порівняльної геномної гібридизації, або методом NGS на біопсії бластоцисти, прийшли до висновку, що PGT-A можна вважати гарною стратегією для жінок з ПНІ, оскільки для досягнення вагітності та ЖН потрібна менша кількість ET (Cozolino та ін., 2020; Ni та ін., 2020; Tong та ін., 2021).
Неінвазивні способи оцінки еуплоїдії ембріона знаходяться в центрі уваги багатьох сучасних досліджень, але цей підхід знаходиться на занадто ранній стадії, щоб розглядати його як варіант у клінічній практиці.

ET на стадії бластоцисти
Ембріони на стадії бластоцисти можуть мати кращі шанси на імплантацію завдяки меншому ризику анеуплоїдії ембріона, кращій синхронізації з ендометрієм і меншим скороченням матки під час перенесення. Систематичний огляд 27 досліджень за участю пацієнтів, які проходили ДРТ, показав із низькою якістю доказів, що ЖН після нової пересадки була вищою в групі перенесення бластоцисти порівняно з групою ET на стадії розщеплення (ВР 1,27; 95% ДІ 1,06–1,51; I 2 = 53%; 15 досліджень; n = 2219 жінок) (Glujovsky та ін., 2022).
У проспективному когортному дослідженні за участю 575 пацієнтів із ПНІ порівнювали перенесення однієї стадії замороженої/розмороженої бластоцисти із кріопереносом на стадії подвійного розщеплення та повідомили про вищу ЖН (ВР 1,27; 95% ДІ 1,11–1,47); частота імплантації (ВР 1,51; 95% ДІ 1,21–1,89) та ОВВ (ВР 1,43; 95% ДІ 1,19–1,73) складала у пацієнтів, яким проводили ЕТ одиночної бластоцисти (Zhang та ін., 2019).
Допоміжний хетчинг
Нездатність бластоцисти вийти зі своєї зони pellucida вважається одним із шляхів, що ведуть до невдалої ДРТ, включаючи невдачу імплантації. У цьому відношенні допоміжне виведення бластоцисти може бути варіантом полегшення імплантації.
Систематичний огляд, включаючи одне РКД та одне обсерваційне дослідження, оцінював допоміжний хетчінг на результати ДРТ у пацієнтів із ПНІ після принаймні трьох невдалих ЕТ та виключення ймовірних причин ПНІ (Busnelli та ін., 2021). Допоміжний хетчінг не збільшив ЖН (дані РКД: ОР 0,78; 95% ДІ 0,48–1,27; Р = 0,31; дані спостереження: ВШ 1,42; 95% ДІ 0,45–4,48; Р = 0,55) або ЖН (дані спостереження: ВШ 1,92; 95% ДІ 0,48–7,67; P = 0,36) (Bimi та ін., 2004; Rufas-Sapir та ін., 2004; Busnelli та ін., 2021).
Інші дослідження, виключені з огляду на основі їхнього визначення, повідомили про подібні результати СЛР. Два дослідження також показали, що внесок допоміжного хетчінгу шляхом часткового розсічення зони в успішну імплантацію був пов’язаний з віком пацієнта: пацієнти старше 38 років продемонстрували помітно вищий рівень ЖН після допоміжного виведення (Stein та ін., 1995; Kanyo et al., 2016). Valojeri та ін. (2008) прокоментували, що користь від допоміжного хетчінгу була виявлена у пацієнтів із замороженими-розмороженими ембріонами, оскільки показники були статистично значно вищими в тестовій групі порівняно з контрольною групою (31,2% і 12,8% відповідно). Ще одне дослідження порівнювало переваги допоміжного хетчінгу у пацієнтів з оптимальною якістю ембріона порівняно з неоптимальною та повідомило про кращі результати у пацієнтів з оптимальною якістю ембріона (Grace та ін., 2007).
Інші методи лікування
Були запропоновані інші методи лікування ПНІ, у тому числі додаткові втручання в лабораторії (наприклад, сповільнена зйомка), медикаментозне лікування (силденафіл), адаптація процедури ЕТ (наприклад, ЕТ під ультразвуковим контролем, виконання пробної ЕТ, забезпечення кінчика катетера >15 мм від очного дна, рекомендований повний сечовий міхур при ЕТ, розширення шийки матки, видалення цервікального слизу, використання фібринового герметика, застосування антибіотиків, постільний режим після процедури) та адаптація стратегії ЕТ (наприклад, кріоперенос). Наскільки нам відомо, немає досліджень, які б оцінювали вплив цих втручань на шанси ЖН у пацієнтів з ПНІ.
Що стосується середовища ЕТ з добавками гіалуронової кислоти (ГК), метааналіз підтверджує покращення ЖН у загальній популяції ДРТ (ВР 1,33; 95% ДІ 1,11–1,60) (Heymann та ін., 2020; Holt-Kentwell та ін., 2022). Однак, наскільки нам відомо, докази, які стосуються жінок із ПНІ, обмежуються одним РКД, яке демонструє переваги середовища ЕТ, збагаченого ГК, порівняно зі звичайним середовищем ЕТ з точки зору клінічного ВВ (Friedler та ін., 2007).
Слід додати, що пари з діагнозом ПНІ можуть отримати користь від переходу на донорство третьої сторони для подальших циклів ДРТ. Незважаючи на те, що донорство третьої сторони створює нові проблеми та вимагає підтримки та суворого надання інформації, воно може обійти основну (неідентифіковану) проблему зі спермою, ооцитом або ембріоном. Необхідні дослідження, щоб підтвердити, що застосування ДРТ із застосуванням донорської сперми або ооцитів справді покращує шанси на вагітність і живонародження після ПНІ.
Лікування за результатами діагностики
Кілька досліджень оцінювали втручання при ПНІ із встановленим основним фактором.
Деякі з цих комбінацій виявлених основних факторів і відповідних методів лікування були розглянуті в попередньому розділі про дослідження. Охоплені методи лікування включають оптимізацію факторів способу життя після їх повторної оцінки, перегляд лікування естрадіолом, якщо ендометрій залишається тонким, гістероскопію для виключення синдрому Ашермана, генетичне консультування та, якщо необхідно, PGT у разі виявлення хромосомної аномалії та лікування антибіотиками у випадку виявлення ХЕ. Будь-які інші виявлені аномалії або дисфункції (дисфункція щитовидної залози, діагноз АФС, аномалії розвитку матки, ендометріоз, аденоміоз) слід контролювати згідно з відповідними застосовними клінічними рекомендаціями.
У рамках дослідження OPTIMUM пацієнти з ПНІ (n = 116) отримували лікування відповідно до визначеного можливого фактора ризику (наприклад, ХЕ з антибіотиками, аномальне високе співвідношення клітин Th1/Th2 з вітаміном D та/або такролімусом, явний/субклінічний гіпотиреоз з левотироксином, і тромбофілія з низькими дозами аспірину) (Kuroda та ін., 2021). У пацієнтів віком <40 років і ≥40 років OВВ у групі OPTIMUM був значно вищим, ніж у контрольній групі (57,4% і 30,3% проти 21,4% і 0% на ET відповідно; P < 0,01). Ці дані свідчать про те, що використання діагностики для оцінки причини ПНІ, швидше за все, покращить ефективність втручань, які потім будуть застосовуватися з більшою обґрунтованістю, ніж зараз. На цей час доступно кілька підтверджених досліджень цінності в контексті, але це, ймовірно, зміниться в майбутньому.
Надання медичної допомоги пацієнтам та консультування
Шлях до лікування фертильності, від дослідження фертильності до фактичного лікування та вагітності, впливає на психічне здоров’я пацієнтів, і ефект значно вищий у пацієнтів із невдалим лікуванням (Boivin та ін., 2022). Повідомлялося, що жінки з ПНІ мають значно вищий рівень стресу порівняно з фертильними здоровими жінками контрольної групи та визнають почуття соціальної ізоляції, чутливість до коментарів, потребу в батьківстві, зниження сексуального задоволення та відмову від способу життя без дітей (Coughlan et al., 2014b). «Низький рівень надії» є ще одним фактором, тісно пов'язаним з психічним здоров'ям і емоційним станом. Дослідження Ni та ін. (2021)показали, що рівень надії був значно нижчим у пацієнтів після повторних циклів ЕКЗ порівняно з тими, хто проходив перший цикл. Відсутня інформація про чоловіків-партнерів у парах.
Було припущено, що рівень стресу, який відчувають жінки з ПНІ, може коливатися у відповідь на кількість підтримуючої терапії, яку вони отримують від клінічного персоналу, результати процедур дослідження (які впливають на прогноз), а також досвід та результати будь-якого подальшого лікування, але це не було вивчено (Coughlan та ін., 2014b). Проте, оскільки психосоціальна допомога вважається невід’ємною частиною лікування фертильності та повинна надаватися до, під час і після лікування ДРТ (Gameiro та ін., 2015), слід докласти зусиль для надання підтримуючої допомоги парам з ПНІ.
Немає універсальної моделі підтримуючої терапії для пар з ПНІ, але на основі вказівок щодо ЖН (Група рекомендацій ESHRE щодо ЖН та ін., 2023) можна застосувати наступний підхід:
- Визнайте жінку/пару як особистість.
- Виділіть час на запитання, інформацію, повторення та обговорення, особливо коли пацієнт/пара відчуває стрес або тривогу.
- Вислухайте факти та почуття пацієнта/пари.
- Виявляйте повагу до пацієнта/пари та їхніх бажань і вибору.
- Використовуйте чітку та делікатну мову: пояснюйте термінологію, уникайте нечутливих термінів і відображайте терміни, яким надає перевагу пацієнт.
- Будьте чесними щодо процесів, ймовірних результатів і прогнозів і уникайте фальшивих запевнень. Це включає чесність щодо доказів і користі (або відсутності користі) для досліджень і лікування, які були запропоновані та застосовуються в клінічній практиці без твердих підстав. На основі їхньої індивідуальної оцінки ймовірності імплантації в наступному циклі пацієнти/пари можуть бути запевнені в тому, що просто продовження лікування ДРТ є хорошим варіантом для них. Подальше підтвердження цього можна отримати з дослідження, яке показує, що половина пацієнтів з ПНІ народжують живих дітей за допомогою ДРТ протягом 5 років (Koot та ін., 2019).
- Застосовуйте спільне планування лікування в партнерському підході. Нещодавно було висловлено припущення, що багатоцикловий підхід може бути корисним у цьому відношенні, оскільки він розглядатиме збій циклу та те, як з ним впоратися з самого початку процесу лікування (Harrison та ін., 2022).
- Будьте добрими, проявляйте турботу та співчуття.
Обговорення
У цих рекомендаціях щодо належної клінічної практики робоча група ESHRE заохочує переглянути ПНІ як медичний стан із фіксованими діагностичними критеріями до клінічного вторинного явища ДРТ, яке може виникати в різні моменти у різних пацієнтів і вимагає певної емпатії та прагматизму для вироблення оптимальної діагностично-лікувальної тактики. Надані рекомендації базуються на цьому підході з чітким визнанням відсутності надійної доказової бази для їх підтвердження. Однак природа та вимога клінічної медицини — давати рекомендації щодо того, що найкраще для пацієнта, враховуючи його індивідуальний клінічний контекст, навіть якщо достовірних даних бракує. Залишається сподіватися, що в найближчі роки будуть опубліковані дослідження, які забезпечать міцнішу основу для клінічних рекомендацій і дозволять досягти чіткого консенсусу щодо оптимального лікування ПНІ. В ідеалі всі дослідження, що використовуються у пацієнтів з ПНІ, матимуть доведену клінічну корисність і відповідність. Будуть проведені дослідження, щоб виявити основну проблему або оцінити фактор, що сприяє невдачі імплантації, і пов’язати їх із конкретним втручанням, яке, як було показано, покращує шанси на живонародження у наступному циклі. Додаткові тести, які не мають пов’язаного втручання, можна розглянути для консультування пацієнта та оцінки доцільності продовження лікування ДРТ або використання інших репродуктивних варіантів.
Необхідність подальших досліджень в ПНІ
Потреба в дослідженні причин невдачі імплантації була визначена як один із 10 провідних пріоритетів досліджень у сфері допоміжної репродукції (Duffy та ін., 2021). Це справді ключ до прогресу в клінічному лікуванні ПНІ. Подальші дослідження емпіричних втручань у пацієнтів з ПНІ невідомої причини навряд чи будуть корисними та можуть вважатися марною тратою дослідницьких ресурсів. В ідеалі втручання слід тестувати на тих, хто має чітку причину ПНІ, і базуватися на біологічному обґрунтуванні. На сьогодні таких досліджень мало. Крім того, майбутні клінічні рекомендації щодо дозволу проводити низку відповідних досліджень, кожне з яких має певний пов’язаний варіант лікування, який буде ефективним для вирішення конкретного та виявленого показання.
У цьому відношенні запропоноване тут визначення слід застосовувати в майбутніх дослідженнях, оскільки це збільшить однорідність як у досліджуваній популяції, так і в інших дослідженнях, що має бути корисним для отримання значущих результатів дослідження та можливого метааналізу.
Що стосується конкретних досліджень і методів лікування, такі теми повинні бути пріоритетними для дослідників:
- Роль визначення та добавки вітаміну D (у разі низького рівня) у пацієнтів з ПНІ.
- Роль імунологічних факторів як фактора, що лежить в основі ПНІ, методи їх дослідження та ефективність цілеспрямованого лікування.
- Роль децидуалізації як потенційної терапевтичної мішені для подолання невідповідного відторгнення імплантованого ембріона.
- Доцільність тестів на сприйнятливість ендометрія, оцінки ХЕ та профілювання мікробіому у пацієнток з ПНІ слід додатково оцінити.
- Роль тонкого ендометрію, а також актуальність специфічних методів лікування для підвищення шансів на вагітність у пацієнток з ПНІ та виявленим тонким ендометрієм.
- Клінічне значення тестів SDF.
- Можлива генетична схильність до екстремальних результатів ЕКЗ (Capalbo та ін., 2021).
- Слід додатково оцінити значення таких методів лікування, як внутрішньоматкова аутологічна інфузія МКПК, внутрішньоматкова інфузія ЗТП та внутрішньоматкова ін’єкція ХГЛ, для запобігання невдачі імплантації в наступному циклі.
- Необхідно додатково оцінити значення лікування антиоксидантами.
- Крім клінічного аспекту, потрібні додаткові знання та дані про вплив на стрес, психічне здоров’я та благополуччя пацієнтів, а також про варіанти підтримуючого лікування, які могли б мінімізувати такий вплив і сприяти кращому догляду.
Очікуючи на результати подальших досліджень і випробувань, робоча група ESHRE рекомендує підхід, підсумований на схемах (наведені у тексті), який полягає в індивідуалізації діагнозу на основі ймовірності успішної імплантації для окремого пацієнта або пари та обмежити дослідження та лікування тими, що підтверджуються чітким обґрунтуванням і даними про їх користь. Поточні рекомендації будуть оновлені через 4 роки після публікації.
ДЖЕРЕЛО: https://www.eshre.eu/
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу
Засіб проти раку грудей зменшив ризик реци ...

Захист найбільш уразливих немовлят

Контрацепція і репродуктивне здоров’я

Клінічна загадка: Нудота та блювання під ч ...
Проблема постпункційного головного болю і ...

СПКЯ та ожиріння: підвищений ризик під час ...


