Ботулотоксин у лікуванні болю
Дата публікації: 03.04.2024
Ключові слова: біль, ботулотоксин, м’язовий синдром, вогнищева дистонія
Вступ
Діагностика та лікування хворобливих м’язових синдромів може бути складним завданням для будь-якого клініциста. Як правило, основою терапії таких станів є лікувальна фізкультура, знеболюючі препарати й настоянка часу. На жаль, не всі пацієнти реагують на цю парадигму, і, попри героїчні зусилля з боку лікуючого клініциста, деякі захворювання не піддаються такому підходу.
У звітах описується передбачувана ефективність використання біологічного нейром’язового блокатора, ботулотоксину, для лікування хворобливих станів, пов’язаних зі скелетними м’язами. Попри те, що використання ботулінічного токсину в лікуванні станів, пов’язаних із мимовільним скороченням м’язів, таких як вогнищева дистонія та спастичність, є неповним розумінням і часом суперечливим, воно підтверджується проспективними, рандомізованими клінічними дослідженнями; однак, хоча обсяг порівнянних досліджень больових синдромів зростає, кількість клінічних рандомізованих досліджень обмежена. Крім того, не всі такі звіти продемонстрували чітку ефективність використання ботулотоксину за будь-яких обставин. Таким чином, з огляду на наше поточне розуміння природи спричиненого м’язами болю та недостатність проспективних досліджень щодо нервово-м’язової блокади та/або пригнічення ноцицепції в таких умовах, доцільно провести критичний і ретельний аналіз даних і думок, представлених у цьому розділі.
Neurology Thursday повернулись! Перегляньте записи заходів, що завершились та не забудьте зареєструватись на ті, що ще будуть!
Фармакологія ботулінічного токсину
Ботулінічний токсин виробляється анаеробною бактерією Clostridium botulinum, паличкоподібним грампозитивним мікроорганізмом, що міститься в ґрунті та воді. Ботулінічний токсин типу A (скорочено BoNT-A або BTX-A) належить до сімейства нейротоксинів (позначених як типи A, B, C1, C2, D, E, F і G) зі схожими властивостями. BoNT-A викликає млявий (а не жорсткий або тетанічний) параліч, блокуючи вивільнення ацетилхоліну, необхідного для скорочення м’язів, у нервових закінченнях. Терапевтична користь може бути отримана шляхом використання фармакологічних властивостей ретельного місцевого застосування цього очищеного нейротоксину.
Різноманітні ботулінічні токсини мають індивідуальну дію, тому необхідна обережність, щоб забезпечити правильне використання та уникнути помилок при лікуванні. Нещодавні зміни до встановлених назв ліків, внесені FDA, мали на меті посилити ці відмінності та запобігти помилкам у лікуванні.
Передбачуваний успіх ботулінічного токсину в боротьбі з болем спочатку пояснювався його здатністю блокувати вивільнення ацетилхоліну в синапсі. Однією з важливих властивостей ботулотоксину при лікуванні болю є те, що вважається, що нейротоксин діє лише на рухові нервові закінчення, зберігаючи сенсорні нервові волокна від його впливу. Однак згодом у доклінічних дослідженнях було продемонстровано вплив ботулотоксину на ноцицептивні нейрони. Таким чином, знеболювальний ефект, ймовірно, виникне, але не як наслідок блокування аферентних сенсорних волокон у місці ін’єкції; скоріше їх приписують вторинним ефектам, які можуть бути результатом паралічу м’язів, покращеного кровотоку, вивільнення нервових волокон під час стиснення м’язами, що аномально скорочуються, і, що, можливо, більш важливо, впливу токсину на ноцицептивні нейрони.
Середня летальна доза (LD50)
Середня летальна доза ботулотоксину (LD50) була визначена для кількох видів тварин, але не для людей. Одиниця BoNT-A зазвичай визначається з точки зору її біологічної активності. Одна одиниця миші (MU) BoNT-A дорівнює LD50 для 20-грамової миші Swiss-Webster. Проте чутливість BoNT-A різна для різних видів. LD50 у мавп було визначено як 39 U/кг. На підставі цих результатів досліджень на приматах LD50 людини оцінюється приблизно в 3000 ОД для дорослої людини вагою 70 кг. Типові дози для більших груп м’язів коливаються від 60 до 400 загальних одиниць, що вводяться за одне лікування; однак, через недостатнє розуміння повної кривої дози-відповіді у людей, рекомендована відносна максимальна доза 360 ОД, введена не раніше ніж через 12 тижнів.
Побічні ефекти
Оскільки механізм дії BoNT-A дуже специфічний, побічні ефекти є рідкісними. Повідомлялося про грипоподібний синдром, але він, як правило, короткочасний. Повідомлялося про інші побічні ефекти, але вони не обов’язково є результатом лікування BoNT-A. Вони включають біль у м’язах, головні болі, запаморочення, лихоманку, озноб, гіпертонію, слабкість, діарею та біль у животі.
М’язова слабкість, переважний і бажаний ефект ін’єкції ботулінічного токсину, також може розглядатися як несприятливий ефект, якщо слабкість виникає в непередбаченій області або є більшою, ніж очікувалося. Клініцисти повинні розуміти функціональні наслідки ненавмисної слабкості, спричиненої ін’єкцією ботулотоксину. Хоча надмірне ослаблення м’язів, які згинають пальці ніг, може мати небажані наслідки, якщо вони взагалі є, поширення токсину в м’язи, які контролюють ковтання, що може статися під час ін’єкції м’язів поблизу гортані (наприклад, проксимальної частини грудинно-ключично-соскоподібного м’яза), може призвести до утрудненого ковтання. Таким чином, пацієнти повинні бути проінформовані про потенційну надто сильну слабкість у ділянці ін’єкції або слабкість у м’язах поблизу.
Застосування ботулотоксину при хворобливих нервово-м'язових розладах
Попередні дослідження станів з мимовільними м’язовими скороченнями дали деякі непрямі докази знеболюючої дії ботулотоксину. Підсумок пошуку MEDLINE для клінічних досліджень із заголовками «ботулінічний токсин» і «біль», проведених з 1966 по вересень 2005 року, призвів до більш ніж 40 досліджень, які включали «біль» у назву статті чи анотацію.
У звіті больова реакція на лікування ботулотоксином цитувалася в контексті лікування низки станів, у тому числі тенісного ліктя, хронічної анальної тріщини, болю, пов’язаного з мастектомією та гемороїдектомією, головного болю (включаючи мігрень), синдрому грушоподібного м'яза, болю в обличчі. , міофасціальний біль, синдром скронево-нижньощелепного суглоба (СНЩС), біль у попереку , хронічний біль у передміхуровій залозі та хлистова травма.
Змінні в цих дослідженнях включали дозування, концентрацію, техніку ін’єкцій, використання одночасних терапевтичних методів, різні діагнози та хронічну неврологічну дисфункцію. Деякі пацієнти, які отримували лікування розладів, які включали мимовільне скорочення м’язів (наприклад, дистонія), також повідомляли про переваги зменшення болю в м’язах, яким вводили ботулотоксин. Змінні в цитованих дослідженнях включали наявність або відсутність одночасної терапії, діагнози, тривалість часу з моменту появи болю, дозування та концентрацію, а також методологію вимірювання результату. У 2016 році Управління з контролю за якістю харчових продуктів і медикаментів США схвалило ботулінічний токсин типу А для зменшення вираженості ригідності м’язів гомілковостопного суглоба та пальців ніг у дорослих зі спастичністю нижніх кінцівок.
Інший огляд досліджень ботулотоксину був проведений Підкомітетом з оцінки терапії та технологій Американської академії неврології. Докази ефективності токсину досліджувалися для різних станів, включаючи хронічний головний біль напруги, епізодичну мігрень, хронічну щоденну мігрень і хронічний біль у попереку.
Долучайтесь до Ortho Trauma Friday!
Згідно зі звітом підкомітету, дані свідчать про те, що ботулінічний токсин може бути корисним для лікування болю в попереку, але, ймовірно, він не ефективний проти епізодичної мігрені та хронічного головного болю напруги. У звіті також зазначено, що наявні докази недостатньо переконливі чи послідовні, щоб визначити корисність ботулінічного токсину в лікуванні хронічного щоденного головного болю (насамперед, трансформованої мігрені).
Німецький звіт також досліджував ефективність ботулінічного токсину проти головного болю напруги.] У подвійному сліпому, рандомізованому, плацебо-контрольованому дослідженні дослідники порівнювали кількість днів без головного болю, які відчували пацієнти за 4 тижні до ін’єкцій BoNT-A, з кількістю таких днів через 4-8 тижнів після лікування. . Кількість днів без головного болю зросла в групах, які приймали плацебо та не отримували плацебо, але різниця у збільшенні між двома групами була незначною.
Проте дослідники виявили, що порівняно з групою плацебо пацієнти, які отримували ін’єкції BoNT-A, відчули значне скорочення тривалості головного болю.
Дослідження, проведене Naik та ін., показало, що використання ботулотоксину для лікування хворобливих шкірних лейоміом пов’язано з покращенням якості життя та тенденцією до зменшення болю у спокої.
Ботулінічний токсин і міофасціальний біль
Пацієнтам із міофасціальним больовим синдромом доступно багато методів лікування. Велика частина варіацій у формах лікування (і діагнозів) цього розладу, ймовірно, є результатом відмінностей у культурі, навчанні та розпізнаванні часто недіагностованого синдрому болю, дисфункції та вегетативної дисрегуляції. Етіологія міофасціального больового синдрому, пов'язаного з тригерними точками, не до кінця вивчена. Деякі клініцисти вважають, що це характерно як результат або гострого епізоду м’язового перевантаження, або хронічного та/або повторюваного м’язового перевантаження. Активні міофасціальні тригерні точки (МТрП), які викликають біль, виявляють виражену локалізовану болючість і часто передають біль у віддалені місця та порушують рухову функцію. Крім того, MTrps може викликати вегетативні зміни.
Для клінічної ідентифікації МТрП клініцист пальпує локалізовану чутливу точку в вузловій частині натягнутої мотузкової смуги м’язових волокон. Тиск на тригерну точку викликає біль у цій області, а також може викликати біль у місці, віддаленому від точки під кінчиком пальця (у феномені, відомому як референтний біль). Під час пальпації MTrPs також викликають біль, що відображає відчуття пацієнта. Застосований тиск часто викликає у пацієнта відповідь: «Це мій біль!» Введення голки, різка пальпація або навіть швидке постукування кінчиком пальця безпосередньо над тригерною точкою може призвести до короткого скорочення м’язів, яке може виявити обстежувач. Це швидке скорочення м’язових волокон канатоподібної натягнутої смуги називається реакцією локального посмикування.
У м’язах, які переміщують відносно невелику масу або є великими та поверхневими (наприклад, м’язи-розгиначі пальців, великий сідничний м’яз), реакція помітна легко і може призвести до підскоку кінцівки, коли дослідник вводить голку в тригерну точку. Локалізована аномальна реакція вегетативної нервової системи може спричинити пілоерекцію, локальне потовиділення або регіональні зміни температури шкіри, що пояснюється зміною кровотоку.
Кілька невеликих проспективних досліджень показали, що ін’єкції ботулотоксину в м’язи ефективні для міофасціального болю, спричиненого тригерними точками (TrPs). Однак переконливих доказів ефективності в більших багатоцентрових дослідженнях немає.
Ботулінічний токсин і м'язове веретено: клінічні проблеми
Існує мало доказів того, що болючі ділянки м’язів, такі як TrPs, пов’язані зі структурними змінами або сенсорними структурами, такими як м’язове веретено; однак веретено бере активну участь у певних умовах аномальної м’язової активності. У спастичному стані, наприклад, рефлекс розтягування посилюється з різних причин, таких як відсутність гальмування з боку інтернейронів спинного мозку. Якою б не була причина, фізіологія м'язового веретена є важливим регулятором м'язового тонусу в спастичному стані.
Було визнано, що BoNT-A зменшує біль, пов’язаний з різними клінічними станами, включаючи краніоцеребральну дистонію, головні болі напруги, цервікогенні головні болі та мігрень, ефект, який спостерігався незалежно від впливу токсину на розслаблення м’язів. (Однак, як зазначено вище, існують суперечки щодо ефективності ботулінічного токсину в лікуванні головного болю.)
Важливо, що було показано, що BoNT-A пригнічує вивільнення нейромедіаторів, які беруть участь у передачі болю, включаючи глутамат і речовину Р у щурів. Модель болю, спричиненого формаліном у щурів, допомогла показати, що місцева периферична ін’єкція BoNT-A може значно зменшити вивільнення глутамату, ознаки болю та місцевий набряк, не викликаючи м’язової слабкості. Ці доклінічні спостереження ще мають бути остаточно підтверджені на людях; однак вони надають можливе обґрунтування використання BoNT-A при хронічних хворобливих станах, включаючи синдроми хронічного міофасціального болю.
Коли розглядати ботулінічний токсин
Показання до лікування ботуліном не зовсім ясні для пацієнтів з міофасціальним больовим синдромом. Ці пацієнти можуть розглядатися як кандидати на ботулінічний токсин, якщо вони не відповіли на традиційні форми лікування, мали хронічну рефрактерну проблему протягом 3 місяців або довше, пройшли повне медичне обстеження для виключення інших не м'язових причин їхнього болю та чітко визначені TrPs.
Клініцист повинен бути обережним, перш ніж розглядати можливість застосування ботулотоксину для лікування пацієнта з міофасціальним болем. Пам’ятайте, що використання BoNT-A для лікування болю схвалено лише в Сполучених Штатах для лікування болю, пов’язаного з цервікальною дистонією. Таким чином, використання BoNT-A для лікування міофасціального болю не призначене для застосування, і його можна вважати найбільш доцільним лише для пацієнтів із захворюванням, яке не реагує на більш консервативне лікування або вважається невідповідним для нього. Фактори, які можуть ідентифікувати міофасціальний больовий синдром як потенційно сприятливу реакцію на ін’єкції ботулотоксину, включають гіпертрофію м’язів, нейрогенну та/або судинну компресію, анатомічну локалізацію, яка ізолює цільовий м’яз від інших структур, і більше ніж 1 показник результату для визначення ефективності лікування. Один із таких станів, який відповідає цим критеріям, називається синдромом грушоподібного м’яза.
Застосування ботулінічного токсину при синдромі грушоподібного м’яза — це суперечливий міофасціальний больовий стан, який проявляється, здавалося б, дивними симптомами. Пацієнти, як правило, жінки, мають нещодавню травму сідниць або таза (зазвичай внаслідок падіння) і скаржаться на глибокий біль у сідницях і стегні, що іррадіює в стегно або навіть у ногу та стопу. Ці характерні ознаки та симптоми можуть бути наслідком стиснення сідничного нерва скороченим грушоподібним м’язом, коли нерв проходить через таз. Хоча деякі клініцисти вважають цей діагноз суперечливим, кілька рецензованих статей цитують клінічні, анатомічні та електрофізіологічні докази цього окремого стану, що викликає біль у попереку та ногах.
При клінічному огляді тиск на сідниці в точці посередині між крижовою кісткою та великим вертлугом стегна відтворює скаргу пацієнта на біль. Оскільки грушоподібний м’яз розташований дуже глибоко, деякі клініцисти кажуть, що пальпація цього TrP може бути виконана належним чином лише за допомогою ректального або вагінального дослідження. Пальпація TrP на задньобоковій частині склепіння прямої кишки (або вагінального) викликає біль у місці компресії та віддає біль або в стегно, або вниз по нозі.
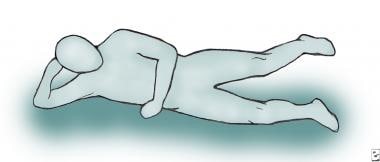
Маневр Бітті (див. зображення нижче) також є корисним клінічним методом відтворення болю пацієнта в цьому стані. Пацієнта просять лягти на неболючий бік і відвести стегно, відсуваючи болючу ногу від столу. Цей маневр ефективно скорочує грушоподібний м’яз і повинен відтворити біль пацієнта в сідницях; однак, оскільки синдром в основному викликає компресію сідничного нерва на рівні стегна, слід виключити інші причини ішіасу (наприклад, грижа поперекового диска).
Одним з корисних діагностичних засобів є електроміографія. У пацієнта з радикулопатією та ішіасом електроміографічне дослідження повинно виявити аномальну спонтанну електричну активність м’язів-розгиначів спини. При синдромі грушоподібного м’яза електроміограма (ЕМГ) класично нормальна. Якщо компресія сідничного нерва є достатньою, щоб спричинити втрату аксона, аномалії повинні бути в м’язах дистальніше грушоподібної м’язи, а в м’язах спини не повинно спостерігатися електричної активності. Повідомлялося, що спеціальний тест нервової провідності, Н-рефлекс, демонструє аномалії при синдромі грушоподібного м’яза, коли відведення, внутрішня ротація та згинання стегна стискають сідничний нерв; однак цей результат не був відтворений іншими клініцистами. Поставити вірогідний діагноз при синдромі грушоподібного м'яза практично неможливо; таким чином, лікування також є важким.
У деяких пацієнтів, якщо консервативне лікування синдрому грушоподібної м’язи не дає результатів, слід розглянути місцеві ін’єкції анестетиків та/або стероїдів. Додатковим варіантом є хірургічна резекція грушоподібного м’яза; однак деякі пацієнти можуть отримати короткострокові переваги від місцевих ін’єкцій TrP у м’яз без відповіді на інше лікування для тривалого контролю болю. Ця підгрупа пацієнтів може отримати користь від лікування BoNT-A.
Обмежена кількість досліджень оцінює ефективність ботулінічного токсину в лікуванні синдрому грушоподібного м’яза. Наприклад, Чайлдерс та його колеги повідомили про результати подвійного сліпого плацебо-контрольованого перехресного пілотного дослідження ін’єкцій BoNT-A для рефрактерного синдрому грушоподібного м’яза у 9 суб’єктів. Усі пацієнти в цьому дослідженні повідомили про інтенсивність болю понад 3/10 за візуальними аналоговими шкалами болю (VASs) після принаймні 3 місяців невдалого консервативного лікування. Кожному пацієнту в м’яз із симптомами вводили 100 ОД BoNT-A або плацебо (фізіологічний розчин) під флюороскопічним та електроміографічним контролем. Через десять тижнів ін’єкції фізіологічного розчину або BoNT-A були повторені. Основними показниками результату були інтенсивності болю, дистресу, спазму та перешкод у повсякденній діяльності.
На початковому етапі відмінностей між групами виявлено не було, але спостерігалися значні ( P < 0,05) відмінності між середнім значенням 2 мінімальних VAS на початковому етапі та середнім значенням 2 мінімальних VAS (у всіх категоріях) під час 10-тижневого лікування (BoNT -A) група, але не 10-тижнева група плацебо. Крім того, середнє значення лікування BoNT-A було значно покращено (P = 0,0273) порівняно з базовим рівнем/середнім значенням виведення за VAS щоденної діяльності. Дані також свідчать про те, що значне (P = 0,0547) покращення VAS при м’язовому спазмі (P = 0,0547) відбулося в групі BoNT-A, але не в групі плацебо. У сукупності ці результати показали, що порівняно з внутрішньом’язовим фізіологічним розчином ін’єкції BoNT-A зменшили деякі, але не всі повідомлення про біль, пов’язаний з хронічним ПМС.
Методи введення
Терапія ботулотоксином повинна бути індивідуальною для пацієнта та клініциста. Потреби в обладнанні слід визначати відповідно до потреб пацієнта, підготовки клініциста та анатомічної мішені для ін’єкції. Наприклад, лікування блефароспазму зазвичай здійснюється простими підшкірними ін’єкціями навколо ока без використання спеціального обладнання; однак для ін’єкцій у глибокі відділи попереку, наприклад у відділ великого поперекового м’яза, може знадобитися використання спеціальних методів візуалізації.
Для поверхневих м’язів достатньо 1,0 мл туберкулінового шприца з голкою 5/8 дюйма 25 калібру. Для невеликих м’язів (наприклад, м’язів обличчя) достатньо 1-дюймової голки 30-го калібру. Для більших м’язів, таких як підколінні сухожилля, достатньо 1-дюймової або 1,5-дюймової голки 25 калібру.
Для більшості м’язів кінцівок для ідентифікації м’язів, особливо дрібних м’язів передпліччя, рекомендується використання електроміографії або стимуляції рухових точок (e-stim). Наприклад, м’яз-згинач пальців, який зазвичай ін’єктують, майже неможливо визначити без електроміографічного наведення. Для клініциста, який розвиває свої навички визначення конкретних м’язів для ін’єкції ботулінічного токсину, використання простої аудіоелектроніографії може покращити розуміння клініцистом функціональної анатомії та допомогти лікарю прийняти рішення щодо локалізації ін’єкції. Для м’язів, які потребують електроміографічного наведення, використовується канюльований монополярний голчастий катод, через який можна вводити ботулінічний токсин. Поверхневий еталонний (анод) і заземлюючий електрод повинні бути розміщені поблизу катодної голки.
Після розміщення пацієнта в такому положенні, де потрібний м’яз можна розслабити, слід визначити рухову точку. Тоді ботулінічний токсин можна ввести після аспірації, щоб запобігти внутрішньосудинній ін’єкції. Спирт, якщо він використовується для очищення шкіри, повинен повністю висохнути, щоб запобігти дезактивації токсину. Використання операційних або спеціальних процедурних (стерильних) кабінетів, обладнаних приладами моніторингу, для внутрішньом’язових ін’єкцій голками малого калібру не є необхідним. Більшість пацієнтів можуть безпечно лікуватися в офісі досвідченими клініцистами.
Післяін'єкційне спостереження
Якщо протягом 24-48 годин після ін’єкції з’являється будь-який дискомфорт або біль, можна ввести м’язові релаксанти або ацетамінофен. Більш сильні анальгетики зазвичай не потрібні.
ДЖЕРЕЛО: https://emedicine.medscape.com
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Струс головного мозку у дітей та підлітків ...

Завершення весни та літню пору травматолог ...

Вінницький центр RECOVERY готовий щороку р ...

Лікарі визначили найкращу стратегію лікува ...

МОЗ затвердило перші шість клінічних прото ...

Запис семінару «Артроскопія: можливості сь ...