Терапія епітеліальними клітинами амніона людини зменшує спричинене гіпертонією жорсткість судин і когнітивні порушення
Дата публікації: 13.02.2024
Автори: Відкриті джерела , Редакція платформи «Аксемедін»
Ключові слова: когнітивні порушення, епітеліальні клітини, терапія епітеліальними клітинам, епітеліальні клітини амніона

Анотація
Запалення судин і фіброз є характерними ознаками гіпертонії та сприяють розвитку серцево-судинних захворювань і когнітивних порушень. Однак сучасні антигіпертензивні препарати не лікують основного пошкодження тканини, такого як фіброз, пов’язаний із запаленням. Епітеліальні клітини амніона людини мають ряд властивостей, які піддаються лікуванню патології судин. Це дослідження перевіряло вплив епітеліальних клітин амніона на судинну патологію та когнітивні порушення під час гіпертонії. Самцям мишей C57Bl6 (8–12 тижнів) підшкірно вводили фізіологічний розчин; n = 58 або ангіотензин II (0,7 мг/кг/добу, n = 56) протягом 14 днів. Після операції групі мишей внутрішньовенно ввели 10 6 амніонних епітеліальних клітин. Інфузія ангіотензину II підвищувала систолічний артеріальний тиск, швидкість пульсової хвилі в аорті, накопичення аортальних лейкоцитів і експресію мРНК підтипів колагену в аорті порівняно з мишами, яким вводили носій (n = 9–11, P < 0,05). Введення епітеліальних клітин амніона послаблювало ці ефекти ангіотензину II (P <0,05). Індуковані ангіотензином II когнітивні порушення запобігали терапії епітеліальними клітинами амніона (n = 7–9, P <0,05). У мозку епітеліальні клітини амніона модулювали деякі запальні гени, диференційованій експресії яких ангіотензин II сприяв (n = 6, p-скоригований < 0,05). Ці висновки свідчать про те, що епітеліальні клітини амніона можуть бути досліджені як потенційна терапія для пригнічення судинної патології та когнітивних порушень під час гіпертонії.
Вступ
Гіпертонія вражає ~ 30% дорослого населення світу і є основним фактором ризику розвитку серцево-судинних захворювань. Хоча сучасні антигіпертензивні препарати ефективні для зниження артеріального тиску, вони, як правило, не лікують основне пошкодження тканин, наприклад фіброз, пов’язаний із запаленням.
Надмірний фіброз може призвести до жорсткості судин, яка виникає з віком і посилюється при гіпертонії. Жорсткість судин також може передувати гіпертонії і сама по собі є основним незалежним фактором ризику серцево-судинних захворювань. Відомо, що жорсткість аорти, зокрема, сприяє серйозному пошкодженню кінцевих органів, у тому числі в мозку, де це пов’язано з підвищеною частотою когнітивних порушень. Таким чином, терапія, спрямована на фіброз судин, може зменшити тягар гіпертонії та серцево-судинних захворювань, а також зниження когнітивних функцій.
Клітинна терапія може мати переваги перед окремими фармакологічними агентами, оскільки клітини можуть вивільняти декілька медіаторів, які могли б ефективніше впливати на складні механізми захворювання. Епітеліальні клітини амніона походять із шару амніона, який утворює частину мішка, що вміщує плід, що розвивається. Епітеліальні клітини амніона мають ряд переваг перед іншими типами клітин, які розглядаються для терапії, включаючи низьку імуногенність, протипухлинні властивості, неінвазивні процедури екстракції та мінімальні етичні проблеми щодо їх збору та використання. Крім того, епітеліальні клітини амніона мають антифіброзні, протизапальні, антиапоптотичні та проангіогенні властивості, які можуть бути корисними при лікуванні серцево-судинних захворювань.
Реєстрйтесь на вебінар «Проблемність ведення пацієнтів з ІХС та фібриляцією передсердь» від провідного фахівця Іванова Валерія Павловича
Таким чином, ми перевірили, чи може введення епітеліальних клітин амніона обмежити аортальний фіброз і жорсткість під час експериментальної гіпертензії, і чи пов’язаний такий ефект з покращенням пізнання.
Матеріали та методи
Тварини
Мишей випадковим чином розподіляли по групах лікування, і дослідники не визначали групи лікування, де це було можливо. Оскільки відомо, що молоді самки мишей мають притуплену реакцію на інфузію ангіотензину II , це не є надійною моделлю для вивчення потенційної терапії гіпертензії у самок. Таким чином, ми використовували лише самців мишей у цьому дослідженні.
Введення ангіотензину II і вимірювання артеріального тиску
Мишам вводили фізіологічний розчин або ангіотензин II (0,7 мг/кг/день підшкірно) протягом 14 днів за допомогою осмотичного мінінасоса (модель Alzet 2002), імплантованого підшкірно в середню лопаткову область. Мишей анестезували ізофлураном (2–4% інгаляції з киснем [0,4 л/хв]), який доставляли через нагрітий носовий конус і поміщали на тепловий килимок. Глибину анестезії контролювали, спостерігаючи за частотою дихання та перевіряючи відсутність рефлекторної відповіді на пощипування пальця ноги. Під час операції мишам вводили бупівакаїн (2,5 мг/кг підшкірно) у місці операції та карпрофен (5 мг/кг підшкірно). Потім миші отримували карпрофен (5 мг/кг SC) щодня протягом 2 днів після операції.
Систолічний артеріальний тиск контролювали у мишей у свідомості за допомогою плетизмографії манжети хвоста (MC4000 Multichannel system, Hatteras Instruments). Перед операцією мишей тренували протягом 1 дня (тобто в день - 1), щоб акліматизуватися до процедури, а потім реєстрували артеріальний тиск у дні 0 (до операції) і 14 після операції.
Підготовка та ін'єкція епітеліальних клітин амніона
Епітеліальні клітини амніона були виділені з доношеної плаценти, подарованої здоровими добровольцями, які пройшли планове кесарів розтин. Фізіологічний розчин (носій) або 1 × 10 6 епітеліальних клітин амніона вводили в хвостову вену після того, як миші прийшли до тями після імплантації осмотичного мінінасоса. Загалом 7 мишей загинули протягом 5 хвилин після болюсної ін'єкції клітин через ймовірну емболію легеневої артерії.
Оцінка жорсткості аорти
Ультразвукове дослідження черевної аорти проводили на 0-й та 14-й дні після операції за допомогою апарата Vevo 2100 (VisualSonics; FUJIFILM; Канада). Мишей анестезували ізофлураном (2% при 0,4 л/хв) і поміщали на нагріту платформу. З живота видалили шерсть і нанесли на живіт ультразвуковий гель (Aquasonics, США). Доплерівські зображення пульсової хвилі та ретроспективні зображення EKV, отримані в B-режимі, були отримані з поздовжніх зрізів черевної аорти (супраренальної) за допомогою ультразвукового датчика MS-400. Дані експортували, а швидкість пульсової хвилі аналізували за допомогою програмного забезпечення VevoLab і VevoVasc (FUJIFILM Visualsonics Inc. Canada) і методу петлі InD-V.
Проточний цитометричний аналіз лейкоцитів в аорті
Проточну цитометрію проводили, як описано раніше, у тканині мозку, але модифікували для аорти та крові. Мишей вбивали за допомогою асфіксії вуглекислим газом і перфузували через лівий шлуночок 0,2% клексану (400 МО, Sanofi Aventis, Австралія) у 0,01 М фосфатно-сольовому буферному розчині (PBS). Усю аорту (від дуги аорти до біфуркації стегнової кістки) з периваскулярним жиром збирали для проточної цитометрії. Зразки подрібнювали ножицями та розщеплювали в PBS (з MgCl 2 і CaCl 2), що містив суміш колагенази типу XI (125 ОД/мл), колагенази типу IS (460 ОД/мл) і гіалуронідази (60 ОД/мл) (Sigma -Aldrich, США) протягом 30 хв при 37 °C. Потім зразки пропускали через фільтр 70 мкм.
Цільну кров збирали через правий шлуночок у гепаринізовані пробірки. Потім зразки інкубували з 10 мл буфера для лізису еритроцитів (еритроцитів) протягом 5 хвилин при кімнатній температурі на шейкері. Зразки промивали PBS і центрифугували при 4 °C протягом 5 хвилин (1500 об/хв). Це повторювали, щоб переконатися, що еритроцити були видалені із зразка. Потім клітини ресуспендували в 500 мкл PBS.
Експресія генів в аорті
Експресію матричної РНК колагену в аорті визначали за допомогою ПЛР у реальному часі. Аорту збирали й швидко заморожували в рідкому азоті. Аорти обробляли ультразвуком (Life Technologies, США), змішували з хлороформом і центрифугували при 824 × g протягом 15 хвилин при 4 °C. Водну фазу збирали і РНК екстрагували за допомогою (Qiagen, США). РНК кількісно визначали за допомогою спектрофотометра і перетворювали на 1- й ланцюг кДНК за допомогою набору High Capacity cDNA RT Kit. Комерційно доступні праймери використовували для вимірювання експресії мРНК колагену (Col1a1 , Col3a1 , Col4a1 , Col5a1) і гена домашнього господарства, Gapdh , на машині CFX96 Touch Real-Time PCR Detection. Зміни в експресії генів оцінювали за допомогою дельта-дельта CT методу.
Імунолокалізація епітеліальних клітин амніона
Епітеліальні клітини амніона локалізували в аорті за допомогою імуногістохімії. Фіксовані (4% параформальдегід), залиті парафіном грудні зрізи аорти (5 мкм) депарафінізували, інкубували з гістоленом (2 × 10 хв), промивали 100% і 70% етанолом, а потім дистильованою H 2 O. Вилучення антигену проводили за допомогою цитратного буфера (pH 6,0), потім зрізи промивали PBS і ендогенну пероксидазу блокували 1% H 2 O 2 . Ендогенний мишачий IgG блокували за допомогою козячого антимишачого IgG з подальшим блокуванням 10% сироваткою осла у фосфатно-сольовому буфері. Потім зрізи інкубували протягом ночі при 4 °C з анти HLA-G. Наступного дня зрізи промивали та інкубували з кон’югованим з пероксидазою хрону ослячим антимишачим вторинним антитілом (1:200) протягом 45 хвилин при кімнатній температурі. Зрізи промивали PBS та інкубували в коричневому розчині DAB. Після цього зрізи промивали, контрастно фарбували гемотоксіліном і монтували за допомогою монтажного середовища DPX. Зображення були зроблені за допомогою камери Olympus DP73, підключеної до мікроскопа Olympus BX53 зі збільшенням 400 × із стандартним програмним забезпеченням CellSens.
Секвенування РНК мозку
Півкулі мозку були зібрані та швидко заморожені в рідкому азоті. Мозок обробили ультразвуком у TRIzol, змішали з хлороформом і центрифугували при 824 × g протягом 15 хвилин при 4 °C. Водну фазу збирали і РНК екстрагували за допомогою RNeasy® Micro Kit. РНК кількісно визначали за допомогою спектрофотометра NanoDrop One, а потім зберігали при -80 °C. Зразки РНК були відправлені в Сінгапур для підготовки бібліотеки кДНК і секвенування РНК. мРНК очищали від тотальної РНК за допомогою полі-Т олігоприєднаних магнетиків. мРНК перетворювали на кДНК і очищали за допомогою AMPure XP Beads.
Результати
Епітеліальні клітини амніона інфільтрують аорту мишей з гіпертонією
Щоб локалізувати епітеліальні клітини амніона в аорті, ми пофарбували зрізи людським лейкоцитарним антигеном G (HLA-G). Як і очікувалося, не спостерігалося позитивного фарбування на HLA-G у мишей, які отримували інфузію ангіотензину II, яким вводили фізіологічний розчин. Навпаки, HLA-G-позитивні клітини (стрілка у вигляді більшого збільшення) спостерігалися в адвентиції мишей, які отримували інфузію ангіотензину II, які отримали епітеліальні клітини амніона 14 днів тому. У медіальному або інтимальному шарах аорти позитивного фарбування не спостерігалося.
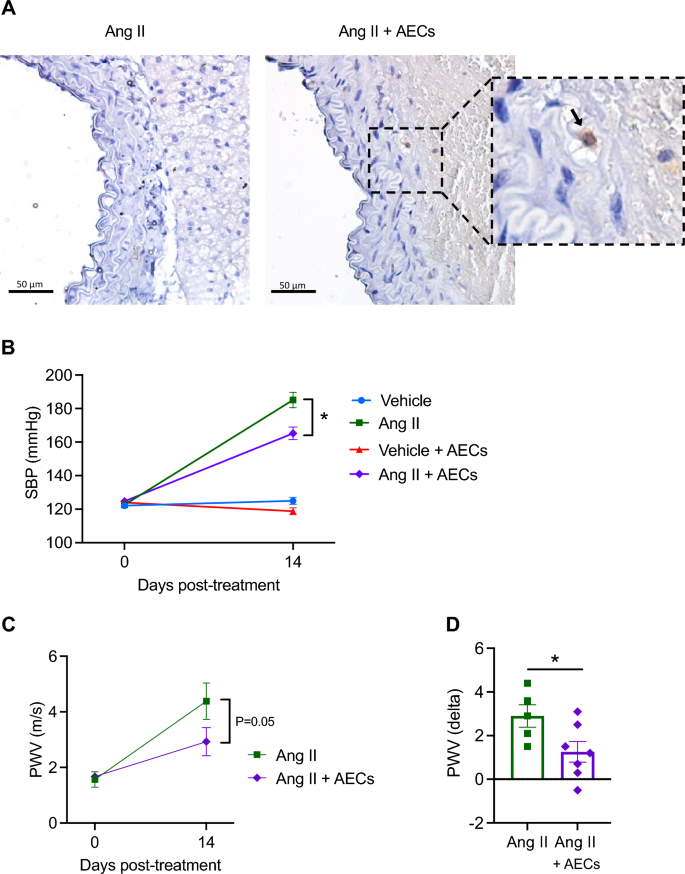
Індукована ангіотензином II гіпертонія та жорсткість аорти зменшуються введенням епітеліальних клітин амніона. (A) Імунне фарбування на HLA-G у мишей, які отримували ангіотензин II і ангіотензин II + амніонні епітеліальні клітини (AEC).
Епітеліальні клітини амніона знижують систолічний артеріальний тиск і швидкість пульсової хвилі в аорті
Інфузія ангіотензину II протягом двох тижнів призвела до підвищення систолічного артеріального тиску ~ 60 мм рт.ст. . Введення епітеліальних клітин амніона притупило реакцію пресора на ангіотензин II на 20 мм рт.ст. Лікування епітеліальними клітинами амніона не впливало на систолічний артеріальний тиск у мишей, яким вводили носій. Швидкість пульсової хвилі в аорті, виміряна за допомогою ультразвукової сонографії, була нижчою у мишей, яким вводили ангіотензин II, яким вводили епітеліальні клітини амніона.
Епітеліальні клітини амніона зменшують проникнення імунних клітин в аорту
Інфузія ангіотензину II збільшила кількість загальних лейкоцитів (CD45+), мієлоїдних клітин (CD11b+;), макрофагів (F4/80) і низьких моноцитів Ly6C (Ly6C+) в аорті. Кількість нейтрофілів аорти (Ly6G+), моноцитів з високим рівнем Ly6C (Ly6C+), Т-клітин (CD3+) і В-клітин (CD19+) не було змінено інфузією ангіотензину II. Введення епітеліальних клітин амніона запобігало індукованому ангіотензином II збільшенню загальної кількості лейкоцитів, мієлоїдних клітин, макрофагів і низьких моноцитів Ly6C у аорти.
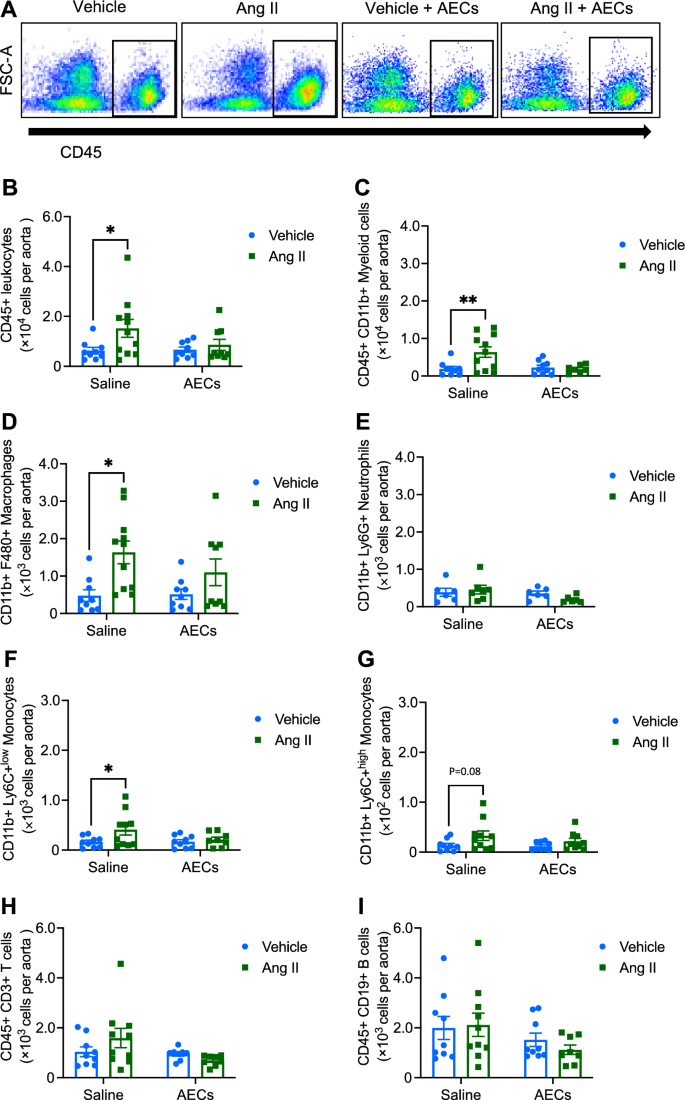
Введення епітеліальних клітин амніона запобігає інфільтрації імунних клітин аорти, індукованій ангіотензином II. (A) Репрезентативні точкові графіки проточної цитометрії, що демонструють стратегію стробування для загальної кількості лейкоцитів (CD45+ високий) з аорти мишей, яким вводили носій, ангіотензин II, носій + амніонні епітеліальні клітини (AEC) і ангіотензин II + AEC. Вплив інфузії ангіотензину II та спільного лікування з AEC на (B) CD45+ лейкоцити, (C) CD11b+ мієлоїдні клітини, (D) F4/80+ макрофаги, (E) Ly6G+ нейтрофіли, (F) Ly6C+ низький рівень моноцитів, (G)) Моноцити з високим вмістом Ly6C+, (H) CD3+ T-клітини та (I) CD19+ B-клітини в аорті (n = 8–11). Усі дані є середніми ± SEM * P <0,05. Двосторонній ANOVA з тестом Сідака.
Крім того, ми кількісно визначили циркулюючі лейкоцити. Ми не спостерігали жодних змін у CD45+ лейкоцитах у мишей з гіпертензією, які отримували епітеліальні клітини амніона (ангіотензин II: 1,1 ± 0,4 × 10 6 проти ангіотензину II + епітеліальні клітини амніона: 1,1 ± 0,7 × 10 6 клітин на мл крові. n = 4–5 на групу).
Епітеліальні клітини амніона покращують робочу пам'ять у гіпертонічних мишей
Ні % часу, проведеного у внутрішній зоні, ні загальна пройдена відстань не зазнали впливу гіпертензії або введення епітеліальних клітин амніона. Неушкоджену робочу пам’ять було визначено як витрати значно понад 50% часу взаємодії на дослідження нового об’єкта. Репрезентативні теплові карти для кожної групи лікування з розташуванням нових і знайомих об’єктів показані на. Миші, введені в транспортний засіб, витрачали більше часу (~ 60%) на взаємодію з новим об’єктом, ніж зі знайомим об’єктом (t-тест одного зразка проти 50%), тоді як миші, яким вводили ангіотензин II, не розрізняли нові та знайомі об’єкти. Терапія епітеліальними клітинами амніона не вплинула негативно на продуктивність мишей, яким вводили носій. Крім того, введення епітеліальних клітин амніона мишам, яким вводили ангіотензин II, призвело до більшої кількості часу, витраченого на взаємодію з новим об’єктом, ніж зі знайомим об’єктом.
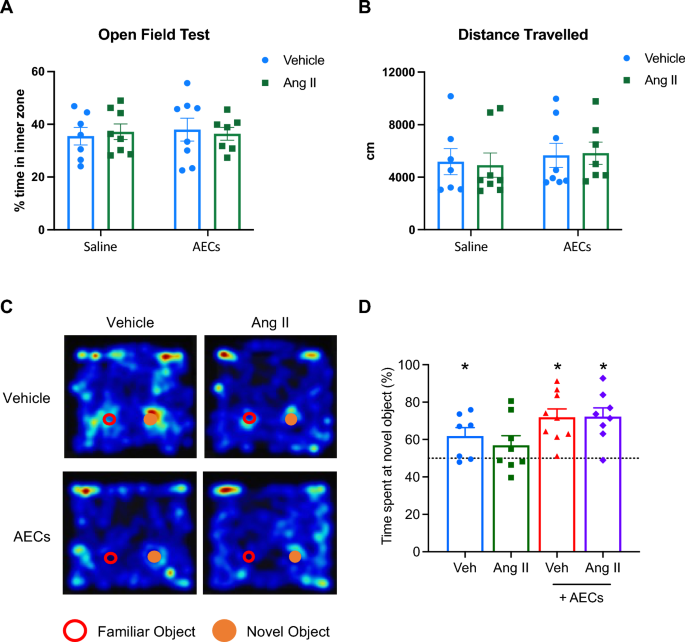
Введення епітеліальних клітин амніона покращує індуковане ангіотензином II когнітивне порушення. (A) Відсоток часу, проведеного у внутрішній зоні під час випробувань у відкритому полі. (B) Загальна пройдена відстань (у см) у відкритому польовому тесті (C) Репрезентативні графіки теплової карти, що демонструють взаємодію між знайомими та новими об’єктами у мишей, яким вводили носій, ангіотензин II, носій + амніон епітеліальних клітин (AEC) і ангіотензин II + AEC . (D) Вплив інфузії ангіотензину II та спільного лікування AEC на пам’ять розпізнавання (n = 7–9). Усі дані є середніми ± SEM * P <0,05. Т-критерій для однієї вибірки проти 50%.
Епітеліальні клітини амніона модулюють експресію генів у мозку
Масове секвенування РНК проводили на мозку мишей, яким вводили носій, ангіотензин II, носій + амніонні епітеліальні клітини або ангіотензин II + амніонні епітеліальні клітини. Теплова карта, що показує всі диференціально експресовані гени. Порівнюючи мишам, яким вводили тільки ангіотензин II, і тільки носій, було виявлено 341 диференціально експресований ген (168 з підвищеною регуляцією та 173 зі зниженою) у мозку. У мозку було виявлено 365 диференціально експресованих генів (183 з підвищеною регуляцією та 182 зі зниженою регуляцією) під час порівняння мишей, яким вводили лише ангіотензин II, з епітеліальними клітинами ангіотензину II + амніона.
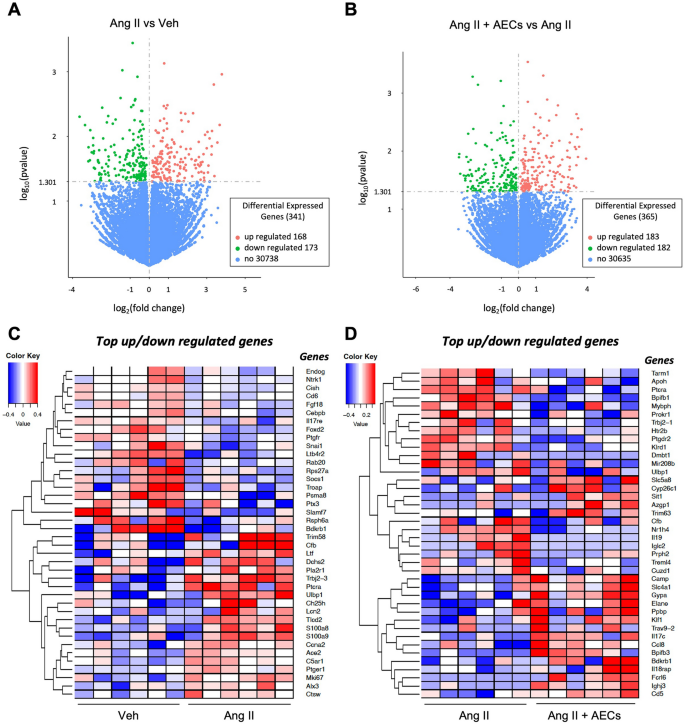
Введення епітеліальних клітин амніона модулює гени, які по-різному експресуються в мозку шляхом інфузії ангіотензину II. Вулканічний графік диференціально експресованих генів у мозку мишей, яким введено (A) транспортний засіб проти ангіотензину II або (B) ангіотензин II проти ангіотензину II + AEC. Поріг диференціальної експресії становить p -value < 0,05. Горизонтальна вісь — це log2-кратна зміна генів. Вертикальна вісь – статистична значущість, масштабована як − log 10 p -значення. Кожна крапка представляє окремий ген (синій: немає істотної різниці; червоний: підвищена експресія; зелений: знижена експресія). Верхні гени з підвищеною та зниженою регуляцією в мозку мишей, яким вводили (C) транспортний засіб проти ангіотензину II або (D) ангіотензин II проти ангіотензину II + AEC (n = 6 на групу). Гени з підвищеною регуляцією позначено червоним, а гени зі зниженою регуляцією – синім. Колірна шкала представляє значення log10 (середнє FPKM + 1).
Подальший аналіз генів, пов’язаних із запаленням, показав, що до генів, які ангіотензин ІІ найбільше знижує регуляцію порівняно з носієм, належать ендонуклеаза G (Endog), рецептор нейротрофічної тирозинкінази (Ntrk1), білок, що містить цитокін SH2 (Cish), антиген CD6 (Cd6), CCAAT підсилювач зв’язуючого білка бета (Cebpb), рецептор інтерлейкіну 17 E (Il17re), рецептор лейкотрієну B4 2 (Ltb4r2), супресор передачі сигналу цитокінів 1 (Socs1), пентразин 3 (Ptx3) і член родини SLAM 7 (Slamf7). Найвищі гени активованої регуляції після інфузії ангіотензину II включали фактор комплементу B (Cfb), лактотрансферин (Ltf), пов’язаний з таксовим кадгерином 2 (Dchs2), бета-рецептор Т-клітин, що приєднується до 2-3 (Trbj2-3), пре-Т-клітинний рецептор антигену альфа (Ptcra), білок 1, що зв’язує UL16 (Ulbp1), 25-гідроксилаза холестерину (Ch25h), ліпокалін 2 (Lcn2), білок, що зв’язує кальцій, S100 A8 (S100a8), білок, що зв’язує кальцій, S100, A9 (S100a9), ангіотензинперетворюючий фермент 2 (Ace2), рецептор комплементу C5a 1 (C5ar1) і катепсин W (Ctsw).
Обговорення
Основний висновок цього дослідження полягає в тому, що епітеліальні клітини амніона можуть запобігти жорсткості аорти, запаленню та когнітивним порушенням, викликаним гіпертонією. Зокрема, епітеліальні клітини амніона обмежують реакцію пресора на ангіотензин II, запобігають інфільтрації імунних клітин аорти, спричиненій ангіотензином II, і експресії колагену, запобігають погіршенню робочої пам’яті та модулюють транскриптомні зміни в мозку, індуковані ангіотензином II. Наші висновки узгоджуються з деякими відомими протизапальними та антифіброзними властивостями епітеліальних клітин амніона. Таким чином, епітеліальні клітини амніона можуть бути потенційним терапевтичним варіантом для профілактики або лікування спричинених гіпертензією пошкоджень судин і когнітивних розладів.
Епітеліальні клітини амніона притупили реакцію пресора на ангіотензин II на 20 мм рт. Раніше було виявлено, що епітеліальні клітини амніона запобігають легеневій гіпертензії при експериментальному пошкодженні легень. Наскільки нам відомо, це дослідження є першим у дослідженні впливу епітеліальних клітин амніона на модель системної гіпертензії. Ефект епітеліальних клітин амніона на зниження артеріального тиску може бути принаймні частково зумовлений їх імуномодулюючими властивостями. На цей момент існує велика кількість доказів, що підтверджують роль імунної системи в гіпертонії, з імунними клітинами, такими як Т-клітини і макрофаги які, як було продемонстровано, сприяють розвитку гіпертонії. У цьому дослідженні ангіотензин II сприяв інфільтрації лейкоцитів (зокрема макрофагів і запальних моноцитів) в аорту, і цьому можна було запобігти шляхом спільного введення епітеліальних клітин амніона. Раніше ми показали, що епітеліальні клітини амніона є домом для місць гострого ушкодження (тобто інсульту або черепно-мозкової травми). У цьому дослідженні ми ідентифікували епітеліальні клітини амніона в аорті, які ми та інші показали як місце запалення та пошкодження під час гіпертонії. Оскільки гіпертонія викликає системне ураження, також можливо, що епітеліальні клітини амніона мігрують в інші тканини. Ми також показали, що антагоніст CCR2 знижує артеріальний тиск і кількість аортальних макрофагів у мишей, яким вводили ангіотензин II. Подібним чином, виснаження моноцитів і макрофагів через лікування клодронатом або низькими дозами дифтерійного токсину послаблювало пресорну реакцію на ангіотензин II, і це було відновлено адоптивним перенесенням моноцитів. Крім того, ми повідомили, що ці клітини мають протизапальні властивості на тваринних моделях травми легенів та інсульту. У цьому дослідженні епітеліальні клітини амніона зменшили інфільтрацію макрофагів і моноцитів в аорті. Епітеліальні клітини амніона можуть пригнічувати міграцію макрофагів in vitro шляхом вироблення фактора, що інгібує міграцію макрофагів (MIF). Раніше ми продемонстрували, що епітеліальні клітини амніона можуть зменшити інфільтрацію макрофагів у мишачій моделі пошкодження легенів і зменшити хемотаксис макрофагів до рекомбінантного мишачого макрофагального запального білка 2 in vitro. Отже, можливо, що епітеліальні клітини амніона в цьому дослідженні зменшили інфільтрацію аортальних макрофагів принаймні частково, пригнічуючи їх міграцію. Епітеліальні клітини амніона не впливають на проліферацію або виживання макрофагів. Таким чином, антигіпертензивний ефект епітеліальних клітин амніона може бути частково зумовлений їхньою здатністю пригнічувати інфільтрацію клітин вродженого імунітету в аорту.
Загалом, це дослідження продемонструвало, що епітеліальні клітини амніона можуть знижувати систолічний артеріальний тиск, посилення судин, запалення та когнітивні порушення у мишей, яким вводили ангіотензин II. Зокрема, ми припускаємо, що захисний ефект епітеліальних клітин амніона проти розвитку жорсткості аорти міг бути важливим фактором, що сприяє збереженню когнітивних функцій під час гіпертонії.
ДЖЕРЕЛО: https://www.nature.com/
Щоб дати відповіді на запитання до цього матеріалу та отримати бали,
будь ласка, зареєструйтеся або увійдіть як користувач.
Реєстрація
Вхід
Матеріали з розділу

Генетичний контроль кишкового мікробіому: ...

Зростання випадків вроджених вад серця піс ...
Ціна фармакологічного схуднення: аналоги G ...

Діагностика і лікування ФП та ТП: Тріпотін ...

Модель штучного інтелекту визначає резисте ...

Канабіс і серце: нові дані про подвійний р ...



